Tema 3 – A hidrosfera e o equilíbrio iônico da água e o pH
Em uma solução aquosa, a água sofre uma autoionização formando sempre dois íons (H3O+ e OH–).
2 H2O ↔ H3O+ e OH–
Segundo a teoria de Arrhenius, os ácidos são compostos que reagem com água e sofrem ionização, originando como único cátion o hidrônio (H3O+(aq)).
No entanto, Arrhenius não concluiu que todas as substâncias moleculares não podem sofrer dissociação iônica, pois em um de seus experimentos ele viu que o HCl, que é um composto molecular, reage com a água formando íons positivos e negativos, conforme mostrado abaixo.
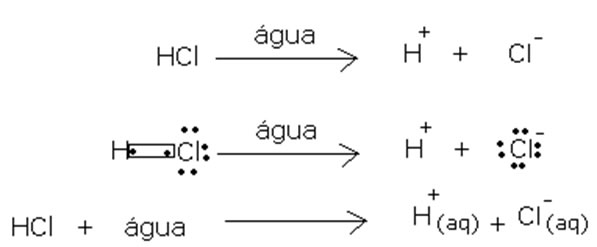
Equação química da ionização do ácido clorídrico na água
Definição de base de Arrhenius: Bases são compostos que em solução aquosa sofrem dissociação iônica, liberando como único íon negativo o ânion hidróxido (OH–), ou oxidrila ou hidroxila.
Exemplo: NaOH → Na+ + OH–
Definição de sal de Arrhenius: Sais são compostos iônicos que possuem, pelo menos,um cátion diferente de H+ e um ânion diferente de OH–.
Exemplo: NaCl (sal de cozinha) → Na+ + Cl–
Assim, para ser ácida, uma solução deve ter uma concentração maior de cátions H3O+do que de OH– livres em seu meio, e o contrário ocorre com as soluções básicas.
Ácidas: [H3O+] > [OH–]
Básicas: [H3O+] < [OH–]
No caso da água, a quantidade desses íons no meio é igual ([H3O+] = [OH–]), por isso, ela é neutra.Isso nos ajuda a entender melhor a escala de pH, que costuma ser usada entre os valores de 0 a 14, em temperatura de 25ºC.
A temperatura precisa ser especificada porque ela altera a quantidade de íons no meio. Se aumentarmos a temperatura, por exemplo, a energia das partículas também aumentará. Por isso, elas se movimentarão mais rápido, o que resultará em um maior número de choques entre elas e, portanto, em uma maior quantidade de íons produzidos.
Mas existem várias substâncias diferentes no cotidiano, além de soluções químicas usadas em laboratórios e indústrias que apresentam diferentes níveis de acidez e basicidade. Só para citar um exemplo, o café é ácido, mas quase todos sabem que o ácido sulfúrico é um ácido bem mais forte que o café.
Assim, para medir o grau de acidez e de basicidade das soluções, foram criadas as escalas de pH e pOH, respectivamente.
A sigla pH significa potencial (ou potência) hidrogeniônico e indica o teor de íons hidrônio (H3O+(aq)) livres por unidade de volume da solução. Quanto mais hidrônios houver no meio, mais ácida será a solução. Por consequência, podemos dizer que quanto mais íons OH–(aq) houver no meio, mais básica ou alcalina será a solução.
Importância do controle da acidez de soluções (pH)Saúde humana:
O pH do sangue humano precisa estar em seu limite ideal de 7,4 para absorver os minerais necessários à saúde daquele indivíduo. Qualquer alimento sólido, ou líquido, que prejudique o equilíbrio do pH ideal estará comprometendo a saúde.
Assim, o pH do sangue humano está inteiramente relacionado à saúde. Uma pequena variação do pH dá oportunidade a uma redução do seu sistema imunológico, dando oportunidade para que seres vivos prejudiciais à nossa saúde, como vírus, bactérias, fungos, que vivem em meios ácidos, com pH abaixo de 7,0 proliferem e encontrem ambiente propício para sobreviver.
A maior parte das pessoas acometidas de câncer apresentam um pH no tecido de 4,5. Em resumo, estando o pH do nosso sangue abaixo da normalidade 7,4 estamos propensos a todos os tipos de doenças: Câncer, artrite, diabetes, doenças do coração, fadiga crônica, alergias, além de doenças causadas por vírus, bactérias e fungos.Uma maneira de manter o seu pH é evitar alimentos com pH baixo, como café (em torno de 4,0), refrigerante (em torno de 2,0), cerveja (varia de 2,5 a 4,2 dependendo da marca).Açúcar é um grande rebaixador de pH. Uma água mineral de boa qualidade pode suprir todas essas carências, no entanto precisa ter as seguintes qualidades: ter pH entre 7,0 e 7,5, e ser rica em minerais.
Solo
O solo vem sofrendo várias agressões e por isso fica desequilibrado, doente. Um desequilíbrio frequentemente encontrado é a acidez do solo, responsável por grandes prejuízos para o agricultor e em consequência, ao homem que está no final da cadeia alimentar.A acidez do solo, ou o pH baixo do solo faz com que a planta deixe de absorver determinados minerais e por isso, aparecem doenças nas plantas.
Numa piscina o controle de pH inibe o aparecimento de micro-organismos que podem causar micoses e outras doenças.Num laboratório o controle de pH é usado para controle de titulações e outras dosagens.
Medir ou alterar um pH é uma tarefa elementar para indústrias, na indústria de alimentos é usado para que os produtos tenham maior durabilidade.Numa estação de tratamento de água, há controle de pH para que a água servida à população esteja dentro dos padrões desejados.
Conceito de pH e pOH
Para medir os níveis de acidez e alcalinidade das soluções, utilizam-se as escalas de pH e pOH, que medem os teores dos íons H+ e OH- livres por unidade de volume da solução.
Medição de pH de solução em laboratório com o uso de uma tira de indicador universal
Veja a escala de pH a seguir e algumas soluções do cotidiano com o seu pH aproximado:
.jpg)
Escala de pH com exemplos de soluções com pH próximo ao indicado
A escala de pH é definida como o logaritmo negativo da concentração de íons H3O+, ou H+, na base 10. Quanto menor o valor do pH, mais ácida é a solução.
Veja como ele pode ser determinado a seguir:
colog [H+] = – log [H+]
pH = – log [H+]
[H+] = 10-pH, em mol/L
Se temos uma solução de concentração igual a 0,01 mol . L1-, por exemplo, isso quer dizer que seu pH é igual a 2. Veja:0,01 mol . L1-= 10-2 mol . L1-
10-2 mol de H3O1+ ———- 1000 mL
pH = – log [H3O1+]
pH = – log [10-2]
pH = – (-2)
pH = 2
Os cálculos acima também nos levam à conclusão de que, a cada unidade de pH diminuída, a solução fica com 10 vezes menos íons H3O+. Se temos uma solução com pH igual a 2 e outra com pH igual a 3, por exemplo, a primeira possui dez vezes mais íons hidrônio do que a segunda.
Agora vamos falar sobre o pOH ou potencial hidroxiliônico.
Essa escala refere-se à concentração dos íons OH– na solução. Analogamente ao cálculo que mostramos para o pH, temos para o pOH:
pOH = – log [OH–]
[OH–] = 10-pOH, em mol/L
Voltando à autoionização da água, temos que a água destilada (totalmente pura) possui pH igual a 7, por isso, é neutra. Dessa forma, o seu pOH também é igual a 7, pois, conforme dito, a concentração desses dois íons na água é igual. À temperatura ambiente de 25ºC, o Kw (produto iônico da água) é igual a 1,0 . 10-14 (mol/L)2. Sendo assim, chegamos à seguinte conclusão para a água:
Kw = [H+] . [OH–] = 1,0 . 10-14 mol/L
[H+] = [OH–] = 1,0 . 10-7 mol/LpH = – log [H+] pOH = – log [OH–]
pH = – log 1,0 . 10-7 pOH = – log 1,0 . 10-7
pH = 7 pOH = 7
Visto que, como mostrado acima, [H+] . [OH–] = 1,0 . 10-14 mol/L, então,em todos os casos, sejam as soluções ácidas, básicas ou neutras, a soma do pH com o pOH sempre resulta em um total de 14.
Veja como isso é verdadeiro quando aplicamos o fator (-log) nos dois lados da equação:
– log ([H+] . [OH–]) = – log 1,0 . 10-14
– log [H+] – log[OH–] = 14
pH + pOH = 14
Se temos uma solução ácida, por exemplo, com pH igual a 4, sabemos que o seu pOH é igual a 10. Os valores de 0 a 14 da escala de pH podem ser medidos precisamente por meio de um equipamento chamado pHmetro (também chamado de peagômetro)
 PHmetro usado em laboratório para medir o pH de uma solução básica.
PHmetro usado em laboratório para medir o pH de uma solução básica.
Porém, em muitos casos, são utilizados também indicadores ácido-base, ou seja, substâncias que mudam de cor de acordo com o pH da solução. Um indicador ácido-base sintético, por exemplo, é a fenolftaleína, que apresenta cor rosa quando está em contato com um meio básico, mas fica incolor se o meio é ácido.Outros dois indicadores são o papel de tornassol, que fica vermelho na presença de ácidos e azul na presença de bases, e o indicador universal, que apresenta cores diferentes para cada valor de pH.
.jpg)
Exercícios Sobre pH E pOH
Para resolver estes exercícios sobre pH e pOH, é necessário conhecer bem as características dessas grandezas que determinam a acidez e a basicidade de um sistema aquoso.
Questão 1
(UnB-DF) Os sistemas químicos baseiam-se em algumas características. Os sistemas ácidos caracterizam-se pela liberação de íon hidrônio,H3O1+(aq). Os sistemas básicos baseiam-se na liberação de íon hidroxila, OH –(aq). A tabela a seguir mostra a característica de alguns sistemas.
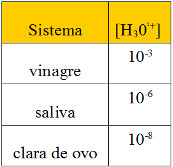
Tabela em exercício de pH
Considerando os sistemas citados, 100% ionizados, julgue os itens abaixo.
0. Todos os sistemas são formados por substâncias ácidas.
1. O pOH da saliva é igual a 6.
2. O vinagre é mais ácido que a clara de ovo.
3. O pH do vinagre é igual a 3.
4. Acrescentando uma gota de vinagre a uma gota de saliva, a solução se tornará neutra.
Questão 2
(UFPE) A concentração hidrogeniônica do suco de limão puro é 10-3 mol/L. Qual o pH de um refresco preparado com 20 mL de suco de limão e água suficiente para completar 200 mL?
a) 2,5
b) 3,0
c) 3,5
d) 4,0
e) 4,5
Questão 3
Considere uma solução 0,01 mol . L1- de um monoácido forte genérico HA e indique a alternativa correta.
a) O pH é igual a 1.
b) O pH é menor que 1.
c) O pH é maior que 1.
d) [HA] é muito maior que [A–].
e) [A–] = 0,1 mol . L1-.
Questão 4
Indique se as afirmativas a seguir são verdadeiras ou falsas. Considere a temperatura de 25ºC e KW = 1 . 10-14.
a) Uma solução com [H+] > 1 . 10-7 mol . L-1 apresenta pH > 7.
b) Uma solução com [H+] > 1 . 10-7 mol . L-1 apresenta caráter ácido.
c) Uma solução de hidróxido de sódio (base forte) apresenta pH maior que 7, qualquer que seja sua concentração.
d) Uma solução de ácido sulfúrico (ácido forte) apresenta pH menor que 7, qualquer que seja sua concentração.
e) Uma solução de pH = 9 apresenta concentração de OH– = 1 . 10-5 mol . L-1.
Respostas
Resposta Questão 1
0. Falso. Vamos calcular o pH de cada sistema:
| Vinagre:
pH = – log [10-3] |
Salina:
pH = – log [10-6] |
Clara de ovo:
pH = – log [10-8] |
Portanto, a clara de ovo forma um sistema básico.
1. Falso.
pH + pOH = 14
pOH = 14 – pH
pOH = 14 – 6
pOH = 8
2. Verdadeiro.
3. Verdadeiro.
4. Falso. Acrescentando uma gota de vinagre a uma gota de saliva, a solução torna-se ainda mais ácida.
Alternativa “d”.
A concentração inicial era de 10-3 mol/L ou 0,01 mol/L.
Antes da diluição:
10-3 mol de H3O1+ ———- 1000 mL
x ———————- 20 mL
x = 2 . 10-5 mol de H3O1+ em 20 mL
Depois da diluição:
2 . 10-5 mol de H3O1+———- 200 mL
y ———————- 1000 mL
y = 10-4 mol de H3O1+ em 1000 mL
pH = – log [H3O1+]
pH = – log [10-4]
pH = – (-4)
pH = 4
Alternativa “c”.
0,01 mol . L1-= 10-2 mol . L1-
10-2 mol de H3O1+ ———- 1000 mL
pH = – log [H3O1+]
pH = – log [10-2]
pH = – (-2)
pH = 2
Resposta Questão 4
a) Falsa. Uma solução com [H+] > 1 . 10-7 mol . L-1 apresenta pH < 7, pois é uma solução ácida.
b) Verdadeira.
c) Falso. Em uma diluição infinitesimal o pH tende a ficar próximo a 7.
d) Falso. Em uma diluição infinitesimal o pH tende a ficar próximo a 7.
e) Verdadeira.
Estudo do Carbono
Química Orgânica
 A Química Orgânica ajuda-nos a entender as estruturas e as propriedades das moléculas formadas por cadeias carbônicas
A Química Orgânica ajuda-nos a entender as estruturas e as propriedades das moléculas formadas por cadeias carbônicasA Química Orgânica recebeu inicialmente esse nome para descrever substâncias extraídas de organismos vivos. Acreditava-se que elas só podiam ser produzidas em organismos vegetais e animais, mas nunca em laboratório.
Entretanto, provou-se que o homem conseguia sim sintetizar compostos orgânicos em laboratório, e então a definição de Química Orgânica mudou para:
“Ramo da Química que estuda a maioria dos compostos formados pelo elemento carbono”.
O carbono é o elemento básico para o estudo da química orgânica, tema que costuma ser muito cobrado no Enem. Localizado no grupo 14 (família IVA), o carbono possui seis elétrons, sendo quatro destes localizados em sua camada de valência. Desta forma, o carbono, tetravalente, realiza quatro ligações covalentes para adquirir sua estabilidade química. Pode-se ligar com outros átomos de carbono, encadeando-se, para formar tipos inúmeros de cadeias. O átomo de carbono se liga a hidrogênio e, a outros elementos comuns em compostos orgânicos como o oxigênio (O), nitrogênio (N), enxofre (S), halogênios (Cl, Br, F, I), etc.
Tais compostos são agrupados em diferentes funções que apresentam propriedades químicas semelhantes, tais como os hidrocarbonetos, os álcoois, as cetonas, os aldeídos, os ácidos carboxílicos, os ésteres, os éteres, as aminas, as amidas, entre outros.
Veja nesta subseção como identificar cada uma dessas funções, onde elas estão presentes em nossa sociedade, a realizar a nomenclatura dos compostos orgânicos segundo as regras estabelecidas pela IUPAC, como ocorre o fenômeno da isomeria em muitas dessas substâncias e o que são os polímeros naturais e artificiais que formam os plásticos tão comuns em nosso cotidiano.
Classificação do Carbono
A classificação do carbono é baseada na quantidade dos demais átomos de carbono ligado a ele e também no tipo de ligação.
O carbono pode ser classificado seguindo vários critérios: um deles se baseia na quantidade dos demais átomos de carbono a ele ligados.
Carbono primário: ligado diretamente, no máximo, a 1 outro carbono;
Carbono secundário: ligado diretamente a 2 outros carbonos
Carbono terciário: ligado diretamente a 3 outros carbonos;
Carbono quaternário: ligado diretamente a 4 outros carbonos.
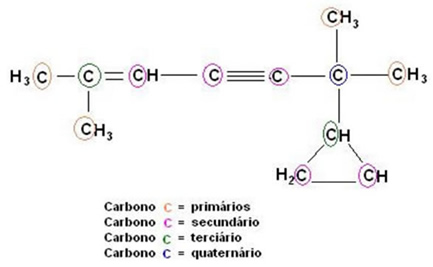
A outra classificação se refere aos tipos de ligação que unem os carbonos.
O carbono pode ser classificado em função das ligações que apresenta:
a) Carbono Saturado: apresenta somente ligações simples, chamadas de sigma (σ).
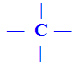
b) Carbono Insaturado: presença de duplas ligações, denominadas de pi (π). Ou ainda, carbono que apresenta ligação tripla.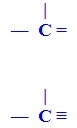
Composição: o C é o principal elemento, incluem também o H, N, O, S, P e ainda os halogênios.
Características: em geral os compostos orgânicos são covalentes apolares. A presença de um elemento diferente do C e H promove certa polaridade na molécula.
H H
Ex.: H – C – H H – C – OH
H H
Apolar Polar
CARACTERÍSTICAS GERAIS
Ponto de fusão e ebulição: inferiores aos compostos inorgânicos, a maioria apresenta instabilidade térmica.
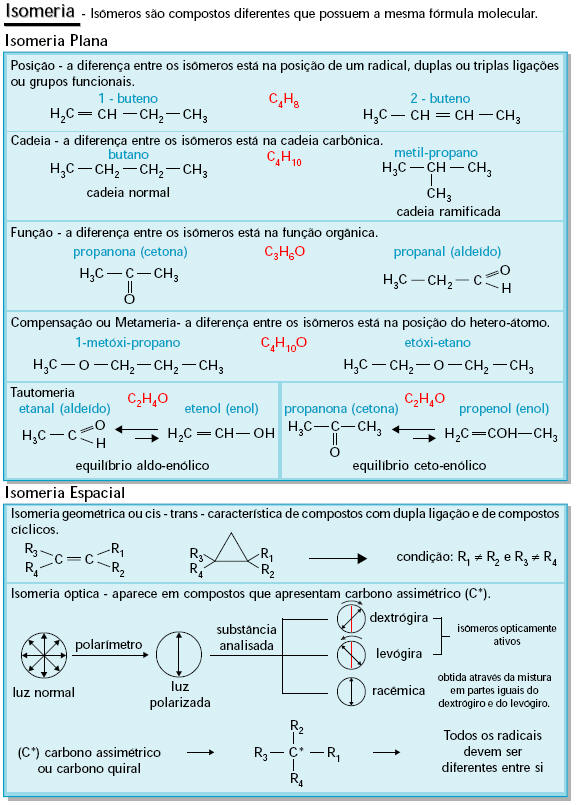
Isomeria: compostos com a mesma fórmula molecular.
Solubilidade: os apolares pouco solúveis em água, os polares solúveis, a exemplo do álcool e açúcar.
Combustibilidade: em geral são combustíveis.
Encadeamento: em função da tetravalência do C tendem a formar estruturas denominadas cadeias carbônicas.
Velocidade de reação: pouco reativos, dependem de ativadores (luz, calor, pressão, catalisadores, etc.).
Postulados de Couper – Kekulé
Tais postulados foram propostos no século XIX e são resultantes do trabalho de diversos cientistas, em especial, do químico Archibald Scott Couper e, claro, do próprio Kekulé. Assim, é comum também denomina-los Postulados de Couper-Kekulé.
Postulados do Carbono
Por que é importante estudar a fundo o Carbono? Este elemento é a unidade fundamental dos compostos orgânicos, tudo se explica por suas propriedades únicas.
O comportamento químico do carbono começou a ser explicado através dos estudos de dois cientistas do século XIX, Archibald Scott Couper (1831-1892) e Friedrich August Kekulé (1829-1896). Estes estudiosos deram nome aos postulados de “Couper-Kekulé”, vamos conhecer agora as propriedades do carbono detalhadas por este conceito:
1° postulado: O átomo de carbono é tetravalente
A tetravalência do carbono é sua propriedade de formar quatro ligações covalentes, ou seja, ele disponibiliza quatro elétrons ligantes. Isso porque em sua camada de valência o átomo de carbono possui 4 elétrons livres.
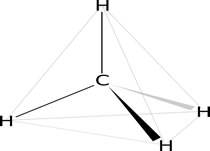
Metano: molécula formada pela ligação de 4 átomos de Hidrogênio (H) a 1 átomo de carbono (C).
2° postulado: As quatro unidades de valência do carbono são iguais entre si.
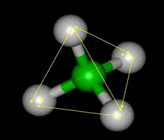
O Fluorometano é um exemplo desta propriedade, só existe um composto com este nome, ele é formado pela substituição de um hidrogênio da molécula de Metano por um átomo de Flúor (F). O Flúor poderá substituir qualquer H da molécula que receberá a mesma nomenclatura, repare na ilustração abaixo:
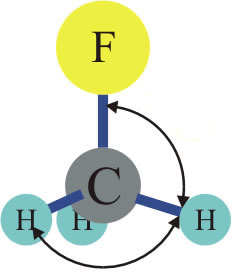
Qualquer posição ocupada pelo átomo de Flúor dará origem ao Fluorometano.
3° postulado: Propriedade de encadeamento – capacidade que átomos de um mesmo elemento têm de formar cadeias moleculares.
.jpg)
Átomos de carbono ligam-se diretamente entre si, formando estruturas denominadas cadeias carbônicas. A variedade de compostos orgânicos existentes na natureza se deve a esta propriedade do Carbono de formar cadeias. O composto acima (decano) é formado por 10 átomos de C interligados.
O carbono não é o único elemento químico que pode formar encadeamentos: alguns outros elementos como o enxofre e o nitrogênio, por exemplo, também apresentam essa característica. No entanto, somente o carbono pode constituir cadeias tão diversificadas, extensas e quimicamente estáveis.
A tetravalência do carbono, sua capacidade de se ligar com vários tipos de elementos químicos e de formar cadeias carbônicas são as propriedades responsáveis pelo enorme número de compostos orgânicos já conhecidos. Por isso, a Química Orgânica é definida como a área da Química que trata dos compostos de carbono com características específicas.
Classificação das cadeias carbônicas
As cadeias carbônicas podem se classificam através de vários fatores:
1- Cadeia aberta e fechada
Cadeia aberta ou acíclica
Nessa cadeia, os átomos de carbono não formam ciclo.
Cadeia fechada ou cíclica
Nessa cadeia, os átomos de carbono formam ciclo ou anéis.
II) Classificação das cadeias acíclicas ou abertas
A) Quanto à disposição dos átomos
Cadeia acíclica normal ou reta:
A única que apresenta átomos de carbono primário e secundário, com duas extremidades.
Cadeia acíclica ramificada:
Apresenta pelo menos um átomo de carbono terciário ou quaternário, com mais de duas extremidades.
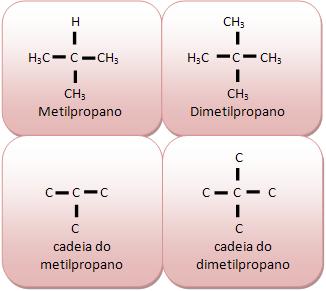
A cadeia do composto ao lado apresenta átomos de carbono primário e secundário com três extremidades considerada ramificada.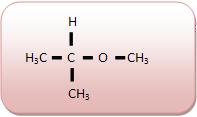 |
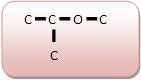
B) Quanto à natureza dos átomos
Cadeia homogênea:
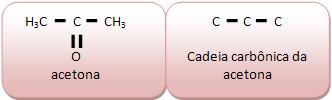
Não apresenta átomos diferentes de caborno intercalados na cadeia, como as cadeias carbônicas de metilpropano e dimetilpropano, acetona e glicerol.
Cadeias heterogênea:
Apresenta átomos diferentes de carbono intercalados na cadeia. Os átomos diferentes recebem o nome de heteroátomos.
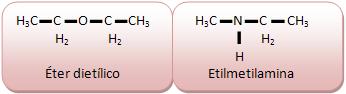
O oxigênio e o nitrogênio são considerados heteroátomos das referidas cadeias carbônicas. Somente os átomos com valência maior que 1 podem ser heteroátomos.
C) Quanto ao tipo de ligação entre os átomos de carbono
Cadeia saturada:
Os átomos de carbono ligam-se entre si, por ligações, como todas as cadeias carbônicas dos compostos mencionados até o momento.
Cadeia insaturada ou não-saturada
Apresenta uma dupla ou tripla ligação entre átomos de carbono.
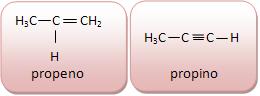
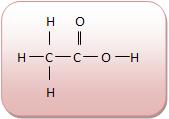
A cadeia carbônica do ácido acético é homogênea, pois entre os átomos de carbono não existe nenhum heteroátomo e na saturada entre os dois átomos de carbono existe apenas uma ligação simples. Vejamos:
III) Classificação das cadeias cíclicas ou fechadas
A) Quanto à natureza dos átomos
Cadeia homocíclica ou cíclica homogênea: em seu anel existem apenas átomos de carbono.
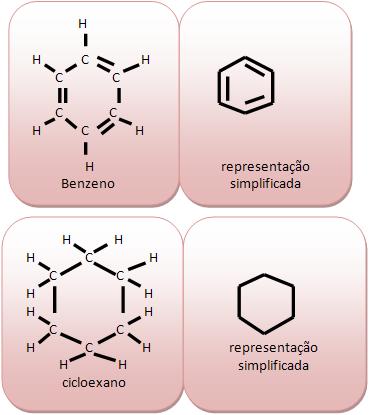
Cadeia heterocíclica ou heterogênia: em seu anel existem átomos diferentes de carbono. Vejamos:
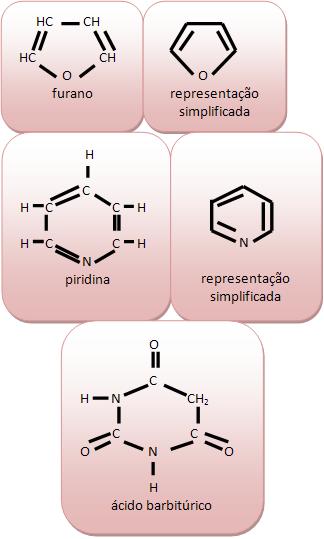
B) Classificação das cadeias homocíclicas
O benzeno (C6H6) é um líquido incolor, que tem odor agradável, mas com vapores átoxicos, imiscíveis com água. Normalmente é usado como solvente, na fabricação de corantes, plásticos, medicamentos, explosivos. Encontrado no alcatrão de hulha, uma das frações provinientes da destilação seca da hulha, carvão mineral contendo aproximadamente 80% de carbono.
A molécula do benzeno (C6H6) é composta por seis átomos de carbono, que são ligados alternadamente, por simples e duplas ligações.
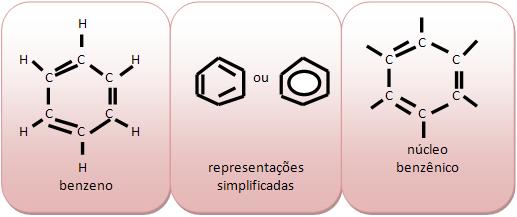
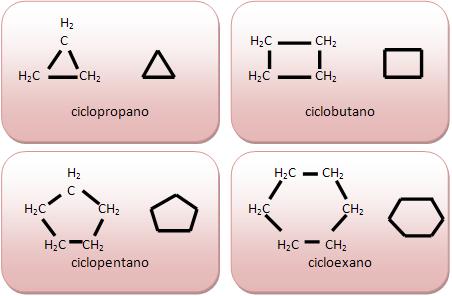
As cadeias homocíclicas são classificadas como cadeias alicíclicas.
As Cadeias alicíclicas não contêm núcleo benzênico. Vejamos:
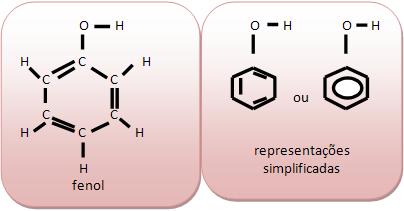
Cadeias aromáticas contêm núcleo benzênico, classificados em cadeia aromática, o fenol comum (C6H5OH) é considerado um sólido, pouco solúvel em água, empregado como desinfetante, na fabricação de corantes, plásticos.
A cadeia aromática pode ser composta por mais de um núcleo benzênico.
Cadeia aromática de núcleos isolados seus anéis não possuem átomos de carbono em comum.
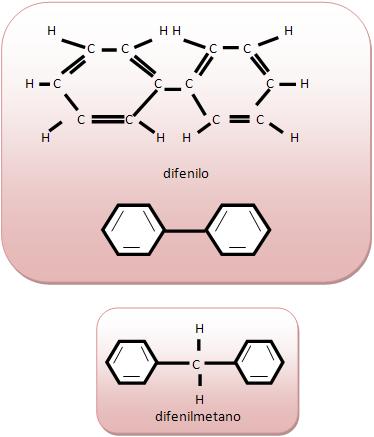
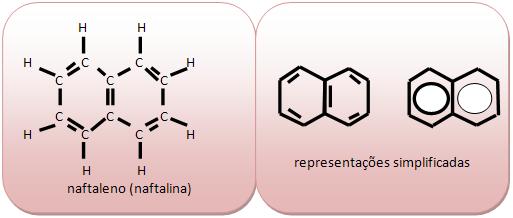
Cadeia aromática de núcleos condensados seus anéis possuem átomos de carbono comum.
Naftalleno ou naftalina (C10H8) é considerada um sólido branco que sofre sublimação para ser usado como inseticida sendo encontrado no alcatrão de hulha.
Cadeia alifática
• Existe uma certa divergência entre os autores quanto a classificação das cadeias.
• Alguns autores usam o termo cadeia alifática como sinônimo de cadeia aberta ou acíclica.
• Outros autores classificam como alifáticas as cadeias não-aromáticas.
A afirmação mais correta seria as cadeias e as alicíclicas seriam alifáticas.
Até agora as cadeias carbônicas foram representadas através de formas chamadas de fórmulas estruturais planas. Esse tipo de fórmula mostra todas as ligações, simbolizadas pelos traços, envolvidas nas cadeias carbônicas. Porém, visto que muitas dessas cadeias podem ser longas e complexas, é comum simplificar a fórmula estrutural, condensando algumas ligações. É possível fazer isso através de dois modos. Veja cada um deles:
- Fórmula estrutural condensada: a primeira forma de simplificar uma cadeia carbônica é utilizar índices, isto é, números que indicam a quantidade de átomos de hidrogênio que se ligam ao carbono. Exemplo:
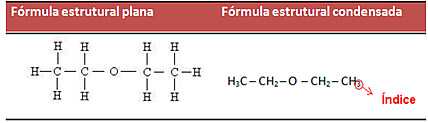
Isso também pode ser feito de forma ainda mais simplificada, utilizando índices para mostrar a quantidade de carbonos na cadeia. Veja como a fórmula mostrada anteriormente fica:
H2C5 ̶ O ̶ C5H2
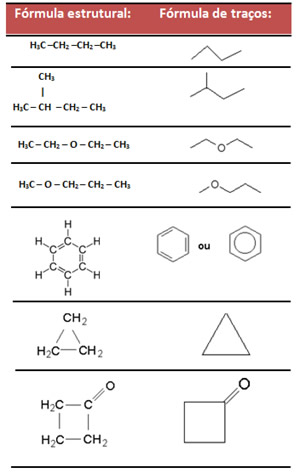
- Fórmula de traços: essa fórmula representa as ligações entre carbonos, usando traços. As pontas, bem como as pontas das inflexões, correspondem a átomos de carbono.
Exemplos:
Funções orgânicas
Funções orgânicas Assim como em química inorgânica, em química orgânica também agrupamos as substâncias com propriedades químicas semelhantes, que são consequência de características estruturais comuns, em funções.
Cada função orgânica é caracterizada por um grupo funcional, que lhe confere características e nomenclaturas específicas.
| Sufixo | Infixo | ||
| N° de Carbonos | Saturação da Cadeia | ||
| 1C | MET | Saturadas | AN |
| 2C | ET | ||
| 3C | PROP | Insaturadas | |
| 4C | BUT | ||
| 5C | PENT | 1 dupla | EN |
| 6C | HEX | 2 duplas | DIEN |
| 7C | HEPT | 3 duplas | TRIEN |
| 8C | OCT | ||
| 9C | NON | 1 tripla | IN |
| 10C | DEC | 2 triplas | DIIN |
| 11C | UNDEC | 3 triplas | TRIIN |
Quando a cadeia possuir ramificações, deve-se utilizar a nomenclatura referente ao número de carbonos da ramificação seguida do sufixo IL para indicar um radical.
Com base nessa regra geral, podemos nomear qualquer função orgânica apenas sabendo o sufixo relacionado ao seu grupo funcional. Podemos dividir as funções orgânicas em hidrocarbonetos, funções oxigenadas, funções nitrogenadas, funções halogenadas e outras funções menores.
Hidrocarbonetos
São um conjunto de funções que só contém carbono e hidrogênio em sua estrutura.
Grupo Funcional: C, H.
Nomenclatura: terminação -O
Os hidrocarbonetos podem ser divididos em:
Alcanos ou parafinas: hidrocarbonetos que possuem cadeia aberta e ligações simples. O termo parafina significa pouco reativo, do latim parum = pequena + affinis = afinidade.
Fórmula Geral: CnH2n+2
Exemplos:
| Pentano |
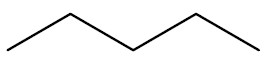 |
| Nonano |
| |
Quando houverem ramificações na cadeia, essas devem ser escritas a frente da cadeia principal, utilizando a terminação –IL. A cadeia principal é contada a partir da extremidade mais próxima da ramificação. Exemplo:
| 3-metil-nonano |
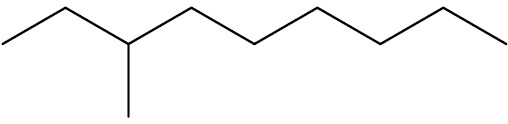 |
Se houverem duas ramificações, nomeá-las sempre em ordem alfabética. Exemplo:
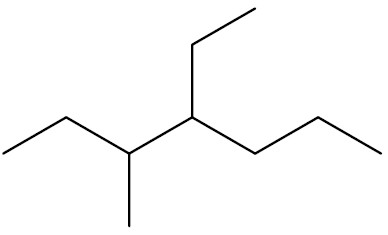
| 4-etil-3-metil-heptano |
 |
Quando houver dúvida, utilizar a contagem mais próxima da ramificação que virá primeiro em ordem alfabética. Exemplo:
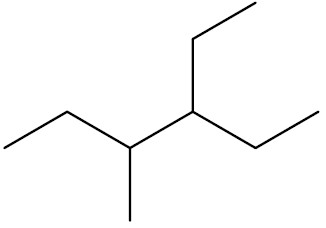
| 3-etil-4-metil-hexano |
 |
Alcenos, alquenos ou olefinas: são hidrocarbonetos que possuem cadeia aberta e ligações duplas (insaturação). O termo olefina significa oleoso, do latim oleum = óleo + affinis = afinidade.
Fórmula Geral: CnH2n
Na nomenclatura dos alcenos, é importante que a contagem da cadeia principal comece na extremidade mais próxima da dupla ligação. A posição da dupla deve vir antes do infixo que indica o tipo de ligação.
Exemplos:
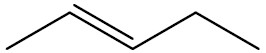
| pent-2-eno |
 |
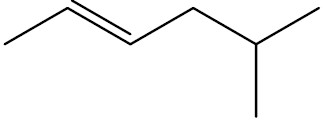
| 5-metil-hex-2-eno |
 |
Alcinos ou alquinos: são hidrocarbonetos que possuem cadeia aberta e ligações triplas. Utiliza-se para os alcinos as mesmas regras de nomenclatura dos alcenos, mas com sufixo in (+0, sufixo geral dos hidrocarbonetos).
Fórmula Geral: CnH2n-2
Exemplos:
| hept-2-ino |
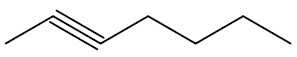 |
| 4-metil-hept-1,5-diino |
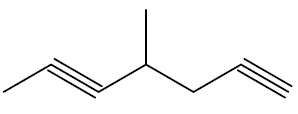 |
Alcadienos ou dienos: são alcenos que possuem duas duplas ligações.
Fórmula Geral: CnH2n-2
Exemplo:
| hex-2,4-dieno |
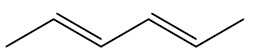 |
Hidrocarbonetos cíclicos: apresentam cadeia fechada e podem ou não possuir insaturações. Sua nomenclatura segue a regra dos hidrocarbonetos de cadeia aberta, apenas adicionando a palavra ciclo na frente.
Exemplos:
| Ciclopropano |
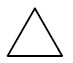 |
| Ciclobuteno |
 |
| Metil-ciclohexano |
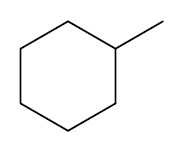 |
Aromáticos: são hidrocarbonetos cíclicos que possuem três ligações duplas alternadas que permanecem em ressonância, formando um anel aromático, mais conhecido como benzeno. O benzeno pode se ligar a outros anéis e formar outros compostos aromáticos.
Exemplo:
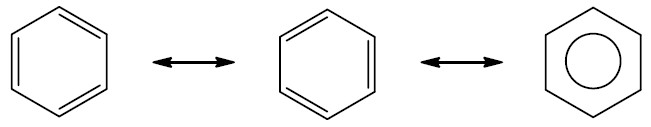
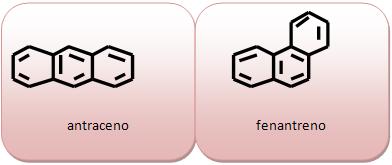
| Naftaleno |
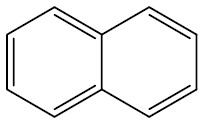 |
| Antraceno |
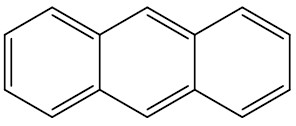 |
| Fenantraceno |
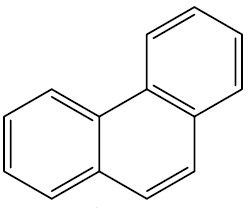 |
Nos anéis aromáticos ramificados, é comum utilizar a seguinte designação para as posições das ramificações:
| 1,2-dimetil-benzeno ou orto-dimetil-benzeno |
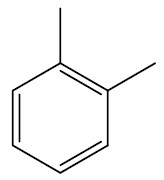 |
| 1,3-dimetil-benzeno ou meta-dimetil-benzeno |
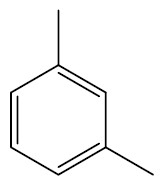 |
| 1,4-dimetil-benzeno ou para-dimetil-benzeno |
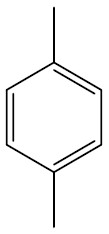 |
Funções oxigenadas
São funções que apresentam o oxigênio na sua estrutura.
Álcoois: são compostos que apresentam o grupo hidroxila (‒OH) em sua estrutura. Podem possuir insaturações, cadeias cíclicas e ramificações. São solúveis em água e até onze carbonos são líquidos.
Na nomenclatura, a contagem da cadeia principal deve iniciar na extremidade mais próxima do grupo funcional.
Grupo Funcional: ‒OH
Nomenclatura: terminação –OL
Exemplos:
| etanol |
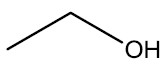 |
| 4-metil-hexan-2-ol |
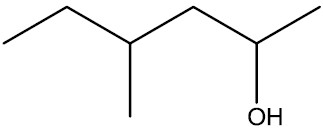 |
| 2-metil-pent-3-enol |
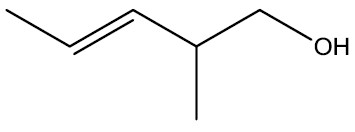 |
Fenóis: são álcoois onde a hidroxila está ligada diretamente ao anel aromático. São antibacterianos e fungicidas, mas podem ser tóxicos aos seres vivos.
Grupo Funcional: Caromático‒OH
Nomenclatura: Fenol ou hidroxi-benzeno
Nota: na nomenclatura de fenóis ramificados, deve-se iniciar a contagem no grupo funcional e girar no sentido horário ou anti-horário, de acordo com a menor numeração para a ramificação, a partir da hidroxila.
| Fenol ou hidroxi-benzeno |
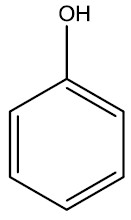 |
| 3-metil-fenol ou 1-hidroxi-3-metil-benzeno ou meta-metil-fenol |
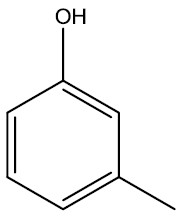 |
Éteres: são compostos que possuem um átomo de oxigênio ligado a dois átomos de carbono. Podem ser formados pela desidratação intermolecular de álcoois.
Grupo Funcional: ‒O‒
Nomenclatura: prefixo que indica o número de carbonos do menor radical + OXI + nome do hidrocarboneto correspondente ao maior radical.
Exemplos:
| Metoxi-propano |
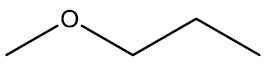 |
| Propoxi-propano |
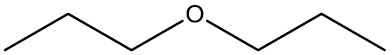 |
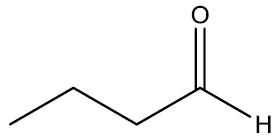
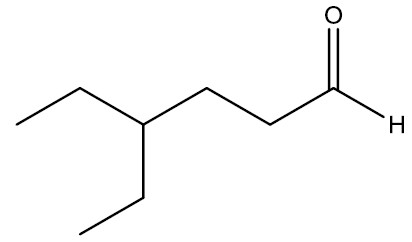
Aldeídos: são compostos que apresentam o grupamento carbonila (C=O) na extremidade da cadeia. O odor dos aldeídos que têm baixo peso molecular é irritante, porém, à medida que o número de carbonos aumenta, torna-se mais agradável.
Grupo funcional: 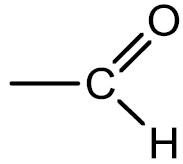
Nomenclatura: terminação -AL
Exemplos:
| Butanal |
 |
| 4-etil-hexanal |
 |
Cetonas: são compostos que apresentam o grupamento carbonila (C=O) no meio da cadeia. São formadas pela oxidação de álcoois secundários, onde um átomo de hidrogênio (ligado ao oxigênio) é retirado e o átomo de oxigênio passa a fazer uma ligação dupla com o carbono da cadeia.
Grupo funcional: 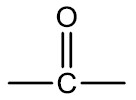
Nomenclatura: terminação -ONA
Exemplos:
| Propanona ou acetona |
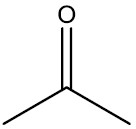 |
| 3-metil-pentan-2-ona |
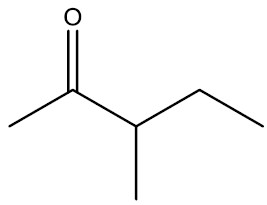 |
Ácidos Carboxílicos: são compostos que possuem o grupamento carboxila (carbonila + hidroxila) na extremidade da cadeia. Em geral são mais fracos que os ácidos inorgânicos e dão origem aos ácidos graxos e lipídeos.
Grupo funcional: 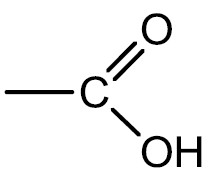
Nomenclatura: Ácido + terminação -ÓICO
Exemplos:
| Ácido propanóico |
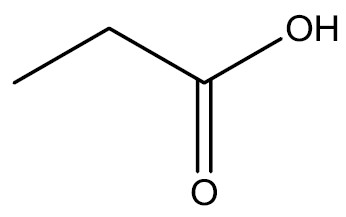 |
| Ácido 2-metil-butanóico |
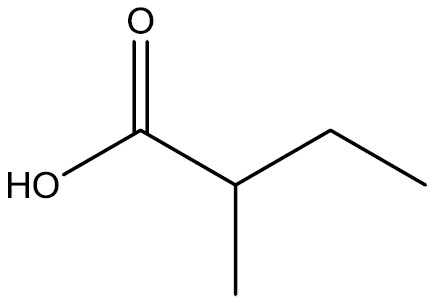 |
Sais de ácidos carboxílicos: são compostos derivados de uma neutralização do ácido carboxílico com uma base. Sendo o metal (Me) incorporado na cadeia carbônica enquanto há liberação de água.
Grupo funcional: 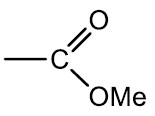
Nomenclatura: terminação –ATO de nome do metal
Exemplo:
| Butanoato de sódio |
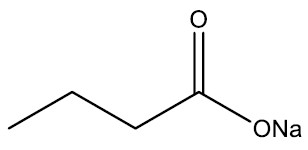 |
Ésteres: originam-se a partir da substituição do hidrogênio da hidroxila de um ácido por um radical orgânico. Podem ser produzidos pela esterificação de um ácido carboxílico com um álcool.
Grupo funcional: 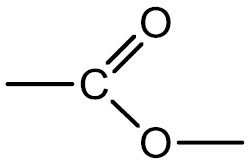
Nomenclatura: terminação –ATO de nome do radical carbônico
Exemplos:
| Propanoato de metila |
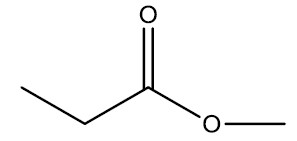 |
| Propanoato de propila |
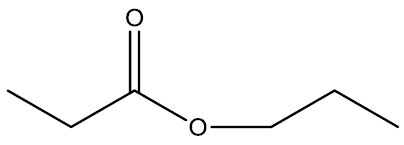 |
 Funções nitrogenadas
Funções nitrogenadas
São funções que possuem o nitrogênio em sua estrutura.
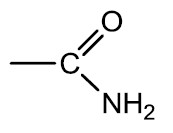
Aminas: são bases orgânicas, obtidas a partir da substituição de um ou mais hidrogênios da amônia (NH3) por radicais orgânicos. Os aminoácidos são compostos que possuem o grupamento amina e ácido carboxílico na mesma molécula.
Grupo Funcional: ‒NH2 ou ‒NH‒ ou ‒N<
Nomenclatura: terminação -AMINA
Exemplos:
| Etilamina |
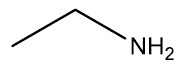 |
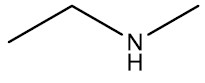
| Etil-metilamina |
 |
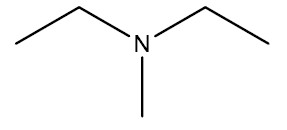
| Dietil-metilamina |
 |
Amidas: São compostos orgânicos derivados de ácidos carboxílicos pela substituição da hidroxila (‒OH) pelo grupamento amino (‒NH2). A ureia, de fórmula CO(NH2)2, é uma diamida que é eliminada pela urina por ser produto final do metabolismo dos animais superiores.
Nomenclatura: terminação -AMIDA
Exemplos:
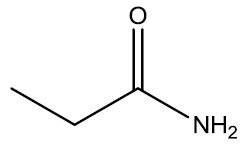
| Propanoamida |
 |
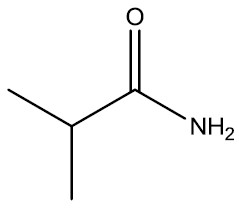
| 2-metil-propanoamida |
 |
Nitrocompostos: São compostos que apresentam o radical nitro (‒NO2). Tem larga aplicação em explosivos e agrotóxicos.
Grupo Funcional: ‒‒NO2
Nomenclatura: NITRO + nome do hidrocarboneto
Exemplos:
| Nitrobutano |
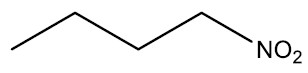 |
| 2,4-dimetil-nitropentano |
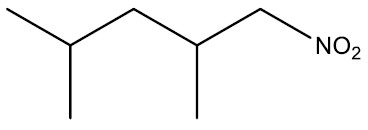 |
Nitrilas ou cianetos: são compostos que apresentam o radical nitrila (‒CN). São o resultado da substituição do átomo de hidrogênio do cianeto de hidrogênio ou ácido cianídrico (HCN) por um radical orgânico.
Grupo funcional: ‒CN
Nomenclatura: terminação -NITRILA
Exemplos:
| Butanonitrila |
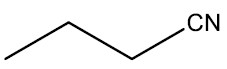 |
| 3-metil-pentanonitrila |
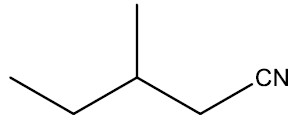 |
 Funções halogenadas
Funções halogenadas
São funções que possuem em sua estrutura um halogênio (F, Cl, Br ou I).
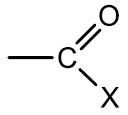
Haletos Orgânicos ou derivados halogenados: são compostos formados a partir da substituição de um átomo de hidrogênio de um hidrocarboneto por um halogênio. São insolúveis em água e em geral tóxicos e danosos aos organismos vivos.
Grupo Funcional: ‒X (F, Cl, Br ou I)
Nomenclatura: nome do halogênio + nome do hidrocarboneto
Exemplos:
| Bromo-propano |
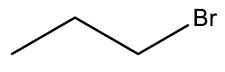 |
| Cloro-benzeno |
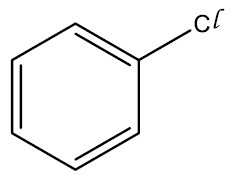 |
Haletos de Ácidos ou haletos de acila: são compostos derivados de ácidos carboxílicos onde a hidroxila foi substituída por um halogênio. Os cloretos de ácidos mais simples são líquidos de cheiro forte e irritante, tóxicos, insolúveis e mais densos que a água.
Nomenclatura: nome do halogênio + -ETO de nome do hidrocarboneto + ILA
Exemplos:
| Iodeto de hexanoíla |
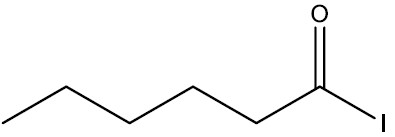 |
| Fluoreto de butanoíla |
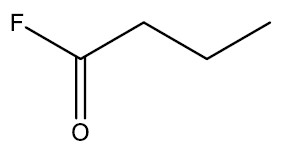 |
Ácidos sulfônicos
São compostos orgânicos derivados do ácido sulfúrico (H2SO4) pela substituição de uma hidroxila por um radical orgânico. São largamente aplicados na obtenção de surfactantes (espumantes), que estão presentes em xampus, detergentes e cremes dentais.
Grupo Funcional: ‒SO3H
Nomenclatura: ÁCIDO + nome do hidrocarboneto + SULFÔNICO
Exemplos:
| Ácido propanosulfônico |
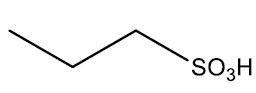 |
| Ácido 5-metil-3-hexasulfônico |
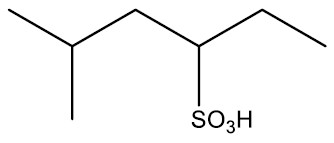 |
Compostos de Grignard
São compostos organometálicos que apresentam pelo menos um átomo de um metal ligado diretamente ao átomo de carbono.
Grupo Funcional: ‒MgX (F, Cl, Br, I)
Nomenclatura: halogênio + ETO de radical + MAGNÉSIO
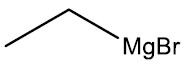
Exemplos:
| Brometo de etil-magnésio |
 |
| Fluoreto de ciclohexil-magnésio |
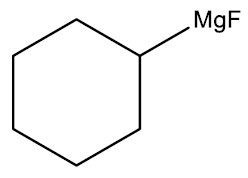 |
Funções mistas
São compostos que apresentam diversas funções na estrutura. Em geral, possuem nomenclatura IUPAC mais complexa, por esta razão são mais conhecidos por seus nomes usuais.
Exemplos:
| Colesterol |
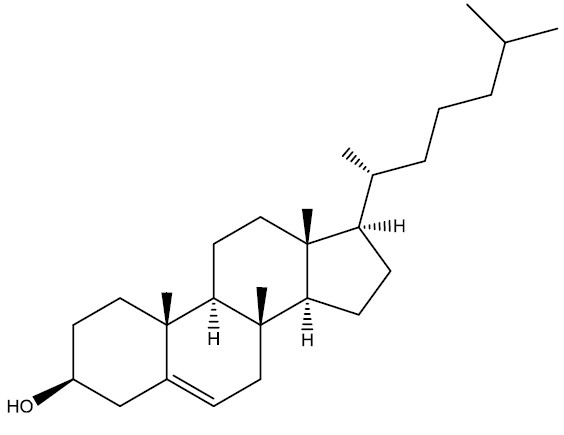 |
| Aspartame |
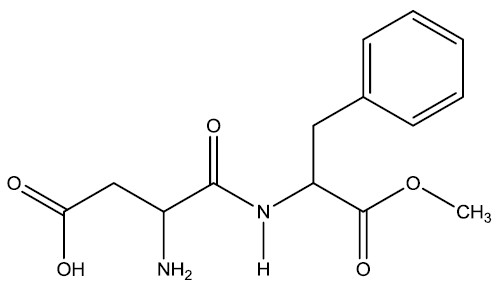 |
Bibliografia
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/materiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf



ISOMERIA
vídeo aulas relacionadas ao assunto:
Atividade Avaliativa 1 – cadeias carbônicas