Condutividade elétrica das substâncias
A condutividade elétrica é uma propriedade que caracteriza a facilidade que os materiais possuem de transportar cargas elétricas. Quanto maior o número de elétrons livres em um material, maior a sua capacidade de transportar eletricidade.
Quando um determinado material conduz eletricidade com facilidade, ele é denominado condutor; caso ele não conduza eletricidade, é chamado isolante.
Embora sejam simples os conceitos envolvidos na condutividade elétrica, existe certa dificuldade para saber quais são os bons e os maus condutores. É comum que os alunos já saibam que os condutores de eletricidade utilizados nas residências sejam feitos de metais, ou que, para se obter um isolamento elétrico, devemos usar luvas ou botas de borracha. Mas para alguns materiais, como os líquidos, ainda existem algumas dúvidas.
Digamos que a solução em questão seja de água e sal. Se colocarmos os bastões nessa solução, observaremos que a lâmpada acenderá. No entanto, se mudarmos a solução para uma de água e açúcar, a lâmpada permanecerá desligada.
Isso nos mostra que é possível diferenciar as soluções de acordo com a sua condutividade elétrica:
1. Solução iônica ou eletrolítica: esse tipo de solução conduz eletricidade, em razão da presença de íons (átomos ou grupos de átomos de elementos químicos com carga elétrica). Esses íons com carga negativa (ânion) e positiva (cátions) fecham o circuito elétrico conduzindo a corrente.
A solução iônica ou eletrolítica pode ser obtida de duas formas:
1.1. Ionização: é a formação de íons em virtude do rompimento de ligações covalentes. Por exemplo, se diluirmos ácido clorídrico (HCl), que é um composto formado por moléculas, em água; ocorrerá a quebra dessas moléculas pela água, originando íons. As equações químicas abaixo demonstram como isso ocorre:
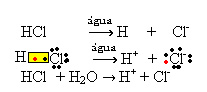
1.2. Dissociação iônica: no caso da primeira solução citada no exemplo acima, temos a dissolução do sal de cozinha ((NaCl – cloreto de sódio), que é um composto iônico, isto é, que já era formado por íons. A água apenas separou os íons já existentes no aglomerado iônico:
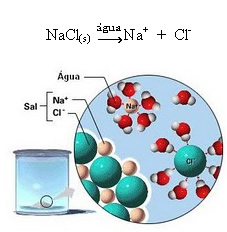
Observe na figura acima que o sal (NaCl) estava na forma de retículo cristalino, porém, por ser uma substância polar, seu polo negativo, que é o Cl–, é atraído pelo polo positivo da água, que é o H+. E o polo positivo do sal, que é o Na+, é atraído pelo OH–, que é o polo negativo da água. Assim, os íons que antes estavam ligados pela ligação iônica são separados.
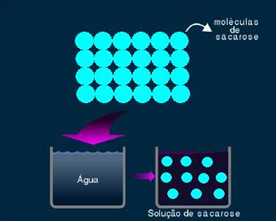
2. Solução molecular ou não eletrolítica: esse tipo de solução não conduz eletricidade. É o segundo caso que citamos, da solução de água e açúcar. O açúcar (sacarose – C12H22O11) é um composto molecular que sofre dissociação sem formar íons. As suas moléculas, que antes estavam agrupadas, são apenas separadas. Assim, por não conter carga, essa solução não conduz corrente elétrica.
A aula prática sobre condutividade elétrica é uma sugestão que tem como objetivo testar a diferentes substâncias para definir, a partir da observação, quais são os bons e os maus condutores de eletricidade.
Veja abaixo como realizar o experimento:
Os materiais utilizados são:
-
uma lâmpada conectada a uma fonte de energia;
-
um recipiente com água pura;
-
um recipiente com água e sal;
-
um recipiente com vinagre e água;
-
um recipiente com etanol;
-
pedaço de madeira;
-
pedaço de plástico;
-
sal de cozinha.
O aparato experimental deve ser montado da seguinte forma:
-
A lâmpada deve ser conectada a uma fonte de tensão;
-
O fio condutor que está ligado à lâmpada deve ter duas extremidades livres, que serão colocadas em contato com o material de teste;
-
Colocar os condutores em contato com os diversos materiais e observar se a lâmpada fica apagada ou se ela acende.
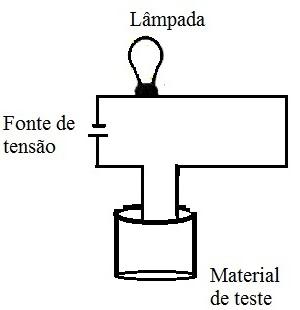
Aparato experimental para testar a condutividade elétrica dos materiais.
O que se espera nesse experimento é que a lâmpada acenda ao entrar em contato com a água e o sal, bem como com a solução aquosa de vinagre. As demais substâncias não conduzirão eletricidade o suficiente para que a lâmpada acenda.
A partir desse experimento, você pode explorar o caso particular da água, pois é o que mais está presente no dia a dia dos alunos. Muito se diz sobre acender a luz ou ligar aparelhos elétricos com as mãos molhadas. Mas você poderá mostrar, com esse experimento, que a água não conduz eletricidade. Por que, então, todo esse medo de um choque ao tocar em aparelhos elétricos?
O que acontece é que, por mais que a água pura não seja boa condutora, raramente encontramos a água tão pura assim. A nossa pele, por exemplo, tem sal, resultado da transpiração Quando ela entra em contato com a água, passa a conduzir eletricidade. A água que consumimos pode possuir sais minerais e também pode conduzir eletricidade.
Peça também aos alunos que eles anotem o que foi observado durante a aula experimental para que, em seguida, possa ser construído um relatório.
Observações
Alguns cuidados devem ser tomados ao realizar essa atividade: utilize baixas fontes de tensão, como pilhas ou baterias, para evitar choque elétrico; não toque nos fios se estiverem desencapados.
Os fios que conduzem eletricidade são feitos de metal, pois este apresenta grande condutividade elétrica.


