É possível alterar a rapidez com que uma transformação química ocorre?
Conteúdos e temas: variáveis que podem modificar a rapidez de uma transformação química (concentração, temperatura, pressão, estado de agregação e presença do catalisador) e procedimentos experimentais relativos a esse estudo.
Competências e habilidades: organizar, relacionar e interpretar dados para chegar a conclusões sobre as variáveis que podem alterar a rapidez com que uma transformação química ocorre; recorrer aos conhecimentos desenvolvidos sobre as variáveis que podem afetar a rapidez do processo de deterioração dos alimentos para a elaboração de propostas de intervenção solidária na sociedade; reconhecer o papel da Química no sistema produtivo, analisando a importância dos estudos relacionados ao uso dos catalisadores.
Estratégias de ensino: experimentos e questões apresentadas nos roteiros.
Recursos: materiais para a execução dos experimentos; roteiros de trabalho.
Avaliação: respostas as questões referentes às atividades experimentais desenvolvidas e problemas que exijam a aplicação dos conceitos aprendidos.
Fatores que influenciam as reações químicas
Cinética química
Podemos observar que algumas reações químicas acontecem com mais rapidez e outras mais lentamente. Algumas demoram horas, dias, anos. Outras levam uma fração de segundo para ocorrer.
As reações químicas ocorrem em velocidades diferentes, como por exemplo o processo de digestão dos alimentos que leva algumas horas e uma explosão que é instantânea. Veja algumas reações químicas:
– ácido e uma base é uma reação instantânea;
– formação da ferrugem, que leva anos para se formar;
– dissolução de uma pastilha efervescente, que leva alguns segundos;
– decaimento radioativo, que leva muitas vezes bilhões de anos;
– queima de uma vela, que leva algumas horas;
– queima de um palito de fósforo, que leva alguns segundos;
– formação das rochas, que leva alguns milhões de anos.




Às vezes é importante controlar estas reações, tornando-as mais rápidas ou mais lentas. A cinética química é uma área da Química que estuda a velocidade das reações químicas e os fatores que alteram esta velocidade.
Cinética Química
CONDIÇÕES NECESSÁRIAS
Para que ocorra a reação entre duas ou mais substâncias, são necessárias duas condições:
Contato entre os reagentes – É primordial que as moléculas dos reagentes sejam postas em contato do modo mais eficaz possível. Por exemplo, ácidos e bases reagem, pois eles possuem a afinidade química, mas se estiverem em frascos separados, não irão reagir. Sendo assim, é fundamental que as espécies reagentes sejam colocadas em contato para que as partículas que formam seus aglomerados possam colidir umas com as outras, rompendo as ligações que existem e formando novas ligações, o que originará novas substâncias.
Afinidade química – É fundamental, também, que os reagentes tenham uma certa afinidade química, ou seja, uma tendência natural para reagir. No dia-a-dia, observa-se que algumas substâncias possuem diferentes afinidades químicas com as outras, ou seja, a natureza dos reagentes define se há a possibilidade de reagirem entre si. Por exemplo, o ferro se oxida (enferruja) lentamente quando exposto ao ar; em contrapartida, a oxidação do sódio no ar é muito rápida, devido à afinidade química entre o sódio e o oxigênio — tanto que o sódio é guardado imerso em querosene para não se oxidar. Afinidade química, enfim, é um fator que depende da própria natureza das substâncias envolvidas na reação.
Teoria das Colisões
A teoria das colisões entre as partículas que constituem os reagentes explica satisfatoriamente os fatores que interferem na ocorrência e na rapidez de uma reação. A teoria das colisões ainda prevê que a velocidade da reação depende:
a) da freqüência dos choques entre as moléculas — um maior número de choques por segundo implicará um maior número de moléculas reagindo e, portanto, maior velocidade da reação;
b) da energia (violência) desses choques — uma trombada violenta (chamada colisão eficaz ou efetiva) terá mais chance de provocar a reação entre as moléculas do que uma trombada fraca (chamada de colisão não-eficaz ou não-efetiva);
c) de uma orientação apropriada das moléculas no instante do choque — uma trombada de frente (colisão frontal) será mais eficaz que uma trombada de raspão (colisão não-frontal); esse fator depende também do tamanho e do formato das moléculas reagente.Nem todas as colisões são eficazes, isto é, nem todas dão origem a novos produtos. No entanto, as colisões que rompem as ligações formadas e formam novas ligações, são denominadas colisões eficazes ou efetivas.
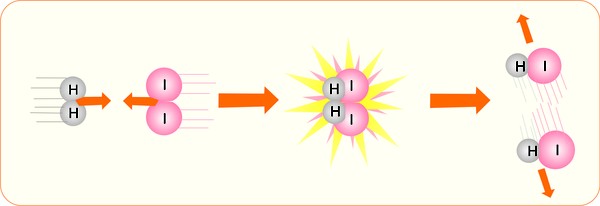
Em um primeiro momento, as moléculas de H (hidrogênio) e de I (iodo) se aproximam rapidamente, em seguida, chocam-se e por fim, quando as moléculas de HI se formam, elas se afastam rapidamente.
Todos os fatores que aumentam a velocidade e o número de choques entre as moléculas facilitarão e, consequentemente, aumentarão a velocidade das reações químicas. Entre esses fatores, podemos destacar: o aumento de temperatura, a participação de outras formas de energia, como a luz e a eletricidade, o aumento de pressão nas reações entre gases, o aumento da concentração dos reagentes que estão em solução, etc.
EFEITOS DA TEMPERATURA
A temperatura é um dos fatores que mais influem na velocidade de uma reação. De fato, um aumento de temperatura aumenta não só a frequência dos choques entre as moléculas reagentes, como também a energia com que as moléculas se chocam. Desse modo, como resultado da teoria das colisões , aumenta a probabilidade de as moléculas reagirem — ou seja, aumenta a velocidade da reação.
Muitos fatos que ocorrem em nosso dia a dia podem servir para demonstrar a relação entre a mudança na velocidade das reações e a mudança de temperatura. Por exemplo, quando aumentamos a chama do fogão para cozer os alimentos mais depressa ou quando usamos a panela de pressão para atingir temperaturas mais altas e acelerar o cozimento; ou, ao contrário, quando usamos a geladeira para diminuir a velocidade de deterioração dos alimentos.
Outro aspecto importante a ser analisado decorre da Termoquímica e diz respeito às variações de energia durante as reações químicas. Neste gráfico, a energia considerada é, em geral, a entalpia. Usualmente, quando há liberação de energia (ΔH< 0), a reação é espontânea. Essas variações podem ser observadas nos gráficos abaixo:
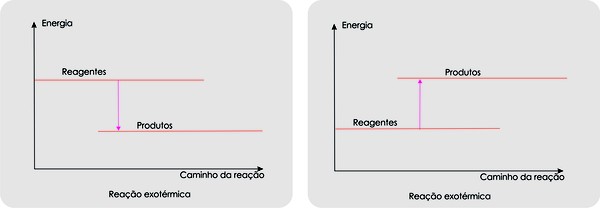
Considerando a equação de queima do carvão, temos:
C(s) + O(g) → CO2(g) ∆H = – 94,1 Kcal
Podemos notar que um pedaço de carvão não pega fogo sozinho. Precisamos aquecê-lo um pouco, até que o mesmo atinja um estado incandescente, neste momento em diante, ele queimará sozinho. Esse “empurrão” inicial é necessário em muitas reações. Como por exemplo, o fato de usarmos um fósforo para acender o gás de um fogão, no motor do automóvel, a faísca da vela detona a gasolina, etc.
O “empurrão” inicial é necessário para levar os reagentes a um estado ativado, em que se forma o complexo ativado. A teoria do complexo ativado, admite que, no instante do choque, ocorre um progressivo enfraquecimento das ligações entre as moléculas iniciais e um fortalecimento das ligações entre as moléculas finais.
No choque efetivo as moléculas absorvem a quantidade de energia mínima necessária (energia de ativação) para a formação do complexo ativado, ou seja, um estado intermediário (estado de transição) entre os reagentes e os produtos. Nessa estrutura, as ligações dos reagentes estão enfraquecidas e as dos produtos estão sendo formadas. Observe uma reação genérica que mostra essa formação do complexo ativado abaixo:AB + XY → AX + YB
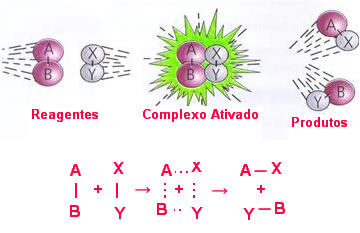
Note que quando ocorre o choque efetivo, forma-se momentaneamente o complexo ativado, no qual as ligações entre os átomos AB e XY estão se rompendo e as ligações que unirão os átomos nas moléculas AX e YB estão se formando.Observe no diagrama que se não for atingida a energia de ativação, não é possível formar o complexo ativado, pois ela serve como uma barreira energética a ser ultrapassada para que a reação química ocorra.
Para que o sistema chegue ao complexo ativado, é necessária certa quantidade de energia. Se incluímos essa energia nos gráficos mencionados anteriormente, os mesmos serão representados da seguinte forma:
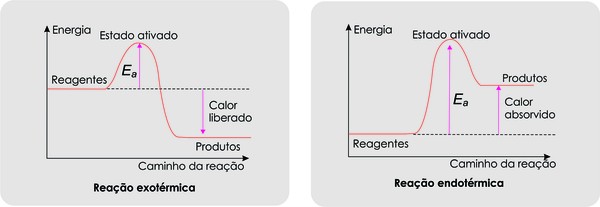
Para reações exotérmicas (reações que liberam energia – ΔH < 0) e endotérmicas (reações que absorvem energia – ΔH > 0), temos os diagramas:
Para atingir a elevação correspondente ao estado ativado, as moléculas reagentes devem ter uma energia igual (ou maior) que uma energia mínima chamada energia de ativação (Eat– trata-se da energia mínima que as moléculas devem possuir para reagir ao se chocarem, isto é, para termos uma colisão efetiva).
EFEITOS DA ELETRICIDADE
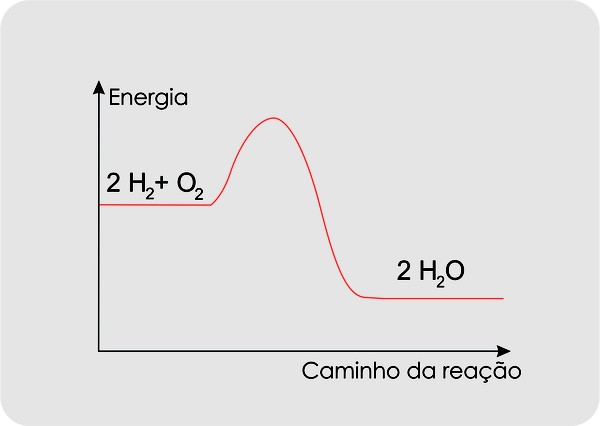
2 H2(g) + O2(g)→faísca elétrica→ 2 H2O(g) ∆H = – 94,1 Kcal
Nessa reação, a faísca elétrica fornece energia para que algumas moléculas de H2 e de O2 ultrapassem a elevação correspondente à energia de ativação. Como a própria reação libera muita energia, isso será suficiente para desencadear a reação na totalidade das moléculas de H2 e de O2 restantes.
EFEITOS DA LUZ
Da mesma maneira que o calor e a eletricidade, a luz (bem como as demais radiações eletromagnéticas) também é uma forma de energia que influi em muitas reações químicas. Quando ficamos diretamente expostos ao sol do meio-dia, por exemplo, as queimaduras que sofremos na pele são o resultado da quebra das moléculas formadoras da própria pele. A água oxigenada se decompõe mais facilmente quando está exposta à luz, por isso devemos deixá-la guardada em local escuro. A fotossíntese realizada pelas plantas é um tipo de reação que é influenciada pela presença da luz. Outra reação em que é muito utilizada a luz é a decomposição do AgBr, que dá origem aos filmes fotográficos.
A velocidade das reações químicas é uma área estudada pela Cinética Química. Esse estudo é importante porque é possível encontrar meios de controlar o tempo de desenvolvimento das reações, tornando-as mais lentas ou mais rápidas, conforme a necessidade.
Existem cinco principais fatores que alteram a velocidade das reações, veja quais são:
a superfície de contato, a temperatura, pressão a concentração dos reagentes e o uso de catalisadores.
1- Superfície de contato: Quanto maior a superfície de contato, maior é a velocidade da reação.
Isso ocorre porque as reações acontecem entre as moléculas que ficam nas superfícies dos reagentes. Elas realizam colisões que, se forem efetivas (com orientação correta e com a quantidade de energia necessária), resultarão na quebra das antigas ligações e formação de novas ligações, ou seja, a reação química ocorrerá. Portanto, quanto maior for a superfície de contato, mais moléculas estarão em contato umas com as outras, maior será a probabilidade de ocorrerem choques efetivos e mais rápida será a reação. Um exemplo que confirma isso é se você colocar para reagir com a mesma quantidade de água um comprimido efervescente inteiro e um triturado. Qual terminará de reagir mais rápido? A resposta é o comprimido triturado, pois a sua superfície de contato é bem maior que a do comprimido compacto.

Reação entre antiácido efervescente e água em duas situações diferentes: no primeiro copo, o antiácido está em pó; no segundo, está em comprimido.
2- Temperatura: Quanto maior a temperatura, maior será a velocidade da reação.
Isso acontece porque, com o aumento da temperatura, a energia cinética das moléculas das substâncias reagentes aumenta, ou seja, elas movimentam-se em uma maior velocidade, o que aumenta a quantidade de choques efetivos que resultam em uma reação mais rápida. Além disso, como a energia das moléculas aumenta, isso propicia que elas tenham a energia suficiente para reagir, que é chamada de energia de ativação.
Por exemplo, quando ocorre um incêndio em uma floresta, que é um meio onde a perda de calor é pequena, a reação libera calor para o meio. Com isso, a temperatura do ambiente aumenta e isso faz com que a reação de combustão ocorra ainda mais rapidamente.

O aumento da temperatura aumenta ainda mais a velocidade dos incêndios florestais.
3- Pressão:
A panela de pressão também é usada com essa finalidade, pois o aumento da pressão aumenta a temperatura que o líquido entra em ebulição e, consequentemente, mais rápido é o cozimento do alimento. Panela de pressão é um exemplo da influência da temperatura sobre a velocidade da reação Por outro lado, se queremos que uma reação ocorra mais lentamente, podemos diminuir a temperatura. É o caso de colocarmos, por exemplo, carnes no freezer, pois a baixa temperatura faz com que esse alimento decomponha-se mais devagar.
Panela de pressão é um exemplo da influência da temperatura sobre a velocidade da reação Por outro lado, se queremos que uma reação ocorra mais lentamente, podemos diminuir a temperatura. É o caso de colocarmos, por exemplo, carnes no freezer, pois a baixa temperatura faz com que esse alimento decomponha-se mais devagar.
3- Concentração: Quanto maior a concentração dos reagentes, maior é a velocidade da reação.
Quando aumentamos a concentração dos reagentes, aumentamos o número de moléculas ou partículas reagentes por unidade de volume e, consequentemente, o número de colisões entre elas aumenta, resultando em uma maior velocidade da reação. Um exemplo é a combustão do carvão. Se colocarmos um pedaço de carvão em brasa dentro de um frasco com oxigênio puro, a reação ocorrerá com uma velocidade muito maior. Isso porque a concentração de um dos reagentes da combustão (o oxigênio) aumentou. Antes, o oxigênio era o presente no ar, que está em uma proporção de cerca de 20%. Dentro do frasco, porém, essa proporção vai para 100%.
4- Catalisadores: São substâncias que aumentam a velocidade de determinadas reações sem participar delas, ou seja, sem serem consumidas durante a reação.
Por exemplo, a água oxigenada decompõe-se com o tempo, mas quando ela é colocada em contato com o sangue de um machucado, essa reação ocorre com uma velocidade muito maior, o que é visto por meio da formação de bolhas.Isso acontece porque o sangue possui uma enzima denominada catalase que funciona como catalisadora da reação de decomposição da água oxigenada, ou seja, aumenta sua velocidade.Os catalisadores conseguem aumentar a velocidade das reações porque eles atuam mudando o mecanismo da reação por diminuir a energia de ativação da reação. Assim, com uma quantidade de energia de ativação menor, fica mais fácil para as partículas reagentes atingirem essa energia e reagirem.
Existem outros fatores que podem interferir em reações específicas. Alguns exemplos são: luz,eletricidade, pressão (no caso de sistemas gasosos) e natureza dos reagentes (quanto maior o número de ligações dos reagentes que precisam ser rompidas e quanto mais fortes elas forem, mais demorada será a reação).
Além desses fatores principais, a natureza dos reagentes e fatores externos como luz e eletricidade podem influenciar a velocidade de certas reações químicas. A natureza do reagente interfere porque quanto maior for o número de ligações dos reagentes que precisam ser rompidas para que a reação ocorra e também quanto mais fortes elas forem, mais lenta será a reação.
Já a luz influencia em reações fotoquímicas, em que há algum reagente fotoquimicamente ativo. Um exemplo é a fotossíntese, que não ocorre sem as radiações luminosas captadas pela clorofila das plantas — o pigmento responsável pela cor verde.
Outro exemplo é a decomposição da água oxigenada, que ocorre com maior rapidez se houver luz. É por isso que os frascos que contêm esse produto são sempre escuros ou opacos, impedindo a entrada de luminosidade.

Frasco opaco de água oxigenada
A velocidade média de uma reação química é determinada em função dos reagentes ou em função dos produtos. Basta usar a seguinte fórmula:
Vm = variação da concentração do reagente ou do produto
intervalo de tempo
Vm = ?[reagente ou produto]
?t
ou
Vm = [final – inicial]
(tfinal – tinicial)
Se fizermos em relação a um reagente, teremos que acrescentar o sinal negativo na fórmula, pois, visto que os reagentes são consumidos durante o processo, a sua concentração final é menor que a inicial, por isso o resultado daria negativo.
Veja mais detalhes de como aplicar essas fórmulas no texto Cálculo da Velocidade Média de uma Reação.
Questões
1. Considerando o que foi estudado em sala de aula sobre os fatores que podem alterar a rapidez das transformações
químicas, responda às questões:
a) Por que alimentos armazenados na geladeira demoram mais para estragar do que fora dela?
b) Qual item vai estragar mais rapidamente à temperatura ambiente: uma peça inteira de 500 g de carne ou 500 g de
carne moída? Justifique sua resposta.
2. (Fuvest – 1993) Para remover uma mancha de um prato de porcelana, fez-se o seguinte: cobriu-se a mancha com meio copo de água fria, adicionaram-se algumas gotas de vinagre e deixou-se por uma noite. No dia seguinte, a mancha havia clareado levemente. Usando apenas água e vinagre, sugira duas alterações no procedimento, de modo que a remoção da mancha possa ocorrer em menor tempo. Justifique cada
uma das alterações propostas.
Você costuma observar as datas de validade quando compra um alimento?
( ) nunca ( ) sempre ( ) às vezes
Por quê? ________________________________
Você consumiria( ) nunca ( ) não olho as datas de validade ( ) às vezes
Por quê? ________________________________
Você costuma observar as condições em que os alimentos estão estocados nos supermercados/feiras quando faz compras (temperatura da geladeira ou do freezer, alimentos cobertos ou descobertos, condições das embalagens)?
( ) nunca ( ) sempre ( ) às vezes
Por quê? ________________________________.
É possível relacionar prazos de validade e condições de armazenamento de alimentos com seus conhecimentos sobre rapidez das reações químicas?



