Conteúdos e temas: ligação química; modelo explicativo para a transformação química; energia de ligação; modelo explicativo para transformações químicas exotérmicas e endotérmicas.
Competências e habilidades: empregar a linguagem química; interpretar a transformação química como a quebra e formação de ligações; compreender e identificar a energia envolvida na quebra e formação deligações químicas; fazer previsões a respeito da energia envolvida numa transformação química.
Estratégias de ensino: aula expositiva dialogada; resolução de problemas; trabalho individual.
Recursos: texto; materiais de laboratório; roteiro experimental.
Avaliação: respostas às questões.
Forças intermoleculares
Forças intermoleculares são as forças exercidas para manter unidas duas ou mais moléculas.
Elas correspondem a ligações químicas que têm a função de unir ou repelir as moléculas de um composto.
As forças intermoleculares provocam estados físicos diferentes nos compostos químicos. Essa interação pode ser mais ou menos forte, conforme a polaridade das moléculas.
É importante saber que as forças intermoleculares são um tipo de ligação química. As demais são as “forças intramoleculares”.
Assim, as forças intermoleculares são exercidas entre as moléculas e as intramoleculares no interior das moléculas.
As forças intramoleculares são:
Forças de Van Der Waals
O conjunto das forças intermoleculares também pode ser chamado de Forças de Van der Waals. Recebem definições diferentes a depender do autor consultado: uns a conceituam como interações intermoleculares fracas (dipolo-dipolo – forças de Keesom, de orientação -, dipolo-dipolo induzido – forças de Debye, de indução -, e dipolo instantâneo – dipolo induzido – interações de dispersão ou forças de London; outros trazem esse termo como sinônimo de forças de London
Momento de Dipolo
O vetor momento de dipolo de uma molécula é dado como o indicador da polaridade da mesma: semelhante a uma pilha (que apresenta dois pólos – negativo e positivo), uma molécula possui regiões onde a diferença de eletronegatividade entre átomos ligantes desloca a nuvem eletrônica para um deles. Isso significa que o par de elétrons compartilhado estará na maior parte do tempo ao redor do mais eletronegativo – na mecânica quântica, diz-se que a densidade de probabilidade de encontrar os elétrons encontra-se maior na região onde a nuvem é mais notável (ao redor do átomo com maior eletronegatividade).
Essas regiões podem ser caracterizadas por uma parte positiva (onde a nuvem eletrônica é menos densa) e uma negativa (onde é mais densa), assim, um vetor pode ser utilizado para representar a diferença de potencial entre esses dois pontos: o vetor nasce no pólo positivo e é direcionado para o negativo.
A molécula é dita polar quando a soma desses vetores produz um vetor resultante de módulo diferente de zero; o contrário vale para uma molécula apolar, onde a soma dos vetores de cada região (delimitada por dois átomos ligantes entre si) resulta num vetor cujo módulo é igual a zero.
Classificação
As forças intermoleculares são classificadas em três tipos que variam conforme a intensidade:
- Ligação de Hidrogênio: Ligação de forte intensidade.
- Dipolo Permanente ou dipolo-dipolo: Ligação de média intensidade.
- Dipolo Induzido ou Forças de London: Ligação de fraca intensidade.
Ligação de Hidrogênio
A ligação ou ponte de hidrogênio ocorre em moléculas polares que têm o hidrogênio unido a elementos com volume atômico baixo e eletronegativos, como o oxigênio (O), Flúor (F) e Nitrogênio (N).
É a força intermolecular mais forte, pois existe uma grande diferença de eletronegatividade entre os elementos.
Um exemplo de ligação de hidrogênio ocorre na molécula de água (H2O).
Que a ligação de hidrogênio ocorre entre átomos de alta eletronegatividade é indiscutível. O que muitas vezes pode fugir à literatura é considerar apenas o nitrogênio, o flúor e o oxigênio como os potencias átomos para tal interação. Ora, existem outros átomos também muito eletronegativos (como o de cloro) que podem experimentar tal fenômeno. Assim, não é justo limitar o universo de possibilidades para apenas o grupo N,F,O.
A ligação de hidrogênio, muitas vezes erroneamente referenciada como ponte de hidrogênio, é um dos tipos de interação intermolecular – portanto não pode ser considerada uma ligação covalente – que confere certa estabilidade nas ligações com átomos de alta eletronegatividade. Frequentemente, podem ser observados líquidos com altos pontos de fusão justamente por apresentarem interações do tipo ligação de hidrogênio que necessitam de muita energia para serem rompidas. Às vezes, mesmo quando um líquido sofre ebulição total, várias ligações desse tipo podem permanecer na fase vapor: em uma determinada massa de ácido acético, por exemplo, vários dímeros são coexistentes com a forma H3CCOOH: Como pode ser visto no esquema acima, o grupo OH de uma molécula de ácido acético liga-se com o átomo de oxigênio da outra. Formando, então, a ligação de hidrogênio.
Como pode ser visto no esquema acima, o grupo OH de uma molécula de ácido acético liga-se com o átomo de oxigênio da outra. Formando, então, a ligação de hidrogênio.
Aspectos da ligação de hidrogênio
O hidrogênio só consegue formar esse tipo de ligação com outro átomo se, e somente se, sua carga parcial for positiva. Pois assim, pode aceitar um par eletrônico (ligação covalente coordenada).
No caso do ácido acético, tomando o hidrogênio do grupo OH, pode-se perceber que o par de elétrons compartilhado está mais próximo do átomo de oxigênio (mais eletronegativo). Portanto, o hidrogênio possui, nessa ligação, carga parcial positiva. E, ainda, por ser um átomo pequeno, consegue ser atraído por um dos pares eletrônicos isolados de um átomo de oxigênio (que possui 3) de outra molécula.
Daí surge uma interação extremamente forte ocasionada pela carga parcial positiva do hidrogênio com esse par eletrônico isolado: a ligação de hidrogênio propriamente dita.
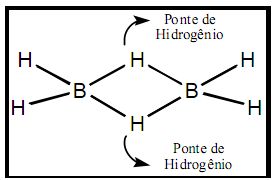
As verdadeiras pontes de hidrogênio
As pontes de hidrogênio não são sinônimas de ligações de hidrogênio, pois, mesmo que possuam tal espécie em comum, são situações completamente diferentes: as pontes de hidrogênio representam um arranjo molecular constituído por 2 elétrons divididos entre 3 átomos (3 centros, 2 elétrons):
Na diborana (B2H6), por exemplo, dois átomos de boro estão ligados entre si pela presença de átomos de hidrogênio que formam, literalmente, uma ponte entre eles. Assim, a espécie BH3 não é evidenciada, mas o seu dímero.
Nesse exemplo, 2 elétrons do hidrogênio de cada ponte são divididos para os 2 átomos de boro (logo, 2 elétrons e 3 átomos – BHB).
Força intermolecular dipolo-dipolo
Dipolo-dipolo
Interações desse tipo são características de substâncias constituídas por moléculas polares, onde o pólo positivo de uma molécula liga-se com o pólo negativo de outra. Assim repetindo-se indefinidas vezes.
As interações dipolo-dipolo ou interações entre dipolos permanentes são forças atrativas que ocorrem entre moléculas polares e é considerada uma interação de força intermediária. Nesse caso, o hidrogênio não interage diretamente com F, N e O. elétrons estão distribuídos de forma assimétrica e assim o elemento mais eletronegativo atrai os elétrons para si.
A força dipolo permanente-dipolo permanente, ou simplesmente, dipolo-dipolo ocorre somente em moléculas polares, isto é, aquelas que não apresentam distribuição uniforme de carga ao longo de sua superfície. Para citar um exemplo, na molécula de HCl (gás clorídrico) a nuvem eletrônica está mais deslocada no sentido do átomo de cloro, pois ele é mais eletronegativo que o hidrogênio.
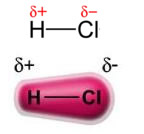
Observe que ao redor do átomo de cloro há um acúmulo de elétrons, o que acarreta a formação de um polo negativo, que é simbolizado pela letra grega delta (-δ). Em consequência, na região ao redor do átomo de hidrogênio é formado um polo positivo (+δ), pois possui baixa densidade eletrônica. A molécula de HCl constitui, então, um dipolo elétrico e, com isso, ao entrar em contato com outras moléculas de HCl vizinhas, ocorre uma força de atração entre os polos contrários das moléculas, conforme é possível visualizar logo abaixo:
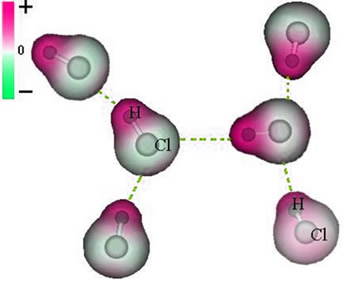
Essa força de atração que se estabelece entre a extremidade negativa do dipolo de uma molécula com a extremidade positiva do dipolo de outra molécula, constitui a força dipolo-dipolo.
Assim, como o próprio nome diz, o dipolo é permanente, por isso ela ocorre só em compostos polares. E quanto maior a polaridade de uma molécula, mais intensas serão as interações dipolo-dipolo na substância.
Se estiver na fase sólida, a formação do dipolo permanente orienta a posição de cada molécula no espaço, formando cristais dipolares; como ocorre no caso do brometo de hidrogênio ilustrado a seguir:
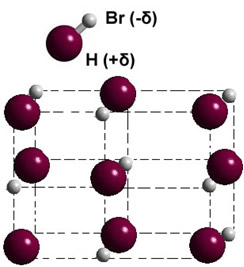
Outros exemplos de substâncias polares que possuem a força dipolo-dipolo entre as suas moléculas são: H2S, CO, HCCl3, SO2.
Essa força intermolecular é de intensidade média, pois se apresenta mais forte que a força de atração dipolo induzido-dipolo induzido, porém menos intensa que a ligação de hidrogênio. É por isso que seus pontos de fusão e ebulição são maiores que os das substâncias que possuem força de dipolo induzido. Como a força dipolo permanente é mais forte, é necessário o fornecimento de mais energia para que as interações de suas moléculas se rompam.
Forças dipolo induzido-dipolo induzido ou dispersão de London
As forças dipolo induzido-dipolo induzido são de fraca intensidade e ocorrem entre moléculas apolares, entre átomos de gases nobres ou entre moléculas polares e apolares. Essa força ocorre por uma deformação momentânea na nuvem eletrônica da molécula.

Dentre as forças intermoleculares, as forças dipolo induzido-dipolo induzido são as únicas que não foram estudadas pelo físico holandês Johannes Diederik Van der Waals (1837-1923). Elas foram elucidadas pelo físico alemão Fritz Wolfgang London (1900-1954), por isso essas forças também são denominadas de forças de London ou forças de dispersão de London. Outra denominação dada a essas forças é dipolo instantâneo-dipolo induzido.
Esse tipo de força ocorre em substâncias apolares, como o H2, O2, F2, Cl2, CO2, CH4 e C2H6, entre outras. E podem ocorrer também entre átomos de gases nobres, quando estes se aproximam, causando repulsão entre suas eletrosferas. Desse modo, os elétrons se acumulam em determinado lado, que fica polarizado negativamente e o lado oposto positivamente, em razão da deficiência de carga negativa.
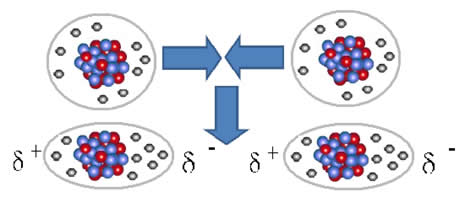
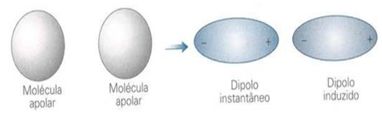
As moléculas apolares podem passar do estado gasoso – em que elas estão muito distanciadas e não há nenhuma interação, pois não há polos –, para o estado líquido e sólido. Nesses estados de agregação, as moléculas estão mais próximas e as atrações ou repulsões eletrônicas entre seus elétrons e núcleos podem levar a uma deformação de suas nuvens eletrônicas, momentaneamente, originando polos positivos e negativos temporários.
Os dipolos instantâneos podem induzir a polarização de moléculas vizinhas, resultando em forças atrativas.
Essa indução pode ocorrer também entre moléculas diferentes e geralmente essas forças são mais fracas de intensidade que as forças de dipolo-dipolo e a da ligação de hidrogênio. Por isso, sólidos com essa força de interação como o gelo-seco (dióxido de carbono – CO2) e o iodo (I2), que estão no estado sólido, sublimam (passam para o estado gasoso); porque a energia necessária para romper suas interações é pequena.
Um exemplo de forças intermoleculares entre moléculas polares e apolares ocorre entre o gás oxigênio (apolar) e a água (polar). Acontece que a extremidade negativa da água se aproxima do O2, se repelindo e, assim, a nuvem eletrônica da molécula apolar se afasta. O oxigênio fica, então, momentaneamente polarizado e passa a interagir com a água se solubilizando nela.
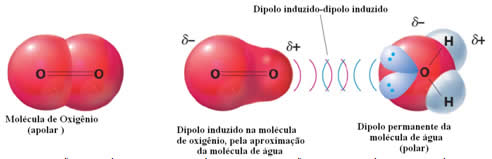
Visto que essas forças são fracas, a solubilidade desse gás em água é pequena. Mesmo assim, sua presença é essencial para preservar a vida de vários organismos aquáticos.
Essa força de interação ocorre também na natureza, dando a aderência entre as patas das lagartixas e a superfície por onde caminham. Por isso elas conseguem caminhar sobre paredes e tetos sem cair ou grudar.
Dipolo induzido – Dipolo instantâneo
O dipolo induzido é constituído pela atração não gravitacional que ocorre entre todas as moléculas apolares e polares.
Os elétrons estão distribuídos de forma uniforme e não há formação de dipolo elétrico. Porém, quando as moléculas se aproximam induzem a formação de dipolos temporários.
As interações dipolo permanente – dipolo induzido são observadas quando uma molécula polar deforma a nuvem eletrônica de uma molécula apolar. Assim, induz a formação de um dipolo.
Os elétrons que constituem a nuvem eletrônica de uma molécula estão em constante movimento, assim, se pudéssemos tirar fotografias dessa nuvem, elas não representariam a mesma imagem.
Ou seja, em moléculas apolares, há possibilidade de tornar-se polar durante um curto período de tempo. Entretanto, esse tempo é o bastante para que deforme a nuvem de outra molécula apolar e induza-a, de modo a formar dois pólos distintos (positivo e negativo). Tendo assim um dipolo induzido.
Verifica-se que a polarizabilidade de uma molécula apolar cresce com o seu tamanho, pois os elétrons da nuvem circundante encontram-se menos atraídos pelo núcleo. Por exemplo: o flúor se encontra no estado gasoso nas CNTP ao ponto que o iodo está no estado sólido.
Como a molécula de iodo é bem maior que a de flúor, é mais facilmente polarizável, assim, mesmo que as duas sejam apolares, as interações dipolo instantâneo – dipolo induzido são mais intensas na primeira substâncias.
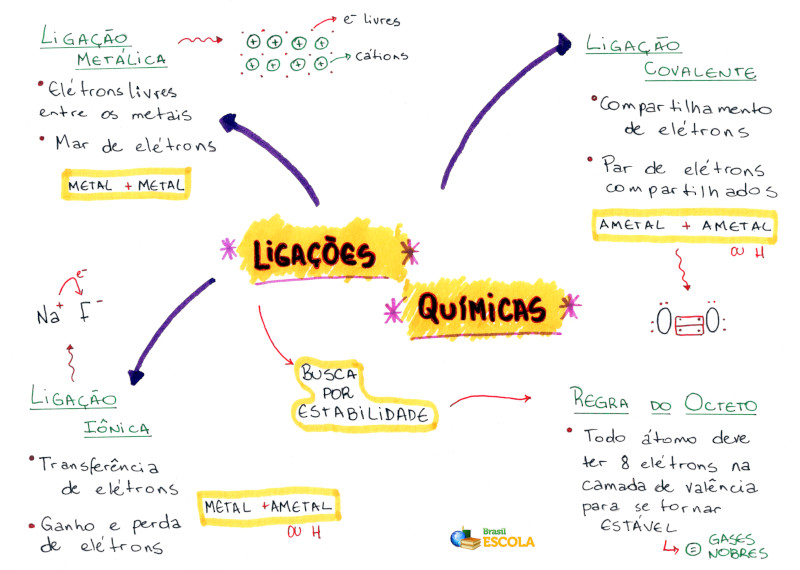
Ligações químicas
ligações químicas correspondem à união dos átomos para a formação das moléculas. Em outras palavras, as ligações químicas acontecem quando os átomos reagem entre si.
São classificadas em: ligação iônica, ligação covalente, ligação covalente dativa e ligação metálica.
É impossível se pensar em átomos como os constituintes básicos da matéria sem se pensar em ligações químicas. Afinal, como podemos explicar que porções tão limitadas de matéria, quanto os átomos, possam formar os corpos com que nos deparamos no mundo macroscópico do dia-a-dia. Também é impossível se falar em ligações químicas sem falarmos em elétrons. Afinal, se átomos vão se unir uns aos outros para originar corpos maiores, nada mais sensato do que pensar que estes átomos entrarão em contato entre si. Quando dois átomos entram em contato, o fazem a través das fronteiras das suas eletrosferas, ou seja, de suas últimas camadas. Isso faz pensar que a última camada de um átomo é a que determina as condições de formação das ligações químicas.
Em 1868, Kekulé e Couper, propuseram a utilização do termo valência para explicar o poder de combinação de um átomo com outros. A valência de um dado elemento é que determina as fórmulas possíveis ou não de compostos formados por ele.
A primeira situação seria entender por que dois ou mais átomos se ligam, formando uma substância simples ou composta. Como, na natureza, os únicos átomos que podem ser encontrados no estado isolado (moléculas monoatômicas) são os gases nobres, logo se pensou que os demais átomos se ligariam entre si tentando alcançar a configuração eletrônica do gás nobre mais próximo deles na tabela periódica. Todos os gases nobres, com exceção do He, possuem 8 elétrons.
Esta maneira de pensar a ligação entre os átomos passou a ser conhecida por Teoria do octeto, e foi proposta por Kossel e Lewis no início do século XX. Baseado nessa idéia, a valência de um átomo passou a ser vista como a quantidade de elétrons que um átomo deveria receber, perder ou compartilhar para tornar sua última camada (camada de valência) igual a do gás nobre de número atômico mais próximo, algumas características como por exemplo, a estabilidade desse elementos preenchidas por 8 elétrons na Camada de Valência.
A partir disso, a “Teoria ou Regra do Octeto” postula que um átomo adquire estabilidade quando possui 8 elétrons na camada de valência (camada eletrônica mais externa), ou 2 elétrons quando possui apenas uma camada.
Para tanto, o átomo procura sua estabilidade doando ou compartilhando elétrons com outros átomos, donde surgem as ligações químicas.
As ligações químicas podem ser classificadas em três categorias:
– Iônica – Covalente normal e dativa – Metálica
Ligação Iônica
Também chamada de ligação eletrovalente, esse tipo de ligação é realizada entre íons (cátions e ânions), daí o termo “ligação iônica“.
Os Íons são átomos que possuem uma carga elétrica por adição ou perda de um ou mais elétrons, portanto um ânion, de carga elétrica negativa, se une com um cátion de carga positiva formando um composto iônico por meio da interação eletrostática existente entre eles.
A ligação iônica ocorre com a formação de íons. A atração entre os átomos que formam o composto é de origem eletrostática. Sempre um dos átomos perde elétrons, enquanto o outro recebe. O átomo mais eletronegativo arranca os elétrons do de menor eletronegatividade. Ocorre entre metais e não metais e entre metais e hidrogênio.
átomo com facilidade para liberar os elétrons da última camada: metal
átomo com facilidade de adicionar elétrons à sua última camada: não metal
A ligação iônica ocorre entre metais e não metais e entre metais e hidrogênio. Num composto iônico, a quantidade de cargas negativas e positivas é igual.
A ligação entre o sódio (11Na) e o cloro (17Cl) é um exemplo característico de ligação iônica. Observe a distribuição dos elétrons em camadas para os dois elementos:
Na 2 – 8 – 1 Cl 2 – 8 – 7
Para o cloro interessa adicionar um elétron à sua última camada, completando a quantidade de oito elétrons nela. Ao sódio interessa perder o elétron de sua camada M, assim a anterior passará a ser a última, já possuindo a quantidade necessária de elétrons. Na representação da ligação, utilizamos somente os elétrons da última camada de cada átomo. A seta indica quem cede e quem recebe o elétron. Cada elétron cedido deve ser simbolizado por uma seta. Esta representação é conhecida por fórmula eletrônica ou de Lewis.
O sódio possuía inicialmente 11 prótons e 11 elétrons. Após a ligação, a quantidade de prótons não se altera e a de elétrons passa a ser 10. O cloro que inicialmente possuía 17 prótons e 17 elétrons, tem sua quantidade de elétrons aumentada de uma unidade após a ligação. Com isso o sódio se torna um íon de carga 1+ e o cloro 1-. A força que mantém os dois átomos unidos é de atração elétrica, ou seja, uma ligação muito forte. Como foram utilizados um átomo de cada tipo, a fórmula do composto será NaCl.
De maneira análoga podemos observar a ligação entre o flúor (9F) e o alumínio (13Al). O alumínio perde os três elétrons de sua última camada, pois a penúltima já possui os oito elétrons necessários. Como o átomo de flúor possui 7 elétrons em sua última camada, precisa de apenas mais um elétron. São necessários três átomos de flúor para acomodar os três elétrons cedidos pelo alumínio.
De maneira análoga ao exemplo anterior, ocorre a formação de íons positivo e negativo devido a quebra do equilíbrio entre as quantidades de prótons e elétrons nos átomos. O alumínio passa a ser um íon de carga 3+ e o fluor 1-. A fórmula do composto será AlF3.
Ligação covalente simples
Também chamada de ligação molecular, as ligações covalentes são ligações em que ocorre o compartilhamento de elétrons para a formação de moléculas estáveis, segundo a Teoria do Octeto; diferentemente das ligações iônicas em que há perda ou ganho de elétrons.
Além disso, os pares eletrônicos é o nome dado aos elétrons cedido por cada um dos núcleos, figurando o compartilhamento dos elétrons das ligações covalentes.
Como exemplo, observe a molécula de água H2O: H – O – H, formada por dois átomos de hidrogênio e um de oxigênio em que cada traço corresponde a um par de elétrons compartilhado formando um molécula neutra, uma vez que não há perda nem ganho de elétrons nesse tipo de ligação.
Ligação Covalente Dativa ou coordenada
A existência de algumas moléculas não pode ser explicada simplesmente através da ligação covalente simples. Para estes casos foi formulada a teoria da ligação covalente coordenada. Neste tipo de ligação, um dos átomos que já estiver com última camada completa entra com os dois elétrons do par compartilhado. Este par de elétrons apresenta as mesmas características do da ligação covalente simples, a única diferença é a origem dos elétrons, que é somente um dos átomos participantes da ligação. Os elétrons do par passam a pertencer a ambos os átomos participantes. A ligação covalente coordenada é representada por uma seta que se origina no átomo doador e termina no átomo receptor.
Dadas as distribuições eletrônicas em camadas para os átomos de 16S e 8O.
S 2 – 8 – 6 O 2 – 6
Compartilhando dois elétrons através de ligações covalentes simples, ambos os átomos atingem os oito elétrons na última camada.
No entanto, esta molécula ainda pode incorporar ainda um ou dois átomos de oxigênio. Tal fato só pode ser explicado se o enxofre utilizar um ou dois pares de elétrons não envolvidos em ligações para formar um ou dois pares dativos com o oxigênio.
Representada por uma seta um exemplo desse tipo de ligação é o composto dióxido de enxofre SO2: O = S → O
Isso ocorre porque é estabelecida uma dupla ligação do enxofre com um dos oxigênios a fim a de atingir sua estabilidade eletrônica e, além disso, o enxofre doa um par de seus elétrons para o outro oxigênio para que ele fique com oito elétrons na sua camada de valência.
Outra molécula que não pode ser explicada somente com a ligação covalente simples é a de CO2. O interessante desta molécula é que a ligação covalente dativa ocorre do átomo mais eletronegativo (O) para o menos eletronegativo (C).
É o tipo de ligação que ocorre quando os dois átomos precisam adicionar elétrons em suas últimas camadas. Somente o compartilhamento é que pode assegurar que que estes átomos atinjam a quantidade de elétrons necessária em suas últimas camadas. Cada um dos átomos envolvidos entra com um elétron para a formação de um par compartilhado, que a partir da formação passará a pertencer a ambos os átomos. Ocorre entre não metais e não metais, não metais e hidrogênio e entre hidrogênio e hidrogênio.
O hidrogênio possui somente uma camada contendo um único elétron, compartilhando 1 elétron, atinge a quantidade necessária para a camada K, que é de dois elétrons. Os elétrons compartilhados passam a ser contados para as eletrosferas dos dois átomos participantes da ligação.
Na molécula de nitrogênio ocorrem três ligações covalentes entre os dois átomos.
7N 2 – 5
Estas três ligações garantem que os dois átomos de nitrogênio atinjam a quantidade de oito elétrons nas suas últimas camadas. A ligação covalente entre dois átomos iguais é dita apolar, pois nela os elétrons são compartilhados de maneira igual, nenhum dos átomos tem mais força que o outro para atrair o elétron para si.
A molécula de CO2 é formada por dois átomos de oxigênio e um de carbono unidos através de ligações covalentes.
6C 2 – 4 8O 2 – 6
O átomo de carbono compartilha 4 elétrons e cada átomo de carbono 2, garantindo assim que ambos atinjam os oito elétrons nas últimas camadas.
Como a ligação é entre átomos diferentes e com diferentes eletronegatividades, a ligação é dita polar pois o átomo de oxigênio atrai para si mais fortemente os elétrons compartilhados.
Além da fórmula eletrônica, os compostos covalentes podem ser representados pela fórmula estrutural, onde cada par compartilhado é representado por um traço. Ex.: H – H, O = C = O.
Uma ligação covalente unindo dois átomos é dita simples. O conjunto de duas ligações unindo dois átomos é dito dupla ligação. O conjunto de rês ligações unindo dois átomos é dito tripla ligação.
Ligação metálica
É o tipo de ligação que ocorre entre os átomos de metais. Os átomos dos elementos metálicos apresentam forte tendência a doarem seus elétrons de última camada. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última chamados de “elétrons livres” formando assim, os cátions.
Forma-se então uma rede ordenada de íons positivos mergulhada num mar de elétrons em movimento aleatório. Se aplicarmos um campo elétrico a um metal, orientamos o movimento dos elétrons numa direção preferencial, ou seja, geramos uma corrente elétrica.
A partir disso, os elétrons liberados na ligação metálica formam uma “nuvem eletrônica”, também chamada de “mar de elétrons” que produz uma força fazendo com que os átomos do metal permaneçam unidos. Exemplos de metais: Ouro (Au), Cobre (Cu), Prata(Ag), Ferro (Fe), Níquel (Ni), Alumínio (Al), Chumbo (Pb), Zinco (Zn), entre outros.
Iônica
A ligação iônica é considerada uma ligação química forte. Ela é produzida pela atração eletrostática entre íons de cargas diferentes (+ e -). Consiste na relação estabelecida entre metal e não-metal por meio da transferência de elétrons.
As forças que produzem a ligação covalente resultam na partilha de pares de elétrons entre dois átomos de não-metais.
A maior parte dos compostos covalentes tem pontos de ebulição e fusão baixos, são pouco solúveis em água e dissolvem-se com facilidade em solventes apolares.
Metálica
A ligação metálica resulta das forças exercidas no interior das moléculas de substâncias metálicas.
Os metais têm poucos elétrons de valência, sendo bons condutores de eletricidade, calor e refletem a radiação.
 Leia também sobre Ligações Químicas.
Leia também sobre Ligações Químicas.
Exercícios
1. Enem (2011/ Questão 58/ prova branca) A pele humana, quando está bem hidratada, adquire boa elasticidade e aspecto macio e suave. Em contrapartida, quando está ressecada, perde sua elasticidade e se apresenta opaca e áspera.
Para evitar o ressecamento da pele é necessário, sempre que possível, utilizar hidratantes umectantes, feitos geralmente à base de glicerina e polietilenoglicol:
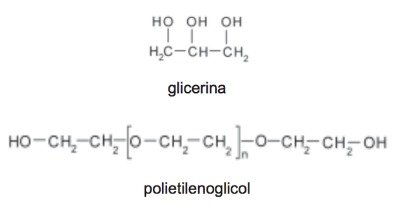
A retenção de água na superfície da pele promovida pelos hidratantes é consequência da interação dos grupos hidroxila dos agentes umectantes com a umidade contida no ambiente por meio de:
a) ligações iônicas
b) forças de London
c) ligações covalentes
d) forças dipolo-dipolo
e) ligações de hidrogênio
2. (UERJ-1997) Água e etanol são dois líquidos miscíveis em quaisquer proporções devido a ligações intermoleculares, denominadas:
a) iônicas.
b) pontes de hidrogênio.
c) covalentes coordenadas.
d) dipolo induzido – dipolo induzido.
e) dipolo permanente
3. (Vunesp-2003) Pode-se verificar que uma massa de água ocupa maior volume no estado sólido (gelo) do que no estado líquido. Isto pode ser explicado pela natureza dipolar das ligações entre os átomos de hidrogênio e oxigênio, pela geometria da molécula de água e pela rigidez dos cristais. As interações entre as moléculas de água são denominadas
a forças de Van der Waals.
b) forças de dipolo induzido.
c) forças de dipolo permanente.
d) pontes de hidrogênio.
e) ligações covalentes.
A Escala de Pauling foi definida por Linus Pauling e tem a função de medir a eletronegatividade dos elementos químicos.
A eletronegatividade está relacionada à atratividade dos átomos e moléculas, ou seja, ao potencial que estes possuem de atrair elétrons.
Na tabela periódica, a eletronegatividade aumenta da esquerda para a direita e de baixo para cima, ou seja, conforme os períodos aumentam, maior é o número de camadas da eletrosfera dos elementos e, portanto, maior o seu raio, o que influencia diretamente na sua eletronegatividade, já que haverá uma aproximação menor entre os elétrons a serem compartilhados e o núcleo do átomo, que exerce o ponto de atração.
Assim, o elemento mais eletronegativo é o flúor. A ordem de polaridade é, portanto:
F > O > N > Cl > Br > I > S > C > P > H
A eletronegatividade influencia na ligação entre os átomos, já que haverá a possibilidade de maior ou menor atração.
O átomo com mais eletronegatividade atrai para si mais elétrons. A diferença de eletronegatividade entre os elementos determina se a ligação será polar ou apolar. Se a diferença de eletronegatividade for igual a zero, a ligação será apolar, do contrário a ligação será polar.
Polaridade das ligações químicas
A polaridade das ligações químicas explica fatores como o fato de água e óleo não se misturarem. Em razão da polaridade das moléculas da água, uma das ligações mais fortes conhecidas, o óleo permanece em sua superfície, já que, para que pudesse imiscuir-se na água seria necessário o fornecimento de uma quantidade razoável de energia para “quebrar” suas moléculas ou, ainda, que sua ligação fosse, também, polar, o que não ocorre, já que as ligações químicas de óleos e gorduras são apolares. Além disso, os hidrocarbonetos, moléculas formadas por Hidrogênio e Carbono, muitos deles derivados do petróleo, são, também, apolares.
Uma substância polar pode imiscuir-se numa substância polar, da mesma forma que as substâncias apolares podem imiscuir-se entre si.
A eletronegatividade está, portanto, relacionada à força para rompimento de ligações químicas das moléculas.
Numa ligação química, o átomo com maior eletronegatividade, ao atrair os elétrons, fica com a carga negativa. Por outro lado, os átomos com menor eletronegatividade perdem elétrons e, em razão disso, adquirem uma carga positiva.
Raio atômico
Além do raio atômico, outro fator que influencia a eletronegatividade é o número de elétrons que o átomo possui em sua última camada. Quanto maior o número de elétrons, mais o átomo deseja atrair elétrons externos para alcançar a estabilidade (8 elétrons na última camada). Porém, tal fator não deve ser considerado como único critério, já que demonstrações práticas sugerem que o Cloro, que possui 7 elétrons na camada de valência, é menos eletronegativo que o Oxigênio, que possui 6 elétrons na camada de valência. Na+Cl– = NaCl (cloreto de sódio ou sal de cozinha)
Fontes:
ATKINS, Peter. LORETTA, Jones. Princípios de química: questionando a vida moderna e o meio ambiente; tradução Ricardo Bicca de Alencastro. – 3ª Ed. – Porto Alegre: Bookman, 2006. 968 páginas.
http://sec.sbq.org.br/cd29ra/resumos/T1907-1.pdf
FOGAçA, Jennifer Rocha Vargas. “Força intermolecular dipolo-dipolo”; Brasil Escola. Disponível em: https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm. Acesso em 22 de agosto de 2019.