Número de oxidação (Nox)
O número de oxidação (nox / Nox) corresponde a carga elétrica real do íon, ou seja, é o número de elétrons que o átomo realmente perdeu ou ganhou durante uma reação química.
Isso ocorre durante as reações de oxirredução, as quais envolvem a transferência de elétrons entre átomos, íons ou moléculas. Um exemplo de reação desse tipo é a combustão.
Desse modo, temos dois conceitos diferentes para oxidação e redução:
Oxidação: perda de elétrons e aumento do número de oxidação.
Redução: ganho de elétrons e redução do número de oxidação.
O elementos tendem a ganhar, compartilhar ou perder elétrons com o objetivo de se tornarem estáveis, ou seja, apresentar oito elétrons na camada de valência.
O conceito de número de oxidação possui relação com a eletronegatividade, ou seja, a tendência que o átomo do elemento apresenta para atrair elétrons quando ligado a outro átomo. Por exemplo, os metais são pouco eletronegativos, enquanto os ametais são bastante eletronegativos.
Como determinar o Número de Oxidação?
O número de oxidação varia conforme cada elemento químico. Para descobrir o número de oxidação de um elemento químico, existe um conjunto de regras que devem ser seguidas:
1. Nox de substâncias simples
O Nox de cada átomo em uma substância simples é sempre igual a zero. Isso ocorre porque não existe diferença de eletronegatividade entre os elementos.
Exemplos: Fe, Zn, Au, H2, O2. Todos esses elementos possuem nox igual a 0.
2. Nox de íons monoatômicos
O número de oxidação de um íon monoatômico é sempre igual à sua própria carga.
Exemplos:
K+ = + 1
F- = – 1
N-3 = – 3
3. Nox de íons compostos
Em íons compostos a soma dos Nox dos elementos que compõem o íon é sempre igual à sua carga.
A soma dos Nox de todos os átomos constituintes de um composto iônico ou molecular é sempre zero.
No caso do hidrogênio em seus compostos, o número de oxidação é sempre +1, exceto quando ocorrem hidretos metálicos, onde o nox é -1.
No caso do oxigênio em seus compostos, o número de oxidação é -2. A exceção ocorre com o fluoreto de oxigênio (OF2), no qual o nox é +2, e nos peróxidos, onde o nox é -1.
4. Elementos com nox fixo
Alguns elementos apresentam Nox fixo nos compostos em que fazem parte.
Família / Elementos
Nox
Metais alcalinos (1A) e prata (Ag)
+1
Metais alcalinos terrosos (2A) e zinco (Zn)
+2
Alumínio (Al)
+3
Flúor (F)
-1
Exercícios
1. (FGV – SP) Dadas as seguintes espécies químicas: H2S, SO2, H2SO4, H2SO3 e S8, podemos dizer que o número de oxidação do enxofre (S) nessas substâncias é, respectivamente:
a) +2, +2, +6, +6, -2
b) -2, +4, +6, +4, 0
c) +2, +4, +4, +6, -2
d) +2, +4, +4, +4, 0
e) -2, +2, +6, +4, 0
Resposta b) -2, +4, +6, +4, 0
2. (UFSCar – SP) Os números de oxidação do enxofre em H2S, S8 e Na2SO3 são, respectivamente:
a) +2, -8 e -4.
b) -2, zero, e +4.
c) zero, -4 e +3.
d) +1, -2 e -3.
e) -6, +8 e -5
Resposta b) -2, zero, e +4.
3. (PUC – MG – 2006) O número de oxidação (Nox) de um elemento quantifica seu estado de oxidação. Qual é o Nox de Cr no ânion Cr2O72-?
a) +3
b) +5
c) +6
d) +7
Resposta c) +6
4. (PUC – RS – 2003) O número de oxidação do átomo de carbono nas estruturas CH4, HCHO e CO32- é, respectivamente:
a) +4 0 -4
b) -4 0 +4
c) 0 +4 -4
d) -4 -4 0
e) +4 +4 -4
Resposta b) -4 0 +4
Oxidação
Oxidação é a reação química em que átomos, íons ou moléculas perdem elétrons. Ela também provoca o aumento do número de oxidação (nox).
O termo oxidação foi inicialmente criado para denominar as reações nas quais o oxigênio era o reagente. Porém, descobriu-se que em alguns casos, ocorriam na ausência desse elemento. Como o termo já era amplamente conhecido, continuou em uso.
As reações de oxidação ocorrem simultaneamente com as reações de redução. Por isso, são chamadas de oxirredução (redox), na qual existe a transferência de elétrons.
Em reações de oxirredução, o agente oxidante é o que aceita os elétrons, sofrendo redução. O agente redutor perde os elétrons e sofre oxidação.
Exemplos de Oxidação
Oxidação do Ferro
A ferrugem é a oxidação do ferro. Todos os metais podem sofrer oxidação. Ela ocorre devido o contato dos metais com o ar e a água. Inicialmente, forma-se a corrosão que é o desgaste do metal, em virtude da oxidação. Daí, forma-se a ferrugem.
Veja a reação de oxirredução para formação da ferrugem:
Fe(s) → Fe2+ + 2e-. Nessa etapa, o ferro perde dois elétrons, sofre a oxidação
O2 + 2 H2O + 4e- → 4OH-. Redução do O2
2Fe + O2 + 2H2O → 2 Fe(OH)2. Equação Geral – O Fe(OH)2 é o Hidróxido de Ferro, responsável pela coloração castanha da ferrugem.
Para proteger o ferro e o aço da oxidação, pode-se utilizar a técnica de galvanização. Ela consiste no revestimento com zinco metálico. Entretanto, é um processo caro, tornando-se inviável em alguns casos.
Assim, os cascos de navios e plataformas metálicas recebem blocos de magnésio metálico que impedem a oxidação do ferro. O magnésio é considerado um metal de sacrifício e precisa ser substituído de tempos em tempos, quando sofre desgaste.
A pintura também pode proteger o metal da oxidação, mas não é tão eficiente.
Oxidação na Química Orgânica
Além dos metais, a oxidação também pode ocorrer com hidrocarbonetos, especialmente os alcenos. A oxidação orgânica apresenta quatro formas: a combustão, a ozonólise, a oxidação branda e a oxidação energética.
Ozonólise de alcenos
A ozonólise é a reação de alcenos e ozônio, O3(g), catalisada pelo zinco metálico, Zn(s), formando aldeídos e/ou cetonas, além de peróxido de hidrogênio. Se o carbono da dupla ligação do alceno for primário ou secundário, forma-se um aldeído; mas se ele for terciário, o produto será uma cetona.
A ozonólise é um tipo de reação eficiente para a oxidação de um composto insaturado com rompimento de sua dupla ligação. Ela ocorre entre um alqueno (alceno) e um ozônio (O3), como agente oxidante. A seguir ocorre a sua hidrólise ao reagir com a água (H2O) em presença de zinco em pó ou limalhas de zinco (Zn) como catalisadores, formando os produtos principais: aldeídos e/ou cetonas, além da água oxigenada (H2O2).
De maneira simplificada podemos dizer que a ozonólise é uma reação com ozônio seguida de hidrólise. Sua equação química é escrita segundo a forma abaixo, considerando um alceno genérico:
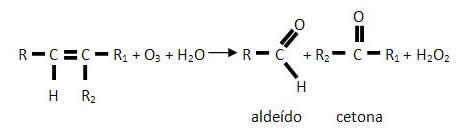
É exatamente em virtude da formação da água oxigenada que o zinco em pó é introduzido, pois ele destrói a água oxigenada formada, evitando que o oxigênio que pode ser produzido pela sua decomposição, oxide o aldeído em ácido carboxílico.
Essa reação forma primeiro um composto intermediário estável chamado de ozoneto ou ozonida, ou ainda ozonídeo. Esse é um produto da ligação dos átomos de oxigênio do ozônio com os carbonos que formam a dupla ligação do alqueno. O ozoneto é um composto instável e explosivo.
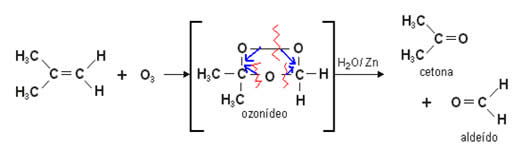
Observamos que ocorre a quebra da ligação dupla carbono-carbono (C=C) e estes passam a participar da ligação dupla com o oxigênio (C=O) nas novas substâncias formadas que podem ser aldeídos ou cetonas.
Para sabermos se ocorrerá a formação de aldeídos ou de cetonas, depende da molécula de alceno inicial, ou seja, depende da localização da dupla no alceno e se o carbono ligado à ligação dupla é primário, secundário ou terciário. Além disso, a estrutura desconhecida do alceno pode também ser determinada pelos produtos formados. Assim, temos a seguinte regra:
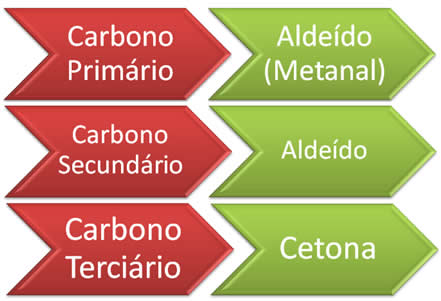
Combustão
A combustão é uma reação química de uma substância com oxigênio, na qual culmina com a produção de luz e calor. O oxigênio é denominado comburente. A substância com carbono é o combustível.
O oxigênio tem como função oxidar o combustível, é o agente oxidante da combustão.
A combustão pode ser completa ou incompleta. Saiba a diferença entre as duas formas:
Combustão Completa: Ocorre quando há suprimento suficiente de oxigênio. Ao final da reação, formam-se dióxido de carbono (CO2) e água (H2O).
Combustão Incompleta: Não há suprimento suficiente de oxigênio, formam-se monóxido de carbono (CO) e água (H2O).
Ozonólise
Nesse tipo de reação, o ozônio é o reagente que causa a oxidação dos alcenos. Ocorre a quebra da ligação dupla dos alcenos e a formação de compostos carbonilados, como aldeídos e cetonas.
Reação de Ozonólise
Oxidação Branda
A oxidação branda ocorre quando o agente oxidante é um composto como o permanganato de potássio (KMnO4), presente em solução aquosa, diluída e resfriada, neutra ou ligeramente básica.
Esse tipo de oxidação ocorre com o uso do Teste de Baeyer, usado para diferenciar alcenos de ciclanos isômeros.
Reação de Oxidação Branda
Oxidação Energética
Nesse tipo de oxidação, o permanganato de potássio encontra-se em meio mais quente e ácido, tornando a reação mais energética. Os agentes oxidantes energéticos podem romper a ligação dupla dos alcenos.
Conforme a estrutura do alceno, podem ser formados cetonas e ácidos carboxílicos.
Fonte
https://www.todamateria.com.br/numero-de-oxidacao-nox/


