A Linguagem dos químicos
Conteúdos e temas: linguagem química (símbolos e fórmulas) e tabela periódica.
Competências e habilidades: ler símbolos químicos e compreender o significado dessa simbologia em termos de partículas (átomos).
Estratégias de ensino: Desenhar a Tabela Periódica e pesquisa sobre a construção histórica da tabela periódica.
Sugestão de avaliação: participação nas atividades; leitura e avaliação dos textos produzidos.
A representação simbólica dos elementos químicos foi mudando ao longo dos tempos.
Tornou-se importante para os químicos representar cada elemento, de um modo simples e entendido por todos, com caráter universal.
Foi Berzelius, cientista sueco, quem introduziu a notação simbólica, moderna, dos elementos.
Jacob Berzelius 1779-1848
São formados por uma, duas ou três letras do nome do elemento (escrito em latim, grego ou inglês):
– 1ª letra maiúscula; – Restantes letras minúsculas (quando necessárias). Exemplificando:
Carbono
Símbolo químico: C Letra maiúscula
Cálcio
Símbolo químico: Ca 1ª letra maiúscula – Restantes letras minúsculas
Nomes de alguns elementos e respectivos símbolos químicos:
Nome do elemento Cobre – do latim Cuprum – Símbolo químico Cu
Nome do elemento Sódio – do latim Natrium – Símbolo químico Na
Nome do elemento Prata – do latim Argentum – Símbolo químico Ag
O símbolo químico de um elemento representa:
– o nome desse elemento;
– um átomo desse elemento.
Exemplo:
Símbolo químico H – Nome do elemento Hidrogênio – representa um átomo do elemento hidrogênio.
Quando se pretende representar mais do que um átomo de um dado elemento (não ligado quimicamente) deves: Indicar, antes do símbolo químico e ao mesmo nível, o número de átomos desse elemento.
Por exemplo:
2 H – representa dois átomos do elemento hidrogénio;
3 O – representa três átomos do elemento oxigénio;
4 C – representa quatro átomos do elemento carbono;
As substâncias moleculares representam-se por meio de fórmulas químicas.
Há regras para escrever a fórmula química de qualquer substância molecular:
- Escrever os símbolos químicos dos elementos que entram na constituição da molécula;
- Colocar um índice numérico à direita, ligeiramente abaixo do símbolo do elemento.
- Este índice indica o número de átomos de cada elemento constituinte da molécula.
- Quando na molécula há apenas um átomo de um elemento químico, omitese o índice 1 (um) após o símbolo.
Por exemplo:
A água é uma substância molecular formada pelos elementos oxigênio e hidrogênio.
A fórmula química da água é: H2O1
Símbolo químico do hidrogênio, Símbolo químico do oxigênio.
A fórmula química de qualquer substância molecular tem um significado qualitativo e um significado quantitativo:
- qualitativamente, indica os elementos que constituem essa substância;
- quantitativamente, informa acerca do número de átomos de cada elemento que constituem a molécula.
Fórmulas químicas
H2 – Nome da substância – Di-hidrogénio -Significado quantitativo e qualitativo – Molécula formada por 2 átomos de hidrogênio.
N2 – Nome da substância – Diazoto -Significado quantitativo e qualitativo, Molécula formada por 2 átomos de azoto.
Equação química
Os reagentes são como ingredientes em uma receita de bolo e é claro que o produto será o bolo quando estiver pronto.
A equação química é a forma de se descrever uma reação química. Os reagentes são mostrados no lado esquerdo da equação e os produtos no lado direito.

Exemplo: a reação de síntese da amônia.
Ao analisar a reação nota-se que uma molécula nitrogênio (N2) reage com 3 moléculas de hidrogênio (H2) para formar 2 moléculas de amônia (NH3).
Lei de Lavoisier ( Lei da conservação das massas)
Num sistema fechado, quando duas ou mais substâncias reagem entre si, a massa total dos produtos é igual a soma das massas das substâncias reagentes.
“Na natureza nada se cria, nada se perde; tudo se transforma”
Massa dos reagentes = Massa dos produtos
Exemplos:
1) Considerando um sistema fechado a reação química:
A + B –> AB
Temos 5g de A e 10g de B, a massa total dos reagente é 15g.
De acordo com a lei de Lavoisier a massa total dos produtos será 15g.
O que é uma substância?
As substâncias são formadas por um único tipo de componente (átomos, moléculas ou aglomerados iônicos) e possuem propriedades constantes e definidas.

As substâncias são os materiais que possuem todas as propriedades bem definidas, determinadas e praticamente constantes.
Exemplos de três substâncias e suas propriedades
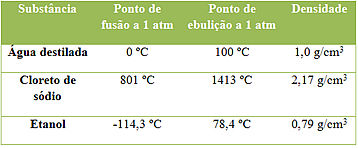
Observe que essas são três substâncias e que suas propriedades são constantes, quando medidas nas mesmas condições de temperatura e pressão. Mas cada uma possui os valores das suas propriedades diferentes, pois não existem duas substâncias que tenham todas as propriedades exatamente iguais. Isso é importante porque elas podem ser usadas para identificar uma substância.
Os átomos são as menores partes constituintes da matéria, sendo que eles podem permanecer isolados, como ocorre, por exemplo, no caso do gás hélio, que é formado por átomos de hélio (He); mas eles também podem se ligar de várias maneiras, formando moléculas (no caso dos que se ligam covalentemente por compartilhamento de pares de elétrons) ou aglomerados iônicos (que se ligam por ligação iônica, em que um doa definitivamente elétrons para o outro e formam-se íons que se atraem).
Assim, as substâncias podem ser formadas por átomos, moléculas ou aglomerados iônicos. A água e o etanol são formados por moléculas, que são, respectivamente, H2O e C2H5OH, enquanto o cloreto de sódio é formado por aglomerados iônicos, cuja fórmula unitária é NaCℓ.
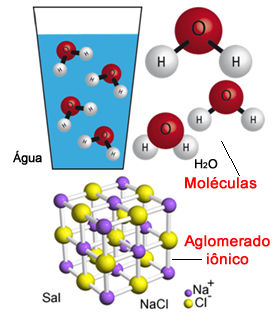
A água e o sal são exemplos de substâncias
Esses exemplos mostram que as substâncias podem ser classificadas de acordo com o agrupamento de átomos que as formam. Se os átomos que se unem para formar a substância forem do mesmo elemento químico, temos então uma substância simples. Alguns exemplos são: gás oxigênio (O2), gás hidrogênio (H2), ferro (Fe), gás hélio (He), alumínio (Aℓ) etc.
Por outro lado, se as substâncias forem formadas por átomos de dois ou mais elementos diferentes, como é o caso da água, do etanol e do cloreto de sódio, então serão classificadas como uma substância composta.
Na natureza não é muito comum encontrarmos as substâncias de forma isolada, pura. Geralmente, elas são encontradas misturadas com outras substâncias. Por exemplo, a água mineral que tomamos contém várias substâncias dissolvidas, e não somente moléculas de H2O; por isso, ela é uma mistura, e não uma substância.
Exercício
Água H2O, Dióxido de Carbono CO2, Amoníaco NH3, Propano C3H8
Nome da substância Modelo da molécula Significado quantitativo e qualitativo
Molécula formada por 2 átomos de hidrogénio e 1 átomo de oxigénio
Molécula formada por 1 átomo de carbono e 2 átomos de oxigénio
Molécula formada por 1 átomo de azoto e 3 átomos de oxigénio Molécula
(UNESP) Observe as figuras 1, 2 e 3.
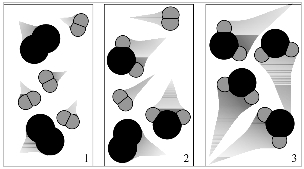
Elas podem representar diferentes momentos de uma reação entre:
a) os gases oxigênio e hélio.
b) os gases hidrogênio e oxigênio.
c) os gases hidrogênio e hélio.
d) os gases nitrogênio e cloro.
e) moléculas de iodo e oxigênio.
QUESTÃO 4
(UEPG) Estão representados abaixo quatro sistemas diferentes, nos quais as figuras de mesma forma e cor representam o mesmo elemento químico. Com base nessas informações, assinale o que for correto.
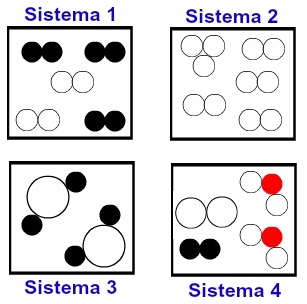
01. O sistema I contém somente substâncias simples.
02. No sistema II, ocorre alotropia.
04. O sistema III contém substância pura.
08. Os sistemas I e IV contêm misturas.
RESPOSTAS
Questão 1
Letra e). Na imagem, temos uma mistura porque há mais de uma substância (grupo de átomos). As outras alternativas estão incorretas porque:
a) Para determinar o número de átomos, basta somar as esferas presentes na imagem. Há 20 átomos na imagem.
b) Para determinar o número de substâncias, basta contar o número de moléculas que não se repetem. Na imagem, temos apenas 5, porque a molécula com dois átomos vermelhos repete-se.
c) Para determinar o número de moléculas, basta somar os grupos individuais de átomos. Na imagem, temos 6 moléculas.
d) Para determinar o número de elementos químicos, basta contar o número de esferas diferentes presentes na imagem, que é 3 (preta, azul e vermelha).
https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-substancia.htm


