Determinação de Oxigênio Presente no Ar
ESTRATÉGIAS DE ENSINO-APRENDIZAGEM
Para se determinar a porcentagem em volume de oxigênio no ar, basta colocar uma palha de aço do fundo de uma garrafa cortada e colocá-la num recipiente com água.

O conhecimento e o estudo dos gases, sua constituição e propriedades é muito importante na Química; afinal de contas, os gases estão constantemente presentes em nosso cotidiano. O mais presente e vital deles com certeza é o ar atmosférico, no qual estamos imersos.
O ar é composto por cerca de 78% de gás nitrogênio (N2), aproximadamente 20% de gás oxigênio (O2), aproximadamente 1% de gás argônio (Ar) e cerca de 1% de outros gases, como o gás carbônico (CO2) e vapor de água.
A atividade experimental a seguir pode ser usada pelo professor que estiver abordando o conteúdo de gases em sala de aula, sendo que seu objetivo é determinar a porcentagem em volume do gás oxigênio presente no ar atmosférico.
Materiais e Reagentes:
- Garrafa de refrigerante;
- Tesoura;
- Fita adesiva ou cola;
- Água
- Um recipiente transparente, como uma bacia;
- Palha de aço;
- Régua, ou fita métrica, ou, ainda, uma trena.
Procedimento Experimental:
1. Corte a parte superior da garrafa de refrigerante e faça furos próximos à borda, como mostrado abaixo:
.jpg)
2. Pregue a palha de aço no fundo da garrafa;
3. Inverta a garrafa e coloque no interior de um recipiente transparente;
4. Encha esse recipiente de água até cobrir os furos da garrafa;
5. Meça a distância entre o nível da água e o fundo da garrafa;
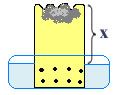
6. Deixe esse sistema em repouso por alguns dias;
7. Determine a distância entre o nível da água no interior da garrafa e o seu fundo:
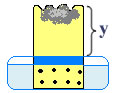
Resultados e Conclusão:
O oxigênio presente no ar reage em contato com o ferro, em determinadas condições, formando óxido de ferro, conhecido como ferrugem. Visto que o oxigênio do ar é consumido, o nível da água sobe, e o ar restante é constituído praticamente apenas de nitrogênio.
Ox equivale ao volume total do ar, que basicamente podemos dizer que é formado de oxigênio e nitrogênio. Já o ycorresponde ao volume de gás nitrogênio. Podemos, então, estabelecer a seguinte relação para determinar a porcentagem em volume de nitrogênio que estava presente no ar, que chamaremos de w:
x (em cm) ———– 100 % (em volume)
y (em cm) ———– w (em volume)
Portanto, a porcentagem de oxigênio presente no ar em volume, será o do ar (100%) menos o do gás nitrogênio:
(100 – w)% = % em volume de oxigênio
Por Jennifer Fogaça
Graduada em Química


