Modelos e Teorias Atômicas
Conteúdos e temas: modelos explicativos; modelo atômico de Dalton,Thomson, Rutherford e Bohr.
Competências e habilidades: interpretar as transformações químicas a partir das ideias de John Dalton sobre a constituição da matéria; compreender modelos e teorias como construções humanas.natureza elétrica da matéria – condutibilidade elétrica dos materiais, isolantes e condutores.
Competências e habilidades: classificação e estabelecimento de critérios; controle de variáveis; elaboração de modelo explicativo; ideias de Thomson, Rutherford e Bohr para o átomo; tabela periódica – estrutura e propriedades dos elementos.
Sugestão de estratégias de ensino: pesquisa; levantamento dos conhecimentos prévios; leitura de textos;exposição dialogada. experimentação para coleta de dados; organização dos dados em tabelas; proposição de questões para análise dos resultados; elaboração de conclusões; discussão geral.
Sugestão de avaliação: respostas às questões e participação na aula, elaboração de textos e outros.
Explicando o comportamento de materiais: modelos sobre a estrutura da matéria
Esses são, respectivamente, os principais modelos atômicos.
Visto que não é possível visualizar um átomo isoladamente, os cientistas, com o passar do tempo, criaram modelos atômicos, ou seja, imagens que servem para explicar a constituição, propriedades e comportamento dos átomos. Esses modelos explicam o que diz a teoria, mas isso não quer dizer que fisicamente o átomo seja igual ao seu modelo.
A ciência é baseada em modelos científicos. Para isso é preciso observar estudar, levantar hipóteses para poder explicar e realizar experimentos para poder compreender. Após essa etapa, é preciso analisar dados para que se possa comprovar a hipótese ou ao menos verificar se ela é viável ou não e se for, essa hipótese passa a ser uma TEORIA CIENTÍFICA que é um modelo explicativo. Algumas teorias não podem ser testadas experimentalmente mas, por terem uma boa fundamentação teórica são aceitas pela sociedade. Foi assim que nossos cientistas criaram diferentes modelos e teorias para poder explicar a natureza da matéria.
No século IV a.C., Aristóteles, filósofo grego, modificou a doutrina proposta e melhorada por filósofos gregos e considerou que a água, o fogo, a terra e o ar, representados por diferentes formas geométricas, seriam elementos fundamentais e poderiam se transformar uns nos outros pela mudança de suas propriedades e que se combinados originariam novos materiais.
No século V a.C. , o filósofo grego Demócrito e seu discípulo Leucipo propuseram que a matéria não poderia ser dividida infinitamente, sendo que qualquer material seria dividido até o seu limite máximo e a partir daí se tornariam indivisíveis e seriam chamados de átomos (a = prefixo de negação, tomo = divisão). Essa teoria ficou conhecida como atomismo.
Porém, apesar de todas as evidências, e estudos realizados também, por outros cientistas, essa teoria não foi aceita pela comunidade científica na época, pelo menos até a primeira metade do século XIX. Os primórdios trazem concepções divergentes, Aristóteles atacou o atomismo de Leucipo, Demócrito com a proposição que a matéria era constituída dos elementos fundamentais, a água, a terra, o fogo e o ar. É a filosofia cristã que vai dar à divindade o poder da Criação e o pensamento aristotélico graça aos dogmas da igreja católica e ao cristianismo prevaleceu até o século XVII,
Com o Renascimento, o trabalho de Pierre Gassendi destacou-se em uma tentativa de recuperar as ideias de Demócrito.
Giordano Bruno foi um atomista e seus pensamentos conflitantes com da igreja católica o levou à condenação máxima. Com a adoção de rigoroso método experimental por Robert Boyle a teoria corpuscular foi ganhando força.
No início do século XIX Dalton propôs o seu modelo atômico trazendo a tona o atomismo e as várias discussões em torno das proposições. Mas, no século XIX, alguns cientistas passaram a realizar testes experimentais cada vez mais precisos graças aos avanços tecnológicos (descoberta da balança). Com isso, não só se descobriu que tudo era realmente formado por minúsculas partículas, mas também foi possível entender cada vez mais sobre a estrutura atômica.
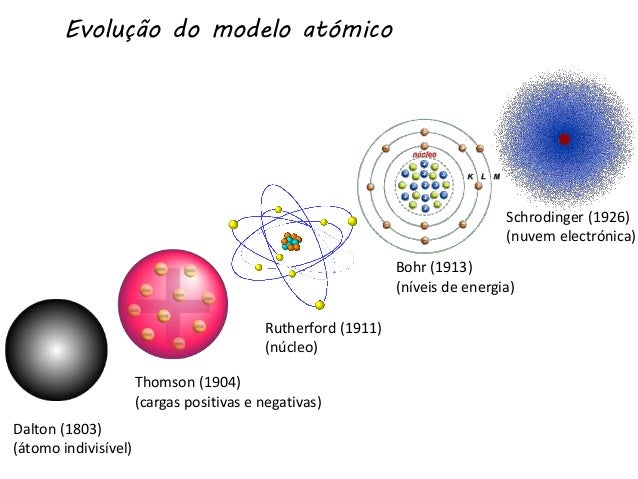
Os cientistas usaram as informações descobertas por outros estudiosos para desenvolver o modelo atômico. Dessa forma, as descobertas de um cientista eram substituídas pelas de outros. Os conceitos que estavam corretos permaneciam, mas os que comprovadamente não eram reais passavam a ser abandonados. Assim, novos modelos atômicos foram criados. Essa série de descobertas da estrutura atômica até se chegar aos modelos aceitos hoje ficou conhecida como a evolução do modelo atômico.
Modelo atômico de Dalton
“ A matéria é formada por átomos, que são partículas minúsculas, maciças, esféricas e indivisíveis.”
Em 1803, um cientista inglês chamado John Dalton publicou um livro contendo sua teoria sobre a constituição da matéria que se baseava em:
– A matéria é constituída de átomos, que são partículas indivisíveis e indestrutíveis;
– Todos os átomos de um elemento químico são idênticos em massa e propriedades;
– As substâncias são formadas pela combinação de diferentes átomos;
– As reações envolvem somente combinação, separação e rearranjo dos átomos, não havendo em seu curso nem a criação nem a destruição de átomos.
Resumindo, Dalton propôs que o átomo seria indestrutível e também seria como uma bola maciça, como uma bola de bilhar, não sendo dotada de cargas elétricas.Esse modelo fazia uma analogia à estrutura de uma bola de bilhar. Todos os átomos seriam assim, diferenciando-se somente pela massa, tamanho e propriedades para formar elementos químicos diferentes.

O modelo atômico de Dalton baseava na estrutura de uma bola de bilhar
Modelo atômico de Thomson
Com os experimentos de Faraday e outros, gerou-se a necessidade de um novo modelo e, Thompson o propôs com a existência do elétron.
Em 1898, o físico inglês John Thomson, realizou experimentos com a ampola de Crookes e conclui que os raios catódicos são constituídos de cargas elétricas negativas, transportadas por partículas de matéria. Thomson descobriu que existiam partículas negativas que compunham a matéria. Isso significava que o modelo de Dalton estava errado porque o átomo seria divisível, tendo em vista que ele teria partículas ainda menores negativas chamadas de elétrons. Assim propôs que os elétrons seriam uma parte constituinte dos átomos e que o átomo seria uma esfera carregada positivamente, na qual estariam incrustados os elétrons com carga negativa.
Esse modelo ficou conhecido como pudim de passas, onde o pudim seria a carga positiva do átomo e as passas seriam os elétrons incrustados nele.
Visto que o átomo é neutro, cargas positivas também deveriam existir. Assim, J. J. Thomson propôs o seguinte em 1898:
“ O átomo é constituído de uma partícula esférica de carga positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total é nula.”

O modelo atômico de Thomson parecia com um pudim ou bolo de passas
Em 1891, o físico irlandês George Johnstone Stoney propôs para a unidade natural de eletricidade o nome de elétron e o cientista inglês William Crookes foi quem identificou essa partícula através de uma invenção de ampola de raios catódicos que continha em seu interior gás ou ar em baixa pressão que submetido a uma corrente elétrica produzia raios luminosos que saiam de uma extremidade da ampola identificada como pólo negativo e caminhavam até a outra extremidade que era o pólo positivo, caracterizando um fluxo de moléculas.
A palavra eletricidade deriva do grego “elektron”, que significa “âmbar”.
HISTÓRIA DA ELETRICIDADE
THALES DE MILETO

A eletricidade surgiu através de um filósofo chamado Thales de Mileto. Ele descobriu que esfregando uma haste de âmbar com um pano, atraía pequenos objetos como cabelo, penas, etc. Do âmbar (gr. élektron) surgiu o nome eletricidade. Dizem que a haste foi eletrificada.
Thales de Mileto ou Tales of Miletus (600 a.C) foi o pioneiro da história da eletricidade.
Thales descobriu o princípio da eletricidade estática, porém não deram tanta importância a sua descoberta. Mas foi a partir do âmbar que surgiu o nome eletricidade.
No entanto ninguém seguiu as idéias de Thales até um bom tempo depois.
Em 1600, o médico e físico willian gilbert continuou com a evolução e história da eletricidade. Foi o primeiro a utilizar os termos energia elétrica e força elétrica , considerado por alguns como pai do magnetismo.
Ele continuou os estudos de tales de Mileto e pode ver que além do âmbar, existem muitas outras substancias que podiam atrair objetos.
Ele explicou que a tração do âmbar e a de outras substâncias por pequenos objetos pode ser explicada devido à eletrização que os materiais sofrem ao serem atritados é denominou a atração de eletricidade.
Esse físico deu uma grande contribuição e um “boom” ao estudo do magnetismo.
STEPHEN GRAY

Já o cientista inglês Stephen Gray, descobriu a eletrização por indução e em 1730 viu que era possível fazer a transferência da eletricidade através de um grupo de materiais.
Ele também explicou as prioridades dos condutores e isolantes.
Três anos depois, em 1733, Charles Dufay viu que além do efeito de atração feito nos objetos, também teria o efeito de repulsão para alguns casos.
Ele percebeu que não existia só a carga positiva como tinha sido dito por Willian. Mas que haviam dois tipos de cargas elétricas: a vítrea e a resinosa, ou seja, cargas carregadas positivamente e negativamente.
Isso foi explicado através das diferentes eletrizações que os objetos adquiriam, ou seja, quando possuíam eletrizações iguais, se repeliam, e quando as eletrizações eram diferentes, se atraíam.
BENJAMIN FRANKLIN

Um pouco mais a frente surge na continuação da história da eletricidade,Benjamin Franklin. Em 1748, Franklin conseguiu o seu primeiro importante resultado científico analisando uma garrafa que acumulava eletricidade, concebida pelo professor holandês da Universidade de Leyden, Pieter van Musschenbroek (1692-1761).
A garrafa de Leyden, como é conhecida, é um tipo primitivo de condensador ou capacitor, com o qual Franklin descobriu os dois “estados da eletricidade”, que depois batizou de cargas positiva e negativa, termos utilizados até hoje.
Descoberta do para-raios
Tempo depois, ele passou a estudar a capacidade dos corpos para atrair ou repelir eletricidade e resolveu fazer uma experiência inédita, em Marly, na França.
Colocou uma longa haste pontiaguda ao longo de um edifício, certo de que a haste poderia atrair o “fogo elétrico” das nuvens e conduzi-lo diretamente para a terra.
Para provar sua teoria, Franklin mandou um de seus empregados segurar uma barra de cera pela qual passava um fio de arame que ligava a haste ao chão.
O raio veio, passou pela haste e pelo fio, e o homem não se machucou. Protegido pela barra de cera e por um estrado limpo e seco que funcionaram como isolantes.
Era a descoberta do primeiro para-raios. Ainda em 1752, Franklin realizou a experiência que o tornou famoso em todo o mundo.
Visando provar a eletrificação das nuvens, ele empinou uma pipa durante uma tempestade. Comprovando que os raios são descargas elétricas que podem ser captadas e conduzidas através de fios.
Entretanto, a invenção que mais lhe trouxe créditos foi a pilha elétrica, em 1800. Ele causou uma enorme agitação no mundo científico quando empilhou discos alternados de zinco e cobre, separando-os por pedaços de tecidos embebidos em solução de ácido sulfúrico.
Esse aparelho que produzia corrente elétrica, sempre que um fio condutor era ligado aos discos de zinco e de cobre das extremidades, passou a ser chamado de pilha de Volta.
A partir daí, todos os aparelhos que produziam eletricidade por meio de processos químicos passaram a ser denominados pelos seguintes nomes:
Celas voltaicas (em homenagem a Volta), pilhas galvânicas (em homenagem a Luigi Galvani (1737-1827)) ou, simplesmente, pilhas.
JAMES WATT

James Watt (1736-1819) nasceu na Escócia. Embora ele não conduzisse experimentos elétricos, ele não deve ser negligenciado.
Ele era um fabricante de instrumentos por comércio e criou uma loja de reparo em Glasgow em 1757. Watt pensou que a máquina a vapor substituiria a energia animal, onde o número de cavalos substituídos parecia uma maneira óbvia de medir a carga pelo desempenho.
Humphrey Davy desenvolveu o arco elétrico e fez uso das células voltaicas na decomposição de compostos. Foi um grande trabalho em eletroquímica que aperfeiçoou a invenção de Volta.
Em 1816 ele criou a chamada lâmpada de Davy, uma invenção fundamental para proteção dos operários das explosões provocadas pelo metano em mistura com o ar atmosférico.
Thomas Seebeck (1770-1831), um físico alemão foi o descobridor do “efeito Seebeck”.
Ele torceu dois fios feitos de metais diferentes e aqueceu uma junção onde os dois fios se encontraram. Ele produziu uma pequena corrente. A corrente é o resultado de um fluxo de calor da junção quente para a fria. Isso é chamado de termoelectricidade. Thermo é uma palavra grega que significa calor.
JOHN FREDERICK DANIELL
John Frederick Daniell desenvolveu a pilha galvânica de cobre e zinco que levou seu nome (1836) e que, superando as construídas anteriormente por Volta e Sturgeon, constituiu a primeira fonte confiável de corrente elétrica de que se dispôs para aprofundar-se no estudo dos fenômenos inerentes à eletricidade.
A pilha de Daniell (1836), foi construída com dois eletrodos um de cobre e um de zinco, mas cada eletrodo ficava em uma cela individual, o que aumentava a eficiência da pilha, pois ela possuía um tubo que ligava as duas cubas, este tipo foi chamado de ponte salina.
Com os dois eletrodos imersos em semi-células contendo soluções com seus respectivos íons, o Cu++ e o Zn++, uma ponte salina ficava conectada às duas semi-células por um fio metálico.
O seu funcionamento é semelhante a de Alessandro Volta (1745-1827), pois possuem os mesmos eletrodos: cobre e zinco. As diferenças são que na pilha de Daniell os eletrodos estão em compartimentos separados, e a utilização da ponte salina, que é responsável pelo fechamento do circuito elétrico.
Nessa pilha ocorre a semi-reação de oxidação no eletrodo de zinco, havendo um fluxo de elétrons através do fio metálico até o eletrodo de cobre, local onde ocorre a semi-reação de redução.
Para manter a neutralidade elétrica, íons migram através da ponte salina, que é uma solução eletrolítica que não participa diretamente das reações nos eletrodos.
MICHAEL FARADAY

Michael Faraday, muito conhecido por estudar e contribuir em grande parte da eletroquímica. Também responsável pela criação dos termos cátion, ânion, eletrodo, eletrolítico.
Em 1831 descobre que a variação na intensidade da corrente elétrica que percorre um circuito fechado induz uma corrente em uma bobina próxima.
Uma corrente induzida também é observada ao se introduzir um ímã nessa bobina. Essa indução magnética teve uma imediata aplicação na geração de correntes elétricas.
Uma bobina próxima a um imã que gira é um exemplo de um gerador de corrente elétrica alternada.
Suas ideias sobre os campos elétricos e os magnéticos, e a natureza dos campos em geral, inspiraram trabalhos posteriores fundamentais nessa área, como as equações de Maxwell. Seus estudos sobre campos eletromagnéticos são conceitos-chave da física atual.
Fez uma das descobertas mais significativas na história da eletricidade: indução eletromagnética. Seu trabalho pioneiro tratou de como as correntes elétricas funcionam.
Muitas invenções viriam de seus experimentos, mas eles viriam cinquenta para cem anos depois.
As falhas nunca desencorajaram Faraday. Ele dizia; “As falhas são tão importantes quanto os sucessos”. Ele sentiu que as falhas também ensinam. O farad, a unidade de capacitância é nomeada em homenagem a Michael Faraday.
Para ocorrer a distribuição de energia, foram criados inicialmente condutores de ferro, depois os de cobre e finalmente, em 1850, já se fabricavam os fios cobertos por uma camada isolante de guta-percha vulcanizada, ou uma camada de pano.
Em 1875 foi instalado um gerador para ligar lâmpadas de arco da estação em Gare du Nord, em Paris. Foram feitas maquinas a vapor para movimentar os geradores, e estimulando a invenção de turbinas a vapor e turbinas para utilização de energia hidrelétrica.
THOMAS ALVA EDISON

Thomas Alva Edison é um dos nomes mais conhecidos na história da eletricidade, foi um dos inventores mais conhecidos de todos os tempos com 1093 patentes.
Auto-educado, Edison estava interessado em química e eletrônica. Em 1879, conseguiu criar uma lâmpada incandescente comercializável com um filamento de haste de carvão.
Apesar de relativamente pouco utilizadas no Brasil, as estradas de ferros eletromagnéticas surgem como alternativa eficaz e limpa para a mobilidade urbana. Também para o trânsito entre cidades, estados e países em várias partes do mundo.
Em 13 de maio de 1880, Thomas Edison fazia o primeiro teste de sua estrada de ferro elétrica em Menlo Park, nos Estados Unidos.
NIKOLA TESLA

Nikola nasceu de pais sérvios 10 de julho de 1856 e morreu um homem quebrou e solitário na cidade de Nova York em 7 de janeiro de 1943.
Ele imaginava um mundo sem postes e linhas de poder. Referido como o maior gênio inventivo de todos os tempos.
O sistema de Tesla triunfou para possibilitar o primeiro grande aproveitamento de Niagara Falls com a primeira usina hidrelétrica nos Estados Unidos em 1886. Um dos maiores gênios da eletricidade, contribui muito para o avanço da história da eletricidade.
HEINRICH HERTZ

Heinrich Hertz (1857-1894), um físico alemão, colocou o trabalho no chão para o tubo de vácuo. Ele estabeleceu as bases para o desenvolvimento futuro de rádio, telefone, telégrafo e até televisão. Ele foi uma das primeiras pessoas a demonstrar a existência de ondas elétricas. Hertz estava convencido de que havia ondas eletromagnéticas no espaço.
Hertz, em suas experiências realizadas a partir de 1885, estuda as propriedades das onde eletromagnéticas geradas por uma bobina de indução; nessas experiências observa que se refletidas, refratadas e polarizada, do mesmo modo que a luz.
Com o trabalho de Hertz fica demostrado que as ondas de radio e as de luz são ambas ondas eletromagnéticas, desse modo confirmando as teorias de Maxwell; as ondas de radio e as ondas luminosas diferem apenas na sua freqüência.
JAMES MAXWELL

James Maxwell (1831-1879), um matemático escocês traduziu as teorias de Faraday em expressões matemáticas. Maxwell foi um dos melhores matemáticos da história. Um maxwell é a unidade eletromagnética do fluxo magnético, nomeado em sua homenagem.
Maxwell demonstrou que os campos elétricos e magnéticos se propagam com a velocidade da luz. Ele apresentou uma teoria detalhada da luz como um efeito electromagnético. A luz corresponde à propagação de ondas eléctricas e magnéticas, hipótese que tinha sido posta por Faraday.
Foi demonstrado em 1864 que as forças elétricas e magnéticas têm a mesma natureza: uma força elétrica em determinado referencial pode tornar-se magnética se analisada noutro, e vice-versa.
Outubro de 1893 George Westinghouse (1846-1914) recebeu o contrato para construir os primeiros geradores nas Cataratas do Niágara.
Ele usou seu dinheiro para comprar patentes no campo elétrico. Uma das invenções que ele comprou foi o transformador de William Stanley.
Westinghouse inventou o sistema de freio a ar para parar trens, o primeiro de mais de cem patentes que ele receberia nesta área sozinho. Ele logo fundou a Westinghouse Air Brake Company em 1869.
WILLIAM THOMSON
William Thomson, foi mais conhecido em sua invenção de uma nova escala de temperatura com base no conceito de um zero absoluto de temperatura a -273 ° C (-460 ° F).
Ao final de sua vida, Thomson manteve uma forte oposição à ideia de que a energia emitida pela radioatividade veio do interior do átomo. Uma das maiores descobertas científicas do século 19.
Thomson morreu, opondo-se a uma das inovações mais importantes da história da ciência.
Alexander Graham Bell (1847-1922) nascido na Escócia, foi criado em uma família interessada e envolvida na ciência do som. O pai e o avô de Bell ensinaram a falar aos surdos.
Uma unidade de nível de som é chamada de bel em sua homenagem. Os níveis de som são medidos em décimos de um bel, ou decibéis. A abreviatura para decibel é dB.
Otto Hahn (1879-1968), químico e físico alemão, fez a descoberta vital que levou ao primeiro reator nuclear.
Ele descobriu o processo de fissão nuclear através do qual núcleos de átomos de elementos pesados podem entrar em núcleos menores, no processo liberando grandes quantidades de energia. Hahn foi premiado com o Prêmio Nobel de Química em 1944.
ALBERT EINSTEIN

Albert Einstein (1879-1955) é um dos últimos a contribuir nessa história da eletricidade. A fórmula de Einstein provou que um grama de massa pode ser convertida em uma quantidade torrencial de energia.
Para fazer isso, a atividade dos átomos deve ocorrer no núcleo. E = energia, M = massa e C = velocidade da luz que é 186,000 milhas por segundo.
Quando você acerta 186.000, você pode ver que só levaria uma pequena quantidade de massa para produzir uma enorme quantidade de energia.
Hoje ele é amplamente considerado como secundário apenas para Isaac Newton e Albert Einstein no mundo da ciência
Nos dias atuais a eletricidade está cada vez mais avançada e avançando cada dia mais. A maior parte feita foi graças a esses nomes mencionados na história da eletricidade.
É incrível ver tudo que podemos fazer com a energia elétrica e o que ela nos proporciona a cada dia. É por isso que somos apaixonados por Eletricidade.
Modelo atômico de Rutherford – Geiger
No final do século XIX, o físico neozelandês Ernest Rutherford estudando a radioatividade descobriu que existem dois tipos de radiações distintos, uma que é rapidamente Absorvida, conhecida como radiação alfa e outra com maior poder de penetração, conhecida como beta. Em 1911, realizou um experimento em que ele bombardeou uma finíssima lâmina de ouro com partículas alfa (α) emitidas por uma amostra de polônio (material radioativo) que ficava dentro de um bloco de chumbo com um pequeno orifício pelo qual as partículas passavam.
Por meio dos resultados desse experimento, Rutherford percebeu que, na verdade, o átomo não seria maciço como propôs os modelos de Dalton e Thomson.
Uma vez estabelecido em Manchester, Rutherford encontrou como assistente o jovem alemão Hans Geiger (1882-1945), famoso por ter criado o Contador Geiger, instrumento utilizado para detectar radioatividade. Ambos publicaram vários trabalhos associados aos estudos das partículas alfa. Rutherford e Geiger publicaram em 1908 dois importantes artigos na Proceedingsof the Royal Society of London. O primeiro deles, intitulado “Um Método Elétrico de Contagem de Partículas α de Substâncias Radioativas” (An Electrical Method of Counting the Number of α – Particles from Radio-active Substances), Rutherford e Geiger relatam dois métodos criados por eles de contagem de partículas alfa emitidas por substâncias radioativas: o método elétrico e o método de cintilações. Geiger estudou um método elétrico de contagem de uma única partícula alfa. A grande dúvida em relação a isso era o fato dos diferentes valores encontrados da carga unitária. Isso fica evidente com a justificativa dada pelos autores no artigo: Houve a necessidade de um método de contar as partículas de alfa diretamente sem qualquer suposição da carga carregada por cada uma […]. Se o número de partículas alfa expelida de uma quantidade definida de material radioativo pudesse ser determinado por um método direto, a carga carregada por cada partícula poderia ser conhecida imediatamente medindo a carga positiva total carregada pelas partículas alfa. E deste modo, deveria ser possível lançar alguma luz na pergunta se a partícula alfa carrega uma carga e ou 2e, e assim resolver o problema mais urgente emradioatividade, […] se a partícula alfa é um átomo de hélio. (RUTHERFORD e GEIGER, 1908, p. 141. Tradução nossa). Geiger utilizou um método conhecido como ionização por colisão. Era um método desenvolvido por J. A. Thownsend que consistia na formação de íons a partir de um potencial elétrico muito grande.
Ele propôs um novo modelo atômico foi idealizado com um átomo divisível, onde teria duas regiões: uma central chamada núcleo constituído pela parte positiva, os prótons e por partículas sem carga, e uma região ao redor da central denominada eletrosfera uma grande região vazia constituída pelas cargas negativas chamadas elétrons que ficam girando ao redor do núcleo. Ele imaginou o seu modelo semelhante a um sistema solar, em que os elétrons girariam ao redor do núcleo, em órbitas como as planetárias.

O modelo atômico de Rutherford fazia uma analogia ao sistema solar
Em 1932, o cientista Chadwick descobriu a terceira partícula subatômica, o nêutron. Dessa forma, o modelo de Rutherford passou a ter os nêutrons no núcleo junto aos prótons, ficando assim:
.jpg)
Modelo atômico de Rutherford incluindo os nêutrons no núcleo
Modelo atômico de Rutherford-Bohr
Esse modelo recebeu esse nome porque, em 1913, o cientista Niels Bohr (1885-1962) propôs um modelo que se baseou no de Rutherford, apenas o aprimorando. Entre seus principais postulados, propôs um novo modelo atômico após o estudo do espectro do átomo de hidrogênio. Aperfeiçoou o modelo atômico de Rutherford onde os elétrons se organizam na eletrosfera na forma de camadas ao redor do núcleo em órbitas circulares, designadas pelas letras maiúsculas K, L, M, N, O, P e Q representando os 7 níveis de energia da eletrosfera. Cada órbita seria um nível de energia que teria uma determinada quantidade de elétrons, o mais próximo do núcleo, menor sua energia e quanto mais afastado do núcleo maior sua energia. Um átomo tem seus elétrons nos níveis de energia mais baixos, mais próximos do núcleo. Se esse átomo, receber energia, sendo por exemplo aquecido, um elétron pode absorvê-la e mudar para um nivel de energia maior. Quando retornar para o nível de energia menor, esse elétron liberará a mesma quantidade de energia antes absorvida e poderá ser, por exemplo, na forma de luz.
“Os elétrons movem-se em órbitas circulares, e cada órbita apresenta uma energia bem definida e constante (nível de energia) para cada elétron de um átomo.”
Essas camadas eletrônicas ou níveis de energia passaram a ser representadas pelas letras K, L, M, N, O, P e Q, respectivamente, no sentido da camada mais próxima ao núcleo para a mais externa.
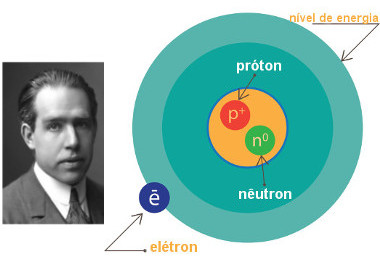
Representação do modelo atômico de Rutherford-Bohr
Veja na figura a seguir que, segundo esse modelo, as órbitas vão progressivamente sendo preenchidas pelos elétrons. Os átomos mostrados a seguir são dos primeiros oito elementos da Tabela Periódica:
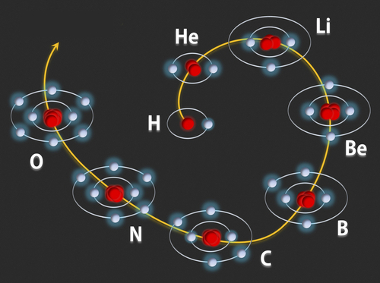
Forma como os níveis energéticos são progressivamente preenchidos por elétrons nos primeiros oito átomos da Tabela Periódica dos elementos
Atualmente, o modelo mais moderno para o átomo é o MODELO QUÂNTICO, que indica que os elétrons não giram em órbitas. Os estudos quânticos demonstram que só é possível a presença de um determinado número de elétrons em cada nivel energético. A maneira como estão distribuídos é conhecida como distribuição eletrônica. Os elétrons da ultima camada são responsáveis pelo comportamento químico do elemento e consequentemente chamados de elétrons de valência.
HISTÓRIA DA RADIOATIVIDADE
Tudo começou com a descoberta dos Raios-X por Wilhelm Conrad Roentgen em 1895. Um ano depois, em 1986, Becquerel constatou que o Urânio emitia radiações análogas aos dos Raios-X de forma espontânea. Essa radiação mais tarde seria chamada por “radioatividade” por Marie Curie.
W.C. Roentgen descobriu acidentalmente os raios X em novembro de 1895 quando fazia experiências em seu laboratório na cidade alemã de Wuzburg. Verificou a presença de um novo tipo de raios cuja origem não sabia explicar e por isso, foram chamados de raios “X”.
Roentgen ficou fascinado e entusiasmado com sua descoberta e em menos de um mês, registrou em filme inúmeras vezes a imagem da mão de sua mulher Bertha. Esta seria a primeira radiografia de um ser humano. O equipamento utilizado foi desenvolvido por ele próprio e pode ser visto na figura abaixo.


Primeiro equipamento utilizado em experiências com os raios X
O Brasil foi um dos primeiros países a utilizar os raios X e já no ano seguinte, foi publicado o estudo científico “Dos raios X no ponto de vista médico-cirurgico” na Faculdade de Medicina do Rio de Janeiro. Em 1897 chegou ao Brasil o primeiro aparelho de raios X. Vários trabalhos foram publicados pelo médico José Carlos Ferreira Pires, pioneiro do uso dos raios X no Brasil. Naquela época, uma radiografia de tórax demorava cerca de 30 minutos e uma de crânio 45 minutos.
1.2 DESCOBERTA DA RADIOATIVIDADE
O esquecimento de uma rocha de urânio sobre um filme fotográfico virgem, levou à descoberta de um fenômeno interessante: o filme foi queimado por alguma “coisa”, na época chamada de raios ou radiações.
Essa descoberta foi chamada posteriormente de radioatividade e os elementos que apresentam essa propriedade foram chamados de elementos radioativos. A palavra radioatividade vem do latim: radius (= “raio”) e é a desintegração espontânea do núcleo atômico de alguns elementos, resultando em emissão de radiação.
A radiação é emitida por muitos outros elementos, além do urânio, – rádio, potássio, tório, carbono e iodo são apenas alguns desses elementos – chamados radioativos. Toda a radiação pode ser prejudicial aos seres vivos (humanos e animais) porque danifica as células vivas. Quanto maior for o nível de radiação recebido, maior será o dano. As pessoas têm usado essa capacidade destrutiva da radiação para tratar de algumas doenças, como por exemplo, o câncer. No tratamento, uma determinada dose de radiação é aplicada ao paciente para matar as células cancerígenas.
As pesquisas sobre a radioatividade foram iniciadas com a descoberta dos raios X em 1895. Poucos meses depois, o físico francês Antoine Henri Becquerel (1852-1908), professor de física do Museu de História Natural da França, descobriu que um determinado material, o urânio, emitia radiações espontaneamente.

Os dez anos posteriores à descoberta de Becquerel foram de grandes avanços. Em 1897, o britânico Joseph John Thomson descobriu o elétron. Dois anos depois, em 1898, o casal Pierre e a sua mulher, a polonesa Marie Curie, estudando os componentes do minério de urânio encontram fontes radiativas muito mais fortes que o próprio elemento. Desse modo, descobriram novos elementos químicos ao qual chamaram rádio (Ra) – verificaram que o rádio podia provocar ferimentos sérios e até fatais nos seres humanos que dele se aproximavam – demonstraram que o tório (Th) também apresentava o fenômeno da radioatividade. O polônio foi assim batizado em homenagem à Marie Curie, por ser polonesa.
1.3 Evolução temporal das principais descobertas:
•1895 – Descoberta dos raios X (W.C. Roentgen) •1895 – Primeiro registro radiográfico.
•1896 – Descoberta da radioatividade (H. Becquerel)
•1896 – Primeiro trabalho brasileiro sobre radiação.
•1897 – Primeiro equipamento de raios X chega ao Brasil.
•1898 – Descoberta do rádio e do polônio (Pierre e Marie Curie)
•1898 – Descoberta das partículas α e β (Rutherford) •1898 – Descoberta dos raios γ (Paul Villard)
•1901 – Primeiro prêmio Nobel de Física (E. Roentgen)
•1902 – Suspeita da indução de doenças de pele. Primeiro limite: eritema.
•1912 – Descoberta dos raios cósmicos (Hess)
•1928 – Suspeita de indução de efeitos genéticos. •1934 – Primeiro limite formal às radiações.
•1945 – Primeira bomba atômica (Hiroshima)
•1971 – Primeiro equipamento de tomografia computadorizada
1.4 OUTRAS APLICAÇÕES DAS RADIAÇÕES IONIZANTES a)Esterilização de instrumentos médicos
Instrumentos médicos podem ser esterilizados de três maneiras: a primeira consiste em colocar os instrumentos em uma autoclave e utilizar vapores, a segunda consiste em utilizar produtos químicos líquidos onde são imersos os instrumentos e a terceira seria utilizando fontes radioativas.
No caso das fontes radioativas, os irradiadores mais utilizados são os irradiadores gama que utilizam fontes de cobalto ou césio de alta energia. Este método e bastante difundido e amplamente utilizado.
b)Sanitização de esgotos
O uso de fontes radioativas e de grande utilidade nas estações de tratamento de esgotos pois se sabe que a radiação ionizante mata bactérias e micoorganismos, sendo portanto de grande aplicação nessa área.
c)Arqueologia, paleontologia e conservação de obras de arte
As radiações ionizantes também podem ser utilizadas no estudo de múmias uma vez que se torna possível observá-las ser ter que abrir seu envoltório.

No que se refere à conservação de objetos antigos tais como livros e obras de artes, o uso das radiações ionizantes tem grande aplicação pois seu emprego destrói fungos e bactérias conforme pode ser visto na figura abaixo.

d) Aplicações agronômicas
Mediante o emprego da técnica de auto-radiografia pode-se estudar o modo como se distribuem os fertilizantes nas plantas. O método consiste em empregar fertilizantes que possuem na sua composição radionuclídeos que emitem radiação (por exemplo, o fósforo 32 que emite radiação β) e analisar a imagem obtida.
e)Recursos hídricos
O movimento das correntes marítimas, das marés assim como o movimento de correntes em rios pode ser rastreado agregando-se radionuclídeos as águas e monitorando sua dispersão e/ou velocidade através da detecção da radiação em diferentes pontos que se deseja avaliar.
f)Produção de energia elétrica
A produção de energia elétrica a partir do combustível nuclear em uma usina nuclear é uma importante aplicação das radiações ionizantes. No Brasil, existem duas usinas nucleares em funcionamento na região de Angra dos Reis que são responsáveis pelo fornecimento de aproximadamente 8% da energia gerada no País. Uma terceira unidade esta em discussão para ser implantada na mesma região.
g) Indústria
A principal aplicação industrial das radiações ionizantes se dá através de uma técnica chamada gamagrafia. Essa técnica consiste em irradiar peças metálicas com fontes de radiação γ, pois esse tipo de radiação tem alto poder de penetração. A gamagrafia apresenta vantagens sobre o uso de raios X, pois as fontes são portáteis e não precisam de energia elétrica para seu funcionamento. Sua principal aplicação esta na detecção de imperfeições em peças, principalmente em soldas. Em hidrologia pode-se controlar o nível de um líquido em um tanque empregando- se radiação γ. Coloca-se a fonte numa determinada altura e um detector do lado oposto. Quando o líquido ultrapassa essa determinada altura, haverá uma diminuição na detecção por conta da absorção da radiação pelo líquido. Sendo assim e possível monitorar a capacidade de um reservatório, por exemplo.

h)Portos, aeroportos e fronteiras
Atualmente tem sido de grande utilidade o uso de radiações ionizantes no controle de portos aeroportos e fronteiras. Seu uso permite avaliar o conteúdo de cargas assim como verificar se clandestinos estão escondidos misturados às cargas. O método também permite checar se uma pessoa esta ou não portando armas. Nas figuras abaixo são apresentados alguns exemplos desse uso.


i)Conservação de alimentos
A irradiação de alimentos é realizada principalmente com o emprego de cobalto 60. Sua aplicação inibe a germinação e a formação de brotos durante um longo período. Há uma redução da velocidade do processo fisiológico da maturação (frutas) e germinação (cebola, batata, etc..). Os efeitos bactericidas são atingidos pela redução no número de microorganismos responsáveis pela deterioração dos alimentos (peixes, ovos, carnes, etc…). O principal problema com esse método é o descrédito do público, que acredita que os alimentos se tornam radioativos e resistem a ingeri-los. No que se refere aos órgãos governamentais, constata-se também uma demora no processo de autorização para sua comercialização.





Origem das Radiações Ionizantes
Naturais ~ 70% Artificiais ~ 30%
Naturais:
•Radônio e Torônio: rochas, solos, sedimentos e minérios que contém concentrações significativas de urânio e tório. São gasosos. •Radiação Cósmica: proveniente do espaço sideral, freadas pela atmosfera.
Artificiais:
Esta descoberta atraiu a curiosidade de muitos cientistas. Uma delas foi Marie Slodowska Curie. Ela foi uma das mulheres mais extraordinárias do século passado. Foi a primeira mulher a ganhar o prêmio Nobel, em 1903. Oito anos depois ela ganharia seu segundo prêmio Nobel. Assim, ela foi a primeira pessoa a ganhar dois prêmios Nobel na área da ciência.
Suas pesquisas no decorrer da vida giraram em torno da radioatividade, dos elementos químicos Rádio e Polônio foram de grande contribuição para a física nuclear e da terapia à base de radiações. Mas conquistar tudo isso não foi nada fácil.
Apesar de muitos revezes em sua vida familiar, em 1894 ela concluiu duas graduações, tornando-se bacharel em matemática e física. Nesse mesmo ano, ela conheceu o cientista francês Pierre Curie. Ele estava terminando sua tese de doutorado que tratava do efeito do calor sobre propriedades magnéticas. Marie também tinha estudos nesse campo e por coincidências ou não, Marie e Pierre se apaixonaram e se casaram.
Em 1897 Marie começou a estudar aquilo que Becquerel não conseguia decifrar, aquela radiação emitida pelo sal duplo de Urânio. E a pesquisa que Marie Curie era tão fascinante que seu marido, Pierre, percebendo a extensão do trabalho da esposa resolveu largar sua pesquisa e se uniu à dela.

Os dois perceberam que um minério de nome Pechblenda era altamente radioativo, contudo o Urânio extraído desse minério emitia uma radiação bem menor do que a própria Pechblenda. O casal elaborou a hipótese de que havia um novo elemento altamente radioativo na Pechblenda.
Depois do processo de separação eles obtiveram uma quantidade mínima de um material que se comportava como o Bismuto do ponto de vista químico, todavia era fortemente radioativo. A esse elemento chamaram de Polônio, em homenagem à terra natal de Marie.
O casal descobriu que o Polônio era 400 vezes mais radioativo que o Urânio. Mas nem mesmo um nível de radiação tão alto justificava o índice encontrado na Pechblenda, o que os levava a crecer que só poderia haver outro elemento ainda mais radioativo que o Polônio presente nela. Após um longo processo exaustivo de separação, eles conseguiram separar uma outra substância que era 900 vezes mais radioativa que o Urânio. A essa substância deram o nome de Rádio.
O próprio Becquerel havia notado que, ao portar por duas semanas um tubo contendo Rádio em seu bolso, havia sofrido uma severa lesão na pele. Ele reportou esse acontecido para Pierre que, depois de verificado em sua própria pele, enviou certa quantidade desse elemento a alguns médico.
Emil Grubbe
Nessa época os médicos da Europa e Estados Unidos já estavam utilizando amplamente os Raios-X para tratar doenças. Por exemplo, depois de notar descamação das mãos expostas aos Raios-X, um estudante de medicina em Chicago chamado Emil Grubbe convenceu um de seus professores a permitir que ele irradiasse um paciente com câncer, uma mulher chamada Rose Lee, que sofria de câncer de mama localmente avançado.
Ao fazê-lo, Grubbe tornou-se o primeiro radioterapeuta do mundo. Os Raios-X eram úteis principalmente para tratar patologias dermatológicas, reumatismo, leucemia, câncer de estômago, reto e mamas.
Claude Regaud
Em poucos anos, os pacientes em todo os Estados Unidos e Europa foram submetidos à radioterapia. Em primeiro lugar, a radioterapia foi realizada essencialmente em um número limitado de tratamentos. Um professor do Institudo do Radium de Paris, de nome Claude Regaud, reconheceu que o tratamento pode ser melhor tolerado e mais eficaz se a radiação fosse entregue de forma mais lenta, com modestas doses por dia ao longo de várias semanas.
Esta técnica, conhecida como “fracionamento”, é uma das principais estratégias na radioterapia.
Henri Coutard
O oncologista francês Henri Coutard foi um dos pioneiros da radioterapia fracionada em uma ampla variedade de tumores. Digno de nota, ele relatou resultados impressionantes usando esta técnica em pacientes com câncer de laringe localmente avançado. Seus relatórios contendo os resultados ainda é citado atualmente.
Malcolm Bagshaw
Posteriormente, muitos radioterapeutas fizeram notáveis contribuições para o campo da radioterapia. Malcolm Bagshaw, da universidade de Standord, demonstrou o potencial efeito curativo da radiação no câncer de próstata. Hoje, baseado em arte de seu trabalho inovador, a radioterapia é conhecida como um dos pilares do tratamento do câncer de próstata.
Gilbert Fletcher
Gilbert Fletcher do MD Anderson Cancer Center estabeleceu regimes de tratamento ideais para uma ampla variedade de sítios tumorais, incluindo câncer de cabeça e pescoço.
Ao longo de todos esses eventos até a data de hoje, a radioterapia evoluiu muito em todos os aspectos, fato que alavancou o uso desta modalidade e a transformou numa das principais armas na luta contra o câncer. Atualmente ela consiste em administrar uma dose de radiação a um volume definido, chamado volume alvo, tentando poupar ao máximo os tecidos normais ao seu redor, A precisão é essencial para garantir um tratamento de qualidade.
Estrutura do átomo
A estrutura do átomo é dividida basicamente em duas regiões: o núcleo, que é formado pelos prótons e nêutrons, e a eletrosfera, formada por elétrons e um grande vazio.

Ilustração de átomo – corresponde apenas a um modelo, e não à realidade
Falaremos aqui do modelo atômico mais estudado no Ensino Médio e que serve para explicar a maioria dos fenômenos físicos e químicos pelos quais a matéria passa. Segundo esse modelo, a estrutura do átomo apresenta basicamente duas regiões distintas, que são:
* Núcleo: É uma região maciça, compacta e densa que fica no centro do átomo. O núcleo atômico é divisível, pois é constituído de duas partículas diferentes:
– Prótons: são partículas carregadas positivamente com carga relativa igual a +1. Sua massa relativa também é de 1.
O número de prótons existente no núcleo é chamado de número atômico (Z) e é o responsável pela diferenciação de um elemento químico de outro, ou seja, cada elemento químico é formado por um conjunto de átomos que possui o mesmo número atômico ou a mesma quantidade de prótons.
– Nêutrons: como o próprio nome indica, essas são partículas neutras, isto é, não possuem carga elétrica. Assim, os nêutrons diminuem a força de repulsão entre os prótons no núcleo (tendo em vista que cargas de mesmo sinal repelem-se).
Essas partículas subatômicas possuem a massa relativa praticamente igual à dos prótons, isto é, 1. Mas, na realidade, a massa do nêutron é um pouco maior que a do próton. Isso é interessante porque, se fosse o contrário, isto é, se os prótons fossem ligeiramente mais pesados do que os nêutrons, todos os prótons seriam transformados em nêutrons. O resultado seria que, sem os prótons, os átomos não existiriam.
Algumas curiosidades:
- O tamanho do núcleo depende da quantidade de nêutrons e prótons que ele possui. Entretanto, pode ser dito que, em média, o núcleo atômico tem o diâmetro em torno de 10-14 m e 10-15 m.
- O próton e o nêutron são partículas 100 mil vezes menores do que o próprio átomo inteiro!
- A massa do átomo é dada praticamente somente pelo número de prótons e nêutrons existentes no núcleo. Isso ocorre porque cada próton e cada nêutron são 1836 vezes maiores que um elétron. Por essa razão, a massa dos elétrons torna-se insignificante.
* Eletrosfera: É uma região periférica ao redor do núcleo átomo onde os elétrons ficam girando em volta deste núcleo.
– Elétrons: Estes foram as primeiras partículas subatômicas descobertas (no anos de 1897, por J. J. Thomson). São partículas carregadas negativamente, cuja carga relativa é de -1. Sua carga em Coulombs é igual 1,6.10-19 C.
Apesar de os elétrons serem negativos, o átomo no estado fundamental é neutro, pois ele possui a mesma quantidade de elétrons e de prótons. Isso significa que as cargas negativas dos elétrons anulam as cargas positivas dos prótons, assim, o átomo fica neutro.
Quando os átomos realizam ligações químicas para formar as substâncias simples e compostas, isso ocorre com os elétrons. Há então uma transferência ou um compartilhamento de elétrons entre dois ou mais átomos.
As ilustrações da estrutura do átomo são apenas modelos, mas não representam a realidade. Por exemplo, a maior parte do átomo é um grande vazio. Para você ter uma ideia, pense no átomo de hidrogênio formado por um próton e um elétron. Se o núcleo desse átomo fosse do tamanho de uma bola de tênis, o seu elétron orbitante estaria a uma distância de três quilômetros! A eletrosfera é maior que o núcleo do átomo cerca de 10 000 a 100 000 vezes.
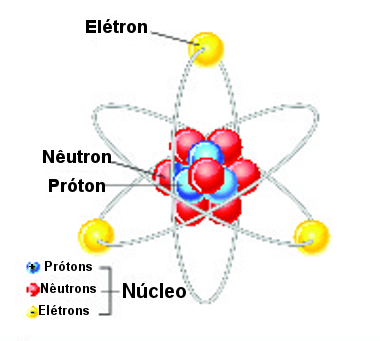
Esquema de estrutura do átomo com as principais partículas subatômicas
Em 1924, Louis de Broglie, partindo dos postulados de Planck e Einstein sobre a dualidade da luz como onda-partícula, disse que o elétron não poderia ser considerado uma partícula, pois possui propriedades de onda.
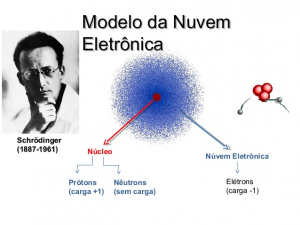
Em 1926, Erwin Schrödinger tentou calcular a posição exata dos elétrons, porém obteve ‘somente’ uma equação, a equação de Schrodinger, responsável por calcular a probabilidade de um elétron estar em uma dada região da eletrosfera. Esta região, ele chamou de orbital. Este modelo foi chamado de modelo de nuvem eletrônica.
A região mais propícia para se encontrar um elétron é chamada de orbital.
Linha do tempo
Leucipo (500 a.C), Demócrito (460 – 370 a.C), Epicuro – (341 – 270 a.C) – constituição atomística da matéria
Empédocles, Platão (427 – 347 a.C), Aristóteles (384 322 a.C) – – teoria dos quatro elementos
Alquimia (V a.C – XVI) – enxofre, mercúrio e sal
William Gilbert – Inglês – (1540 – 1603) – eletricidade – âmbar (elektron)
Giordano Bruno – Italiano – (1548 – 1600) – atomista
Pierri Gassendi – Francês – (1592 – 1655) – atomista
Robert Boyle – Irlandês – (1627 – 1691) – experimentação sistemática
Henry Cavendish – Italiano (1731 – 1810) – composição da água
Joseph Priestley – Inglês – (1733 – 1894) – ar flogisticado – força de atração
Charles Augustin de Coulomb – Francês – (1736 – 1806) – Lei de Coulomb
Antoine- Laurent Lavoisier –Francês – (1743 – 1794) – Combustão/nomenclatura – 1779
John Dalton – Inglês – (1766 – 1844) – Modelo de Dalton – 1805
Michael Faraday – Inglês – (1791 – 1867) – Corrente elétrica – Lei de Indução 1830
Johann Jakob Balmer – Suiço – (1825 – 1898) – Linhas espectrais do hidrogênio – 1848
Dimitri Ivanovich Mendelyeev – Russo – (1834 – 1907) – Tabela Periódica -1871
George Johnstone Stoney – Irlandês (1826 – 1911) – eletricidade unidades descontínuas – elétron – 1874
William Crookes – Inglês (1832 – 1919) – Ampola de Crookes – raios catódicos
Wilhelm Konrad Rontgen – Alemão – (1845 – 1923) – Raios X – 1895
Henri Becquerel – Francês – (1852-1908) – raios invisíveis – 1896
Joseph John Thomson – Inglês – (1856 – 1940) – Modelo de Thomson – 1897, 1907
Charles Thomson Rees Wilson – Escocês – (1869 – 1959) – Câmara de Wilson – 1897
Max Karl Ernst Ludwig Planck – Alemão – (1858 – 1947) – Lei de Planck – radiação do corpo negro – 1900
Pierre Curie (1859 -1906) – Francês e Marie Curie – Polonesa (1867 – 1934) – Pitchbelnda – radio – radioatividade – 1902
Ernest Rutherford – Neozelandês (1871 – 1937) – Modelo planetário – 1911
Frederick Soddy – Inglês – (1877 – 1956) – desintegrações radioativas.
Albert Einstein – Alemão (1879 – 1955) – efeito fotoelétrico – relatividade -1905
Niels Bohr – Dinamarquês – (1885- 1962) – Modelo de Bohr – 1913
Louis De Broglie – Francês – (1892- 1987) – dualidade onda-corpúsculo – 1923
Robert Andrews Millikan – Estadunidense – (1868 – 1953) – carga do elétron – 1923
Paul Adrien Maurice Dirac – Inglês – (1902 – 1984) – teoria do elétron – 1925
Werner Karl Heisenberg – Alemão (1901 – 1976) – Princípio da Incerteza – 1927
Erwin Schrodinger – Austríaco – (1887 – 1961) estudo das ondas estacionárias
Questões para análise do texto
1. Para Dalton, o que era um átomo?
Para Dalton, o átomo era a menor partícula que compunha toda a matéria e era indivisível e indestrutível.
2. Segundo as ideias de Dalton, que característica diferenciava os átomos dos diversos elementos químicos?
Os alunos devem identificar a massa como critério para diferenciar os átomos dos diversos elementos químicos, de
acordo com Dalton.
3. Para Dalton, o que era um elemento químico?
Para ele, os elementos químicos seriam os conjuntos de átomos que possuíssem a mesma massa.
4. Como Dalton representava os átomos? Como eles são representados atualmente?
Os elementos eram representados por símbolos (desenhos circulares). Atualmente, os elementos são representados pela primeira letra em maiúscula de seu nome em latim, e, quando há elementos cujos nomes comecem com a mesma letra, acrescenta-se uma segunda em minúscula; por exemplo, nitrogênio (nitrogen), símbolo N, e sódio (natrum), símbolo Na.Entretanto, é bom ter em conta que o conhecimento de novos fatos químicos, que não podiam ser explicados pelas ideias de Dalton sobre a estrutura da matéria, levaram os cientistas a buscar novas explicações e a propor outros modelos que tivessem maior poder explicativo. Esses modelos serão abordados nas séries seguintes.
Quando Dalton propôs seu modelo atômico, sabia-se que a massa se conservava numa transformação química. A aplicação das ideias de Dalton para explicar a Lei da Conservação de Massa pode ser demonstrada, por exemplo, por meio da combustão do ferro, na qual partículas de ferro e partículas de oxigênio se rearranjam para formar partículas de óxido de ferro; portanto, a soma das massas de reagentes é igual à massa do produto.
1. Como as ideias de Dalton a respeito das transformações químicas explicam:
a) a conservação da massa?
A ideia de Dalton de que os átomos dos reagentes não são destruídos, mas sofrem recombinações para formar os produtos, explica a conservação da massa.
b) a proporção entre as substâncias participantes da reação?
A ideia de Proust, de que há uma proporção determinada entre as massas dos elementos químicos que compõem cada substância, pode ser compreendida com base no modelo de Dalton. Se há uma proporção determinada em massa em uma dada substância, há também uma proporção determinada em relação às partículas que a compõem.
Grade de avaliação da Situação de Aprendizagem 10
Nesta Situação de Aprendizagem esperamos que os alunos tenham entendido a ideia de modelo – construção humana influenciada por seu contexto histórico e social – e que tenham contato com uma das primeiras ideias
sobre átomo – modelo atômico de Dalton –, além de utilizá-la para explicar as relações de massa numa transformação química.
Nas questões para análise do texto (1 a 4), esperamos que eles tenham compreendido, em termos gerais, as ideias de Dalton.
Para retomar com os alunos os assuntos abordados ao longo das últimas quatro Situações de Aprendizagem, pode-se utilizar os exercícios a seguir.
1. A tabela a seguir contém dados relativos à queima de um pedaço de palha de aço.
Experimentos
Massa dos reagentes (g) Massa dos produtos (g) Massa que não reagiu (g) Palha
(ferro) Oxigênio Óxido de ferro Palha ferro) Oxigênio
I 22,4 11,7 32,0 — 2,1
II 22,4 8,6 28,5 2,6 —
III 22,4 9,6 32,1 — —
a) Qual é a massa de oxigênio (O2) que reage nos experimentos I, II e III? Explique.
Experimento I: 11,7 – 2,1 = 9,6 g.
Houve excesso de 2,1 g de oxigênio e 9,6 g reagiram.
Experimento II: 8,6 g.
Todo o oxigênio adicionado reagiu.
Experimento III: 9,6 g.
Todo o oxigênio adicionado reagiu.
b) Verifique se houve conservação de massa em cada um dos experimentos. Mostre os cálculos e conclusões.
Experimento I:
Experimento II:
Experimento III:
2. Analise as seguintes afirmações.
I. Toda vez que ocorrer uma transformação química em sistema fechado e se formar um sólido, a massa final do sistema será maior que sua massa inicial.
II. Na combustão da madeira, a massa inicial do sistema formado por madeira e gás oxigênio é igual à massa final
do sistema formado por gás carbônico, vapor d’água e cinzas.
III. Quando uma transformação química processada em sistema fechado produzgás, as massas inicial e final do sistema serão iguais, pois os gases não têm massa.
Está(ão) correta(s) a(s) afirmativa(s):
a) I
b) II
mi = 22,4 + 8,6 = 31,0 g
mf = 28,5 + 2,6 = 31,1 g
Considerando a incerteza das medidas experimentais, pode-se dizer que a massa se conservou.
mi = 22,4 + 9,6 = 32,0 g
mf = 32,1 g
Considerando a incerteza das medidas experimentais,
pode-se dizer que a massa se conservou.
massa inicial = 22,4 + 11,7 = 34,1 g mi = mf massa final = 32,0 + 2,1 = 34,1 g
A massa se conservou.
c) III
d) I e II
e) II e III
As afirmações I e III estão erradas, pois nas transformações químicas que ocorrem em sistema fechado não ocorrem variações de massa. Além disso, em III afirma-se, erradamente, que gases não têm massa.
3. (Fuvest – 1997) Os pratos A e B de uma balança foram equilibrados com um pedaço de papel em cada prato e efetuou-se a combustão apenas do material contido no prato A. Esse procedimento foi repetido com palha de aço em lugar de papel. Após cada combustão, observou-se: Com papel Com palha de aço
a) A e B no mesmo nível
A e B no mesmo nível
b) A abaixo de B A abaixo de B
c) A acima de B A acima de B
d) A acima de B A abaixo de B
e) A abaixo de B A e B no mesmo nível
Antoine Laurent Lavoisier (1743-1794),o iniciador da Química moderna, realizou, por volta de 1775, vários experimentos. Em um deles, aqueceu 100 g de mercúrio em presença de ar dentro de um recipiente de vidro fechado, obtendo 54 g de óxido vermelho de mercúrio, tendo ficado ainda sem reagir 50 g de mercúrio. Pergunta-se:
a) Qual a razão entre a massa de oxigênio e a de mercúrio que reagiram?
Como foram adicionados 100 g de mercúrio e restaram 50 g sem reagir, sabe-se que a massa de mercúrio que reagiu foi de
50 g. Como a massa de óxido de mercúrio produzido foi de 54 g, sabe-se que a massa de oxigênio que reagiu foi de 4g.
b) Que massa de oxigênio seria necessária para reagir com todo o mercúrio inicial?
Se 50 g de mercúrio consumiram 4 g de oxigênio, então 100 g de mercúrio (o dobro da massa) irão consumir 8 g de oxigênio (o dobro da massa também). Ou, usando a razão calculada no item a:
0,08 = x / 100 x = 8 g de oxigênio
5. As ideias sobre a constituição da matéria propostas por John Dalton no início do século XIX podem explicar:
I. a produção de energia elétrica numa pilha; massa de oxigênio = 4 = 0,08 massa de mercúrio 50
x = 4 · 100
x = 8 g de oxigênio 50
4 g de oxigênio = x
50 g de mercúrio 100 g de mercúrio
II. o aumento de massa durante a queima da palha de aço;
III. o fato de os materiais se combinarem em proporções definidas nas transformações químicas.A aplicação correta do modelo atômico de Dalton ocorre apenas em:
a) I
b) II
c) III
d) I e II
e) II e III
O modelo de Dalton explica os itens II e III, mas não o I, pois Dalton não considerava a existência de cargas elétricas nos átomos.
6. A corrosão de monumentos de mármore ou de metais e derretimento das calotas polares estão relacionadas, respectivamente, aos seguintes problemas ambientais:
a) destruição da camada de ozônio e aquecimento global;
b) chuva ácida e aquecimento global;
c) efeito estufa e superaquecimento global;
d) chuva ácida e destruição da camada de ozônio;
e) superaquecimento global e chuva ácida.
As transformações químicas têm de ser muito bem entendidas, pois nelas está ancorado o estudo da Química. É necessário pensar em alternativas que permitam um trabalho mais autônomo dos alunos que ainda não construíram adequadamente esses conceitos.
Professor, solicite aos alunos que elaborem um trabalho sobre as atividades em que eles têm ou tiveram as maiores dúvidas. Eles deverão buscar em seus próprios cadernos e em cadernos de colegas as informações necessárias. O trabalho deverá conter o tema da atividade.
Outra possibilidade de Situação de Recuperação é a realização de um experimento simples que contempla os aspectos referentes às transformações químicas abordadas ao longo deste volume, conforme indicado a
seguir:
Materiais
f 1 chapa de aquecimento: tampa metálica de lata de leite em pó, fundo de uma lata ou chapa de alumínio retirada de uma lata de refrigerante;
f 1 lamparina a álcool;
f 1 tripé;
f sal de cozinha;
Atividade e as ideias e os conceitos principais nela tratados. Eles podem ser auxiliados por meio de perguntas. Por exemplo, na Atividade 2 (Situação de Aprendizagem 2), você pode orientar a síntese com perguntas como:
Como reconhecer se houve uma transformação química? Quais foram as evidências observadas nos
experimentos?
Dê dez exemplos de transformações químicas que você conhece e organize-os em uma tabela como esta a seguir. Quatro dos exemplos deverão ser extraídos das aulas e os outros deverão ser extraídos do dia a dia.
Transformação química
Classificação – quanto ao tempo – Sinais – perceptíveis – Formas de energia envolvidas
Classificação-
quanto à energia
f sulfato de cobre pentaidratado;
f açúcar;
f 1 conta-gotas com água.
Procedimento
f Coloque separadamente pequenas porções de sal de cozinha, sulfato de cobre
pentaidratado e açúcar na chapa de aquecimento.
f Aqueça uniformemente esses sólidos com a
chama da lamparina durante alguns minutos. Observe e anote.
f Apague a lamparina e deixe a chapa de
aquecimento esfriar.
Tabela 39.
QUIM_CP_vol1_1s_2014.indd 115 17/07/14 14:35
116
f Complete a tabela com as observações,
análises e conclusões.
Poderão também ser incluídos alguns exercícios como os sugeridos em Você aprendeu?
Há muitos deles nas apostilas do Programa
Pró-universitário, Química, Módulo I (SEE-
-SP/USP, 2004), e na maioria dos livros didáticos de Química para o Ensino Médio. Você
também pode apresentar outros valores para
os exercícios propostos ao longo das Situações
de Aprendizagem 7 e 8 e recapitular as ideias relativas ao efeito estufa e à chuva ácida. Discuta com seus alunos as opiniões científicas divergentes sobre o aquecimento global.
Outra sugestão é utilizar artigos sobre combustíveis, usos e impactos ambientais que os alunos tragam para ser debatidos em sala de aula ou outros indicados por você. Como exemplo, há dois textos da revista
Química Nova na Escola que abordam o tema biodiesel.
1. OLIVEIRA, F. C. C.; SUAREZ, P. A. Z.;
SANTOS, W. L. P. Biodiesel: possibilidades e desafios. Química Nova na Escola.
São Paulo: SBQ, n. 28, maio 2008. Disponível em: <http://qnesc.sbq.org.br/online/ qnesc28/>. Acesso em: 24 maio 2013.
2. CARDOSO, A. A.; MACHADO, C. M. D.; PEREIRA, E. A. Biocombustível, o mito do combustível limpo. Química Nova na
Escola. São Paulo: SBQ, n. 28, maio 2008.
Disponível em: <http://qnesc.sbq.org.br/ online/qnesc28/>. Acesso em: 24 maio 2013.
Aquecimento do sulfato de cobre pentaidratado Hidratação do sulfato de cobre anidro
Aquecimento de açúcar
Aquecimento de sal de cozinha
Descrição do estado inicial – Descrição do estado final – Evidências – Classificação quanto ao tempo – Classificação quanto à energia – Classificação quanto à revertibilidade Pode ser classificado como transformação química?
Tabela 40.
f Coloque a chapa de aquecimento sobre a
palma de uma das mãos e pingue algumas
gotas de água sobre o sulfato de cobre. Observe e anote.
Referencias:
https://portaldaengenharia.com/historia-da-eletricidade
https://www.youtube.com/channel/UCmFQaFIFfMGxRFRl6Kkbdkw
https://www.ebah.com.br/content/ABAAABg30AL/radiacoes-introducao-historico-aplicacao
http://www2.fc.unesp.br/BibliotecaVirtual/ArquivosPDF/DIS_MEST/DIS_MEST20060224_MARQUES%20DEIVIDI%20MARCIO.pdf