QUÍMICA
Os compostos covalentes e moleculares podem ser encontrados nos três estados físicos, possuem pontos de fusão e ebulição baixos e não conduzem eletricidade.
A análise das propriedades físicas e químicas dos compostos que realizam ligações covalentes (por compartilhamento de elétrons) nos mostra que existem grandes diferenças entre esses materiais. Mas, antes de vermos essas características em si, vejamos qual é a diferença entre substâncias moleculares e covalentes.
As substâncias moleculares são aquelas que se formam quando átomos se ligam por meio de ligações covalentes, originando moléculas de número determinado.
Entretanto, a ligação covalente pode originar também compostos em uma estrutura de rede com um número muito grande e indeterminado de átomos, que são macromoléculas. Tais substâncias são denominadas de compostos covalentes ou sólidos de rede covalente. Alguns exemplos desses compostos são: diamante (C), grafita (C), dióxido de silício (SiO2) e Carbeto de silício (SiC).
Agora, vejamos as suas principais propriedades:
- Estado Físico em temperatura ambiente: Nas condições ambientes, os compostos moleculares e covalentes são encontrados nos três estados físicos (sólido, líquido e gasoso).
Exemplos:
o Sólido: açúcar (sacarose), sílica (areia), diamante, grafita;
o Líquido: água, acetona, etanol;
o Gasoso: Sulfeto de hidrogênio, gás cloro, gás bromo, gás hidrogênio.

- Ponto de Fusão e Ebulição: Em geral, os pontos de fusão e ebulição dessas substâncias são menores que os das substâncias iônicas.
As substâncias covalentes apresentam as temperaturas de ebulição mais elevadas que as moleculares, sempre superiores a 1000ºC. Isso ocorre porque como suas moléculas estão unidas mais intensamente, formando as redes cristalinas, é preciso fornecer mais energia para fazê-las mudar de estado.
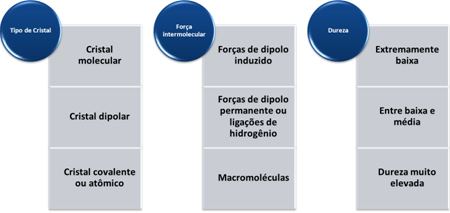
Dois fatores interferem nos pontos de ebulição e fusão dos compostos covalentes e moleculares: a massa molar e a força intermolecular.
Quanto maior a massa molar, maior a inércia da molécula e, consequentemente, maior será o ponto de ebulição e de fusão. Se as massas molares forem aproximadas, olhamos as forças intermoleculares. A força intermolecular de maior intensidade é a da ligação de hidrogênio, levando a um maior ponto de ebulição e fusão. A intermediária é a dipolo permanente e a mais fraca, que leva a um menor ponto de ebulição e fusão, é a dipolo induzido.
- Corrente elétrica: Em suas formas puras, tanto líquidos como sólidos não conduzem corrente elétrica.
Uma exceção é a grafita, que conduz corrente elétrica na forma sólida, porque seus elétrons das ligações duplas fazem ressonância e, por isso, possuem certa mobilidade.
- Solubilidade: Polares se dissolvem em polares e apolares se dissolvem em apolares.
- Tenacidade: A resistência das substâncias covalentes ao impacto ou choque mecânico é baixa. Em geral, são sólidos quebradiços, como mostra o caso do vidro, que é formado por silicatos de sódio e de cálcio.

- Dureza: Em geral, possuem elevada dureza. Com exceção da grafita, porque seus átomos de carbono encontram-se ligados a outros três átomos de carbono, formando placas hexagonais com certa mobilidade, fazendo com que ela seja macia. Devido a isso, ela é até mesmo usada como lubrificante.
A dureza dessas substâncias varia de acordo com o tipo de cristal, conforme mostrado na tabela a seguir: