INTRODUÇÃO
A Química é a ciência que explora o universo microscópico, estudando sua composição, estrutura, propriedades da matéria e as reações químicas. Durante as aulas, é preciso usar muito da imaginação para visualizar moléculas, átomos, enzimas, entre outros elementos invisíveis a olho nu.
A menor partícula possível de um elemento desse universo minúsculo é o átomo. Em grego, átomo significa “não-divisível”. Os átomos são componentes básicos de toda a matéria. Através das ligações covalentes, os átomos formam as moléculas.
CONSTITUIÇÃO DA MATÉRIA TEMA
De que é composto o Universo? Essa pergunta é curiosa e ao mesmo tempo comum, afinal o que compõe as estrelas, a água, a terra, os seres humanos e tudo que os cerca? Tudo provém da matéria e energia e a matéria é constituída de átomos. Sobre o núcleo atômico sabe-se que é constituído de prótons e nêutrons, aliás, essa teoria existe desde o ano de 1932, já nessa época defendia-se a ideia do átomo ser indivisível e recebeu a denominação de partícula fundamental.
Foram necessários vários anos de estudo para se chegar a essa concepção de átomo, e atualmente se faz importante o conhecimento da teoria atômica para entender a tecnologia presente o tempo todo em nossas vidas como, por exemplo, aparelhos eletrodomésticos como o forno microondas, a televisão, esses aparelhos possuem seus princípios de funcionamento baseados no átomo.
A matéria é formada por pequeníssimas partículas que chamamos de átomos. Os átomos possuem a propriedade de se agregar com outros átomos e compor diferentes materiais, é simples! Quando um átomo se junta com outro átomo logo surgem as moléculas, e essas por sua vez podem se unir a outras moléculas dando origem a moléculas cada vez maiores, até que se chegue no produto final: a composição da matéria.
E é basicamente assim que é formado tudo que vemos ao nosso redor, e esse conceito vai mais além, faz parte da composição do que não temos contato, como as estrelas, a lua, o sol, enfim, o átomo compõe o Universo.
Todas as coisas que compõem o universo são constituídos de energia e matéria. A matéria e a energia caminham juntas, pois se não existisse matéria não existiria energia e, não existindo energia não teríamos a matéria.

Matéria – A matéria tem duas características fundamentais: possui massa e ocupa lugar no espaço. Lembre-se que “ocupar lugar no espaço” é sinônimo de dizermos “tem volume”. Assim, massa e volume são coisas que tudo que é material tem. A matéria é formada por pequeníssimas partículas que chamamos de átomos; essas partículas podem se unir e formar o que chamamos de moléculas.

– Terra, Fogo, Água, Ar.
Energia – Capacidade de realizar trabalho.Entende-se por trabalho o movimento da matéria contra uma força que se opõe ao seu movimento. Assim, tudo que tem capacidade de movimentar a matéria possui energia.
Algumas formas de energia são térmica, solar, eólica, sonora, energia mecânica, elétrica e química, cinética, potencial, magnética, nuclear.Todas as formas podem converter-se umas nas outras, no entanto, a energia total do sistema permanece sempre constante.Assim, massa e volume são coisas que tudo que é material tem.
Corpo – é qualquer porção limitada da matéria.
Para um melhor entendimento acompanhe o seguinte raciocínio:
O ouro é uma matéria, mas se ele é usado para se obter uma joia, esse produto será considerado um objeto. Assim também acontece com a madeira, é uma matéria que dá origem a diferentes objetos: cadeiras, mesas, etc.
Objeto – é uma porção limitada de matéria quer por sua forma especial ou por sua (utilidade).

Massa – é a quantidade de matéria que um corpo possui, sendo, portanto, constante em qualquer lugar da terra ou fora dela.
Peso – de um corpo é a força com que esse corpo é atraído (gravidade) para o centro da terra. Varia de acordo com o local em que o corpo se encontra. Por exemplo: A massa do homem na Terra ou na Lua tem o mesmo valor. O peso, no entanto, é seis vezes maior na terra do que na lua.Explica-se esse fenômeno pelo fato da gravidade terrestre ser 6 vezes superior à gravidade lunar. Obs: A palavra grama, empregada no sentido de “unidade de medida de massa de um corpo”, é um substantivo masculino. Assim 200 g, lê-se “duzentos gramas”
A matéria tem 8 propriedades gerais, isto é, 8 características comuns a toda e qualquer porção de matéria: inércia, massa, extensão, impenetrabilidade, compressibilidade, elasticidade, divisibilidade e descontinuidade.
Conheça cada uma delas a seguir:
Inércia:A matéria conserva seu estado de repouso ou de movimento, a menos que uma força aja sobre ela. No jogo de sinuca, por exemplo, a bola só entra em movimento quando impulsionada pelo jogador, e demora algum tempo até parar de novo.
Massa: É uma propriedade relacionada com a quantidade de matéria e é medida geralmente em quilogramas. A massa é a medida da inércia. Quanto maior a massa de um corpo, maior a sua inércia. Massa e peso são duas coisas diferentes. A massa de um corpo pode ser medida em uma balança. O peso é uma força medida pelos dinamômetros.
Extensão: Toda matéria ocupa um lugar no espaço. Todo corpo tem extensão. Seu corpo, por exemplo, tem a extensão do espaço que você ocupa.
Impenetrabilidade: Duas porções de matéria não podem ocupar o mesmo lugar ao mesmo tempo. Comprove a impenetrabilidade da matéria: ponha água em um copo e marque o nível da água com esparadrapo. Em seguida, adicione 3 colheres de sal. Resultado: o nível da água subiu. Isto significa que duas porções de matéria (água e sal), não podem ocupar o mesmo lugar no espaço (interior do copo) ao mesmo tempo.
Compressibilidade:Quando a matéria está sofrendo a ação de uma força, seu volume diminui. Veja o caso do ar dentro da seringa: ele se comprime.
Elasticidade:A matéria volta ao volume e à forma iniciais quando cessa a compressão. No exemplo anterior, basta soltar o êmbolo da seringa que o ar volta ao volume e à forma iniciais.
Divisibilidade:A matéria pode ser dividida em partes cada vez menores. Quebre um pedaço de giz até reduzi-lo a pó. Quantas vezes você dividiu o giz?!
Descontinuidade:Toda matéria é descontínua, por mais compacta que pareça. Existem espaços entre uma molécula e outra e esses espaços podem ser maiores ou menores tornando a matéria mais ou menos dura.
Propriedades Específicas da Matéria
É importante ressaltar que analisando as propriedades especificas, é possível identificar uma substância desconhecida
- Propriedades organolépticas
- Propriedades químicas
- Propriedades funcionais
Organolépticas:
São aquelas que podem ser detectadas pelos órgãos dos sentidos:
Se em sua cozinha existirem dois potes sem identificação, um contendo sal e outro açúcar, você também os identifica pelo gosto salgado ou doce. Um recipiente com óleo diesel e outro com gasolina também conseguem ser identificados apenas pela sua aparência cor, brilho, odor e sabor.
a) Cor: está relacionada com a luz que ele reflete quando iluminado pela luz branca, a matéria pode ser colorida ou incolor. Esta propriedade é percebida pela visão.
b) Brilho: a capacidade de uma substância de refletir luz é a que determina o seu brilho. Percebemos o brilho pela visão.
c) Sabor: uma substância pode ser insípida (sem sabor) ou sápida (com sabor). Esta propriedade é percebida pelo paladar.
Algumas substâncias são conhecidas pelo seu sabor característico.
- Ácidos comestíveis: ácido cítrico/ ácido acético (vinagre)
- Açucares: frutose e sacarose
- Amargo: quinino, boldo
- Adstringente: caju e banana verde (amarra a boca)
O sabor no entanto não pode ser usado pelos químicos para identificar substâncias desconhecidas, pois elas podem ser tóxicas e venenosas.
d) Odor: a matéria pode ser inodora (sem cheiro) ou odorífera (com cheiro). Esta propriedade é percebida pelo olfato.

Nunca devemos cheirar substâncias desconhecidas, pois muitas liberam vapores tóxicos que podem provocar náuseas, tonturas e mal estar geral
Propriedades químicas
São aquelas que se referem à capacidade de uma substância de sofrer transformações.
Por exemplo, a combustão é uma propriedade que a gasolina possui. Quando esta queima, sua composição química muda, transformando-se em novas substâncias. Além da combustão, outros exemplos de propriedades químicas são: oxidação, redução e reatividade.
Propriedades físicas da matéria
As propriedades físicas são propriedades específicas de determinada matéria. São aquelas que podem ser observadas quando há ação mecânica ou do calor (energia térmica). As propriedades que estudaremos são:
Densidade, dureza, ponto de fusão, ponto de ebulição, calor específico, permeabilidade, condutibilidade.
Densidade
É o resultado da divisão entre a quantidade de matéria (massa) e o seu volume ocupado, também é chamada de massa específica.
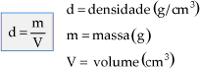
Se pegarmos 10g de algodão e 10g de chumbo, a quantidade de chumbo que teremos que pesar é bem menor que a quantidade. Isso se deve a densidade de cada um que é diferente, o algodão tem a densidade menor, por isso é mais leve e precisa de um volume maior pra completar as 10g em relação ao chumbo.
Vocês saberiam me dizer o por quê de certos objetos flutuam e outros afundam?! Isso está relacionado com a densidade do objeto e do líquido presente. Por exemplo, a água tem densidade de aproximadamente 1 g/cm3, o isopor tem d = 0,03 g/cm3 e o chumbo tem d = 11,3 g/cm3 , como o isopor é menos denso que a água ele irá flutuar e o chumbo que é mais denso irá afundar.
A densidade além de depender do tipo de material do objeto, depende também da temperatura. Um aquecimento, por exemplo, provoca a agitação das moléculas e quando elas se chocam, impulsionam a molécula do lado pra mais longe e assim ocorre dilatação do material (aumento de volume), o que interfere no valor da densidade.
Os gases, tem o volume muito sensível à variação de pressão, então a densidade dependerá também da pressão exercida sobre ele. Portanto, se houver mudanças de estado físico de um gás, ocorrerá também mudança na densidade dele. O fato de a água líquida, por exemplo, possuir uma densidade de 1 g/cm3, e a água sólida (gelo) ter d = 0,92 g/cm3, permite-nos entender o porquê do gelo flutua na água mesmo sendo constituídos da mesma matéria.
Dureza
Representa a resistência que a superfície de um material tem à ação mecânica. Um material é considerado mais duro que o outro quando consegue riscar esse outro deixando um sulco. É medida em graus (0 a 10) o valor 1 corresponde ao mineral menos duro que se conhece, o talco e o valor 10 é a dureza do diamante, o mineral mais duro já visto.
Ponto de fusão
É a temperatura em que uma determinada matéria passa do estado sólido para o líquido e vice-versa em uma determinada pressão. Exemplos:
|
Substância |
Ponto de Fusão (ºC) |
|
Oxigênio Nitrogênio Água Ouro Ferro |
-218,8 -210 0 1064 1538 |
Ponto de ebulição
É a temperatura em que uma determinada matéria passa do estado líquido para o estado gasoso e vice-versa em uma determinada pressão. Exemplos:
|
Substância |
Ponto de Ebulição (ºC) |
|
Oxigênio Nitrogênio Água Ouro Ferro |
-183 -196 100 2856 2861 |
Durante o aquecimento de substâncias puras, quando se atinge o ponto de fusão ou de ebulição, a temperatura da substância deixa de aumentar, mesmo que continue a aquecê-la. Só quando toda a substância tiver sofrido a mudança de estado físico é que a temperatura volta a aumentar. Assim, podemos determinar se uma substância está pura ou não medindo seu ponto de fusão. Se durante a fusão houver variações acima de 1ºC é sinal que sua substância não está pura.
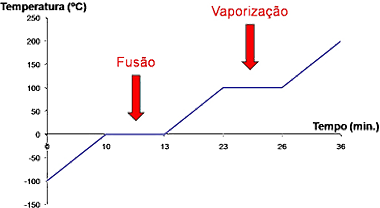
Abaixo temos um gráfico de como varia a temperatura quando aquecemos uma amostra de água pura, desde os -100 ºC até aos 200 ºC. Observe que durante a fusão e vaporização as temperaturas param de subir:
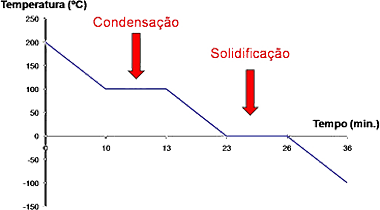
Durante o resfriamento o resfriamento, o gráfico começa na temperatura mais alta até a temperatura mais baixa:
Vamos aproveitar essas propriedades físicas da
matéria e aprender um pouco mais sobre
os estados físicos?!
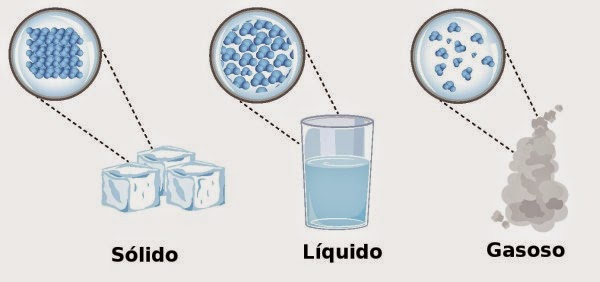
Uma substância pode ser encontrada no estado físico LÍQUIDO, SÓLIDO OU GASOSO.
Estado gasoso
Nesta fase as partículas da substância estão com maior energia cinética, ou seja, elas estão se movimentando mais, livremente e com maior velocidade colidindo entre si. Essa colisão faz com que as moléculas se afastem e por isso a distância entre as moléculas no estado gasoso é maior que a do estado líquido e do estado sólido sucessivamente.
Um gás qualquer colocado dentro de uma garrafa de 1 litro adquire a forma da garrafa e seu volume será de 1 litro. Assim, dizemos que na fase gasosa possui forma e volume variáveis.
Sabendo que os gases (ao contrário dos líquidos e sólidos) não têm volume fixo, com um aumento de pressão podemos comprimi-los, ou reduzir o seu volume facilmente, pois há mais espaço entre as partículas.
Estado líquido
No estado líquido, a matéria tem forma variável e volume definidos. As partículas estão um pouco mais unidas, não há um arranjo definido. As partículas nos líquidos “deslizam” umas sobre as outras e se movem. Isto é o que proporciona a fluidez no líquido. Todos os líquidos podem fluir, e alguns mais que os outros. Os líquidos com baixa viscosidade oferecem menor resistência para fluir A água, por exemplo, flui com mais facilidade que o óleo. Então a água tem baixa viscosidade e o óleo tem alta viscosidade.
Estado sólido
No estado sólido, o corpo tem forma e volume definidos. A matéria em estado sólido pode se apresentar compacta, em pedaços ou em pó. As partículas que formam a substância possuem a menor energia cinética; elas permanecem praticamente imóveis, unidas por forças de atração e geralmente com um arranjo definido, ou seja, cada partícula se encontra uma posição certa.
O arranjo das moléculas de água, na fase sólida, é o responsável pelo aumento do seu volume. Então, ao se congelar, a água se expande, formando o gelo que é menos denso que a água na fase líquida.
Como as moléculas estão organizadas em cada estado físico:
 Mudanças no Estado da Matéria
Mudanças no Estado da Matéria
Mudanças de Fases da Matéria:
Fusão
É a passagem do estado sólido para o líquido. Quando fornecemos calor a um corpo, suas partículas vibram mais e essa agitação faz com que ocorra a mudança de estado.
Solidificação
É a passagem do estado líquido para o sólido. Quando se resfria um corpo, suas moléculas vibram menos e assim se solidificam.
Vaporização
É a passagem do estado líquido para o gasoso. Pode ocorrer por evaporação (passagem lenta e espontânea estimulada pela temperatura, ventilação e superfície de evaporação), ebulição (passagem com grande agitação molecular e a formação de bolhas) e calefação (passagem brusca).
Condensação:
Também chamada liquefação, é a passagem do estado gasoso para o estado líquido.
Sublimação
É a passagem direta do estado sólido para o gasoso ou vice-versa.
Propriedades Físicas da Matéria:
Calor específico
O calor específico é a quantidade de calor que deve ser fornecida para que 1 g de substância tenha a sua temperatura elevada em 1°C. Cada substância possui um determinado valor de calor específico, que é geralmente expresso em cal/g.°C.
|
Material |
Calor específico (cal/g.ºC) |
|
Acetona Areia Água Cobre Etanol Ferro Ouro Prata Alumínio |
0,52 0,2 1 0,09 0,59 0,11 0,03 0,05 0,22 |
Quanto maior for o calor específico de uma substância, maior será a quantidade de calor que deverá ser fornecida ou retirada dela para que ocorram variações de temperatura. A água, quando comparada com os outros materiais da tabela, possui o maior calor específico, que corresponde a 1 cal/g.ºC.
Permeabilidade
Específica para o estado sólido, representa a capacidade de corpos materiais em absorver líquidos.
Condutibilidade
Capacidade de uma matéria em transmitir a passagem de uma corrente elétrica
Propriedades Funcionais da Matéria
São propriedades características de um grupo de substâncias que apresentam propriedades semelhantes. São propriedades que estão presentes em um determinado conjunto de substâncias. Dentre as propriedades funcionais da matéria podemos citar as FUNÇÕES INORGÂNICAS.
As funções inorgânicas apresentam um certo número de características semelhantes.Podemos citar quatro tipos de funções inorgânicas:
1 – ÁCIDOS: Todos os ácidos tem como características o sabor AZEDO.
CUIDADO: Esse conceito não serve de pretexto para você sair experimentando tudo que é acido para constatar seu sabor azedo. Alguns ácidos são extremamente tóxicos e causar lesões graves e até mesmo levar a morte. Portanto tenha muito cuidado. Fiquemos com as substâncias ácidas mais comuns como limão, laranja, abacaxi, maracujá, vinagre, suco de uva, etc. Constata-se que essas substâncias realmente tem sabor azedo, logo dizemos que são substâncias ácidas.
Há também as substâncias ácidas mais fortes, como é o caso dos ácidos usados em laboratóriosque são altamente tóxicos, ÁCIDO CLORÍDRICO ( HCl ) e o ÁCIDO SULFÚRICO ( H2SO4 ).
2- BASES OU HIDRÓXIDOS: As Bases ou Hidróxiodos tem como característica o sabor adstringente, ou seja é uma substância que retrai ou contrai os tecidos humanos. Podemos dizer que ao experimentarmos uma substância com caráter básico, temos aquela sensação de boca travada, como se estivéssemos comido um caqui verde ou uma banana verde.
CUIDADO: O mesmo conselho dado para os ácidos, também serve para as BASES, então não saia experimentando tudo por aí para ver se tem característica de BASE. Assim como os ácidos, existem algumas bases que são extremamente tóxicas podendo causar lesões gravíssimas e irreversíveis e até levar a morte. Um exemplo de substância com caráter de BASE ou HIDRÓXIDO que é letal se ingerido é o HIDRÓXDIO DE SÓDIO ( NaOH ), conhecido popularmente como SODA CAUSTICA.
Existe um exemplo de hidróxido que é usado como medicamento laxante e antiácido estomacal que é o chamado HIDRÓXIDO DE MAGNÉSIO ou popularmente conhecido como LEITE DE MAGNÉSIA.
3 – ÓXIDOS: São compostos formados por dois elementos ( São os chamados compostos BINÁRIOS ), sendo que o elemento OXIGÊNIO é um deles, e estará sempre à direita da fórmula. A seguir cito alguns exemplos de fórmulas de óxidos bem como seus nomes e aplicações:
– CO2, DIÓXIDO DE CARBONO, conhecido popularmente como gás carbônico. No estado sólido é chamado Gelo Sêco. Esse composto é o gás dos refrigerantes.
– CO, MONÓXIDO DE CARBONO. Gás venenoso que pode causar a morte. Esse gás se origina pela combustão imcompleta. Se inalado em grande quantidada, se liga a hemoglobina do sangue e impede a passagem de oxigênio para o cérebro, levando a morte em poucos minutos. É um dos gases responsáveis pelo efeito estufa.
– CaO, ÓXIDO DE CÁLCIO – Conhecido popularmente por CAL. Utilizada na fabricação da argamassa, na fabricação do vidro. A chamada CAL VIRGEM ou CAL viva é muito utilizada para se fazer doce de abóbora.
4 – SAIS: São compostos formados pela reação entre um ÁCIDO e uma BASE.
ÁCIDO + BASE = SAL + ÁGUA
EXEMPLOS DE ALGUNS TIPOS DE SAIS E SUAS APLICAÇÕES
NaCl, CLORETO DE SÓDIO, popularmente conhecido como sal de cozinha. Acho que não preciso citar suas aplicações, não é mesmo?
Cloreto de Sódio- NaCl- Sal de cozinha
Questões para fixação dos temas trabalhados, responder no caderno, demonstrar os cálculos.
- Recorde as definições de matéria.
- Matéria é tudo aquilo que ocupa lugar no espaço e pode, de alguma forma, ser medido.
- Matéria é tudo o que tem massa. Marque com X o que não é exemplo de matéria.
A) Borracha
B) Ar
C) Calor
D) Fumaça
2) Para cada exemplo de propriedade da matéria, acrescente pg ( propriedade geral) ou pe ( propriedade específica).
( ) massa
( ) ebulição
( ) dureza
( ) volume
É propriedade geral da matéria somente:
A) cor e volume
B) volume e massa
C) volume , ebulição e cor
D) dureza e volume
3) Qual das propriedades físicas abaixo é específica da matéria?
Cor
Massa
Volume
Ponto de Fusão
Temperatura
4) Em condições normais, o ponto de ebulição da água é 100 °C. Podemos afirmar que esta é uma propriedade:
a) específica
b) genérica
c) funcional
d) geral
e) organoléptica
5) A seguir são apresentadas algumas propriedades do cloreto de sódio (NaCl – sal de cozinha):
I. Sólido;
II. Cristalizado no sistema cúbico com faces centradas;
III. Branco;
IV. Com ponto de fusão a 800,4 °C;
V. Com ponto de ebulição a 1413 °C;
VI. Com solubilidade de 357 g/L a 25 °C;
VII. Com sabor salgado;
VIII. Inodoro;
IX. Em água, origina solução neutra;
X. No estado sólido, reage com ácido sulfúrico concentrado, produzindo gás clorídrico.
São propriedades especificas:
a) somente I, III e VIII.
b) somente IV, V e VI.
c) somente III, V e VII
d) somente I e X.
e) nenhuma das citadas.
6) Considere a mistura abaixo:
Sobre a mistura podemos afirmar que:
A) O gelo é mais denso que a água.
B) A água é mais densa do que o enxofre, e menos densa do que o gelo.
7) (PUC-MG) Em um laboratório de química, foram encontrados cinco recipientes sem rótulo, cada um contendo uma substância pura líquida e incolor. Para cada uma dessas substâncias, um estudante determinou as seguintes propriedades:
1. Ponto de ebulição
2. Massa
3. Volume
4. Densidade
8) Assinale as propriedades que podem permitir ao estudante a identificação desses líquidos.
a) 1 e 2
b) 1 e 3
c) 2 e 4
d) 1 e 4
10) As mudanças de estado físico do gasoso para o líquido e do sólido para o líquido respectivamente é:
A) fusão e solidificação.
B) vaporização e sublimação.
C) condensação e fusão.
D vaporização e solidificação.
11) Indique o volume: 2 Kg de chumbo ( densidade = 11,3 g/cm3 ) e 2 Kg de alumínio ( densidade = 2,7 g/cm3 ). Efetue e demonstre os cálculos. (Lembre um 1 Kg e igual a mil gramas)
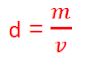
12) Se um liquido possui volume de 166 cm3 e a massa correspondente a 498 g . A densidade do líquido é: demonstre os cálculos
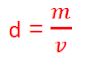
13) Um corpo tem densidade igual a 7,6 g/cm3 e o volume ocupa uma extensão de 200 cm3. Sua massa é:demonstre os cálculos
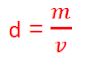
14) O latão, o bronze e o aço são misturas, denominadas ligas metálicas. Pode-se dizer que o latão, o bronze e o aço são tipos diferentes de:
A) misturas heterogêneas.
B) soluções líquidas.
C) soluções sólidas.
D) minerais rochosos.
15) Em geral, as pessoas consideram água mineral engarrafada como água pura, do ponto de vista químico, entretanto, se observarmos o rótulo de uma garrafa de água mineral, podemos afirmar que ela constitui uma:
A) mistura heterogênea.
B) mistura homogênea.
C) substância pura.
D) substância composta.
16) Um aluno deseja calcular a densidade de uma bola de gude. Primeiramente, mediu numa balança a massa do objeto 10 g. Depois, determinou o volume utilizando uma proveta com água que indicava 50 mL: mergulhou a bola de gude e a nova leitura foi 54 mL.
Os valores obtidos permitem saber a densidade do material que é feita a bola de gode é:
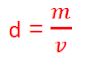
17) (Fuvest-SP) Quais propriedades a seguir são as mais indicadas para verificar se é pura uma certa amostra sólida de uma substância conhecida?
- Cor e densidade.
- Cor e dureza.
- Ponto de fusão e densidade.
- Cor e ponto de fusão.
- Densidade e dureza.
18) (FAAP-SP) No texto: “Um escultor recebe um bloco retangular de mármore e, habilmente, o transforma na estátua de uma celebridade do cinema”, podemos identificar matéria, corpo e objeto e, a partir daí, definir esses três conceitos.
I. Matéria (mármore): tudo aquilo que tem massa e ocupa lugar no espaço.
II. Corpo (bloco retangular de mármore): porção limitada de matéria que, por sua forma especial, se presta a um determinado uso.
III. Objeto (estátua de mármore): porção limitada de matéria.
Assinale a alternativa correta:
a) se somente a afirmativa I é correta.
b) se somente a afirmativa II é correta.
c) se somente a afirmativa III é correta.
d) se somente as afirmativas I e II são corretas.
e) se as afirmativas I, II e III são corretas
19) (CFT-PR) As propriedades de um material utilizadas para distinguir-se um material do outro são divididas em Organolépticas, Físicas e Químicas. Associe a primeira coluna com a segunda coluna e assinale a alternativa que apresenta a ordem correta das respostas.
PRIMEIRA COLUNA
(A) Propriedade Organoléptica
(B) Propriedade Física
(C) Propriedade Química
SEGUNDA COLUNA
( ) Sabor
( ) Ponto de Fusão
( ) Combustibilidade
( ) Reatividade
( ) Densidade
( ) Odor
( ) Estados da Matéria
a) A, B, C, C, B, A, B
b) A, B, C, A, B, C, B
c) A, C, B, C, B, C, B
d) A, B, C, B, B, A, B
e) C, B, A, C, B, A, B
20) Observe a tabela que apresenta as temperaturas de fusão e de ebulição de algumas substâncias.
| Substância | TF ( °C) | TE ( °C) |
| I | -117,3 | 78,5 |
| II | -93,9 | 65 |
| III | 801 | 1413 |
| IV | 1550 | 2827 |
Em relação aos estados físicos das substâncias, a alternativa errada é:
a) I é sólido a -125 °C
b) II é gasoso a 80°C
c )III é líquido a 1000°C
d) IV é gasoso a 2900°C
FONTE: MATERIAL DE APOIO AO CURRÍCULO DO ESTADO DE SÃO PAULO: CADERNO DO PROFESSOR, QUÍMICA, ENSINO FUNDAMENTAL, ENSINO MÉDIO, 1ª SÉRIE. SÃO PAULO: SE, 2014
HTTP://BLOGDEQUIMICAEJA.BLOGSPOT.COM/2017/https://www.mundovestibular.com.br/articles/9303/1/Propriedades-gerais-da-Materia/Paacutegina1.html
Definição e propriedades da matéria – Simulado Enem de Química
Já sabemos que tudo ao nosso redor é formado de matéria, mas você sabe exatamente o que é a matéria? Teste seus conhecimentos sobre a definição e as propriedades da matéria com o Simulado Enem Online de Química. Se errar alguma das 10 questões, têm dicas para estudar!
(UEPG PR/2010)
Define-se como um fenômeno químico aquele que altera a identidade química da espécie da matéria envolvida, ou seja, promove uma reação química. Nesse contexto, assinale o que for correto, no que se refere à exemplificação dessa afirmação.
(UEFS BA/2013)
O ato de medir afeta a grandeza medida, e isso se torna tanto acentuado quanto menor é o objeto da medida observado. Algo semelhante ocorre ao se observarem os elétrons em um átomo. A própria luz interage com eles e afeta a posição e a energia dessa partícula-onda. É, portanto, impossível ter certeza absoluta da posição de um elétron em um átomo, de acordo com o princípio de incerteza de Werner Heisenberg, (1901-1976).
A partir dessas considerações sobre o princípio de incerteza associado aos modelos atuais de estrutura atômica da matéria, é correto afirmar:
UEPG PR/2001)
Assinale o que for correto.
(IFGO/2015)
Em relação aos três estados físicos de agregação da matéria: sólido, líquido e gasoso, é correto afirmar que
(IFGO/2015)
Em relação aos três estados físicos de agregação da matéria: sólido, líquido e gasoso, é correto afirmar que
Competências e habilidades: ler e compreender as informações referentes à constituição da matéria, bem como os fatores que nela influem.·
Estratégias de ensino: levantamento das ideias dos alunos; leitura e discussão do texto e das questões para a interpretação do texto.·
Recursos: Pesquisa – Constituição da matéria.



