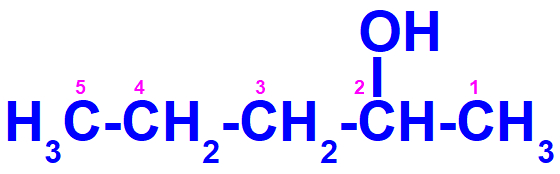História Da Isomeria
Já em 1830, o químico Berzelius que deu nome ao fenômeno, em seus experimentos para obter ácido tartárico, fez a seguinte observação: durante o processo era possível obter duas formas diferentes da substância, com composição e fórmulas idênticas, mas que se diferenciavam pela posição dos átomos na molécula.
Isomeria Plana
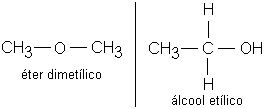
Éteres: compostos que apresentam Oxigênio (O) localizado entre carbonos.
Alcoóis: apresentam grupo (-OH) ligado a carbono saturado.

1-pentino e 2-pentino possuem mesma fórmula molecular: C5H8O.
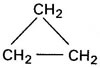
cadeia fechada
Ciclopropano – cadeia fechada (cíclica)
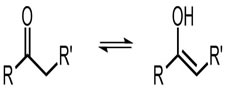
Cetona Enol
Isomeria Espacial
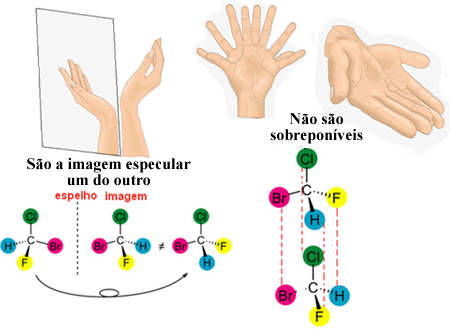
A isomeria espacial faz uma análise espacial da molécula, ela é dividida em: isomeria geométrica e isomeria óptica.
.jpg)
Talidomida
A talidomida é um fármaco que possui dois isômeros ópticos, sendo que um atua como sedativo e o outro causa deformações em fetos, sendo, portanto, proibido para grávidas.
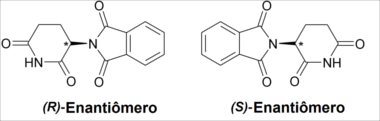
Os enantiômeros da talidomida possuem atividade óptica, sendo que o dextrogiro ou enantiômero (R) desvia o plano de luz polarizada para a direita, e o levogiro ou enantiômero (S) desvia o plano de luz polarizada para a esquerda. Assim, uma mistura racêmica é opticamente inativa porque contém partes iguais desses dois enantiômeros.
No entanto, essa diferença na conformação espacial dos átomos acaba por resultar em diferentes propriedades biológicas, ou seja, diferentes atividades exercidas em um organismo vivo. Com o tempo, descobriu-se que somente o isômero dextrogiro ou (R) era responsável pelas propriedades analgésicas, sedativas e antessentires, enquanto a talidomida levogira (S) é teratogênica, isto é, provoca mutações no feto.Por essa razão, durante as décadas mencionadas nasceram cerca de 12 mil crianças com má formação. Entre os efeitos colaterais que a talidomida pode causar nos fetos estão: desenvolvimento incompleto ou defeituoso dos membros, malformação no coração (como a ausência de aurículas), intestino, útero e vesícula biliar; efeitos nos músculos dos olhos e da face, surdez, defeitos na tíbia e no fêmur, além de, como a imagem a seguir mostra, polegar com três
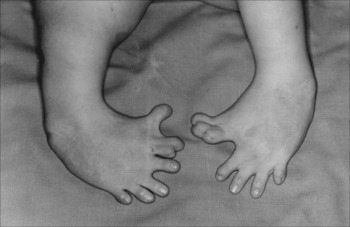
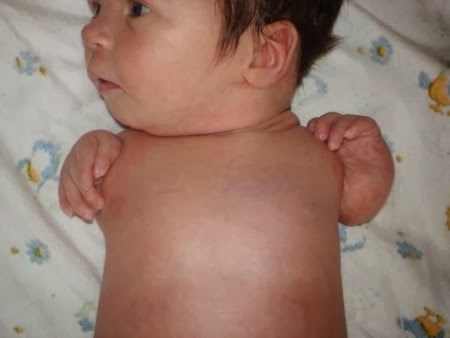
Malformação congênita dos pés, um dos efeitos do uso de talidomida sobre fetos*
Por Jennifer Fogaça
Graduada em Química
Isômeros Opticamente Ativos
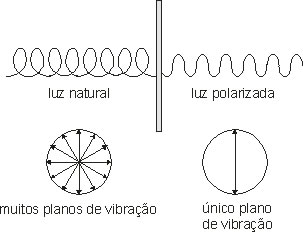
Isômeros opticamente ativos são substâncias orgânicas capazes de polarizar e desviar o plano da luz para a direita e para a esquerda.
.jpg)
Representação da luz polarizadaA imagem acima representa a única incidência dos feixes de luz, a partir de uma fonte luminosa, polarizada ao passar por uma substância que apresenta isômeros opticamente ativos.Como foi dito, além de polarizar, existem isômeros que desviam a luz para a direita e outros que desviam a luz para a esquerda, conforme a representação abaixo:
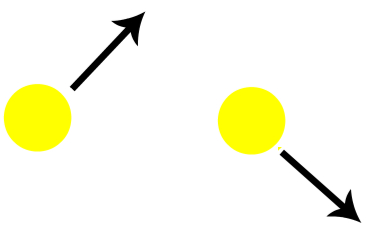
Desvios realizados por moléculas de isômeros opticamente ativos⇒ Dextrogiros: é o nome dado à molécula da substância capaz de polarizar e desviar a luz para a direita;
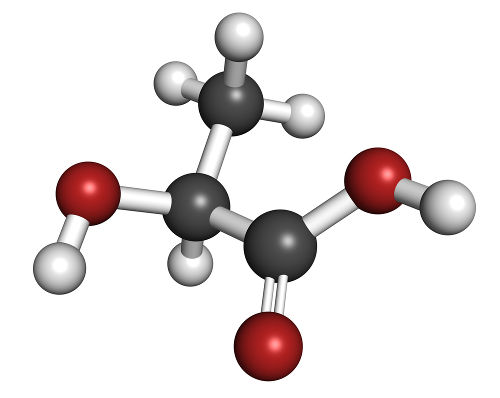
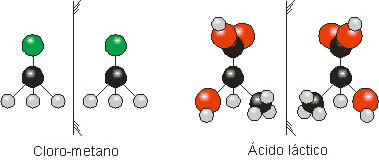
O ácido lático apresenta isômeros opticamente ativos
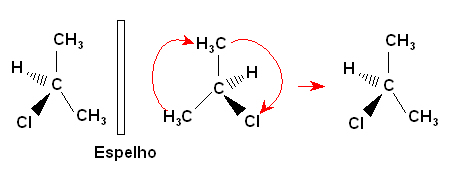
O Que É Um Carbono Assimétrico Ou Quiral?
|
G1 — C*— G2 Sendo que G1 ≠ G2 ≠ G3 ≠ G4
|
G4
|
H3C — C* — CH2 — CH2 — CH3
|
CH2
|
CH3
A tragédia da talidomida e a luta por direitos e regulação
Novembro/2017
A tragédia da talidomida, no final dos anos 1950, foi um divisor de águas na regulação de medicamentos. Ela foi descoberta na Alemanha em 1953 para ser agregada a antibióticos, mas foi reconhecida mundialmente após 1957 como sedativo e hipnótico. Em 1961, entre 10 e 15 mil crianças nasceram com malformações após suas mães terem ingerido o medicamento durante a gestação.
No Brasil, o assunto talidomida nunca saiu da pauta de problema público, pois a falta de uma regulação efetiva do medicamento fez com novos casos de malformações aparecessem após a aparentemente retirada da droga de circulação em 1962.
No artigo A tragédia da talidomida: a luta pelos direitos das vítimas e por melhor regulação de medicamentos, Adriana Moro e Noela Invernizzi, respectivamente doutoranda e professora do Programa de Pós-graduação em Políticas Públicas da Universidade Federal do Paraná, revisitam a história da talidomida e seus desdobramentos no plano regulatório e dos direitos das vítimas no Brasil com base em revisão de literatura, análise documental e reportes de jornais. Entre dezembro de 2014 e agosto de 2015, as autoras pesquisaram o acervo da Associação Brasileira de Portadores da Síndrome da Talidomida (ABPST) de notícias da mídia impressa veiculadas entre as décadas de 1960-1980.
“Observamos que a mídia se tornou um espaço para a voz das vítimas, jogando um papel relevante ao transformar o drama das famílias em um problema público. As organizações de vítimas e familiares, assim como médicos, advogados e outros atores demandaram publicamente maior controle da indústria farmacêutica e denunciaram as lentas respostas dadas às vítimas. A divulgação também auxiliou na conquista de outras pautas como os direitos dos portadores de deficiência e promoveu o debate social sobre questões bioéticas referentes aos conflitos de interesse na saúde, o direito à vida, o aborto, entre outros”, revelam.
Segundo as autoras, os eventos evidenciaram a carência de normas fortes para o uso seguro de medicamentos e o quão frágeis eram a regulação e as práticas de comunicação entre médicos e instituições, o que não apenas permitiu a ocorrência da tragédia como também gerou morosidade no seu enfrentamento. “As notícias denotaram a tremenda desigualdade entre o poder das empresas causantes do problema e as vítimas. A transformação dos acontecimentos em um problema público, mediante sua veiculação na mídia, e a crescente mobilização das vítimas, foram forças essenciais que pressionaram por uma regulação de medicamentos mais efetiva”, afirmam.
Leia em HCS-Manguinhos:
A tragédia da talidomida: a luta pelos direitos das vítimas e por melhor regulação de medicamentos
Adriana Moro e Noela Invernizzi, respectivamente doutoranda e professora do Programa de Pós-graduação em Políticas Públicas/Universidade Federal do Paraná.
Talidomida, o calmante barato e eficaz que causou terríveis deformações físicas nos recém nascidos



.jpg)