Funções orgânicas Assim como em química inorgânica, em química orgânica também agrupamos as substâncias com propriedades químicas semelhantes, que são consequência de características estruturais comuns, em funções.
Cada função orgânica é caracterizada por um grupo funcional, que lhe confere características e nomenclaturas específicas.
| Sufixo | Infixo | ||
| N° de Carbonos | Saturação da Cadeia | ||
| 1C | MET | Saturadas | AN |
| 2C | ET | ||
| 3C | PROP | Insaturadas | |
| 4C | BUT | ||
| 5C | PENT | 1 dupla | EN |
| 6C | HEX | 2 duplas | DIEN |
| 7C | HEPT | 3 duplas | TRIEN |
| 8C | OCT | ||
| 9C | NON | 1 tripla | IN |
| 10C | DEC | 2 triplas | DIIN |
| 11C | UNDEC | 3 triplas | TRIIN |
Quando a cadeia possuir ramificações, deve-se utilizar a nomenclatura referente ao número de carbonos da ramificação seguida do sufixo IL para indicar um radical.
Com base nessa regra geral, podemos nomear qualquer função orgânica apenas sabendo o sufixo relacionado ao seu grupo funcional. Podemos dividir as funções orgânicas em hidrocarbonetos, funções oxigenadas, funções nitrogenadas, funções halogenadas e outras funções menores.
Hidrocarbonetos
São um conjunto de funções que só contém carbono e hidrogênio em sua estrutura.
Grupo Funcional: C, H.
Nomenclatura: terminação -O
Os hidrocarbonetos podem ser divididos em:
Alcanos ou parafinas: hidrocarbonetos que possuem cadeia aberta e ligações simples. O termo parafina significa pouco reativo, do latim parum = pequena + affinis = afinidade.
Fórmula Geral: CnH2n+2
Exemplos:
| Pentano |
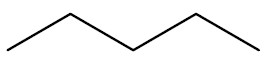 |
| Nonano |
| |
Quando houverem ramificações na cadeia, essas devem ser escritas a frente da cadeia principal, utilizando a terminação –IL. A cadeia principal é contada a partir da extremidade mais próxima da ramificação. Exemplo:
| 3-metil-nonano |
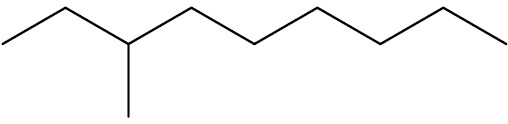 |
Se houverem duas ramificações, nomeá-las sempre em ordem alfabética. Exemplo:
| 4-etil-3-metil-heptano |
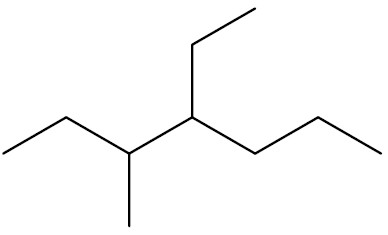 |
Quando houver dúvida, utilizar a contagem mais próxima da ramificação que virá primeiro em ordem alfabética. Exemplo:
| 3-etil-4-metil-hexano |
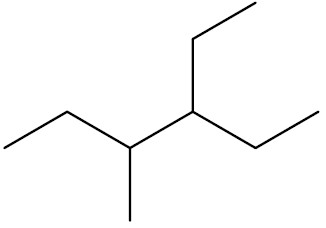 |
Alcenos, alquenos ou olefinas: são hidrocarbonetos que possuem cadeia aberta e ligações duplas (insaturação). O termo olefina significa oleoso, do latim oleum = óleo + affinis = afinidade.
Fórmula Geral: CnH2n
Na nomenclatura dos alcenos, é importante que a contagem da cadeia principal comece na extremidade mais próxima da dupla ligação. A posição da dupla deve vir antes do infixo que indica o tipo de ligação.
Exemplos:
| pent-2-eno |
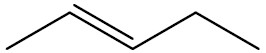 |
| 5-metil-hex-2-eno |
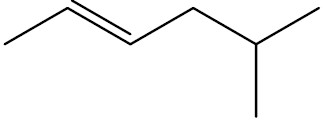 |
Alcinos ou alquinos: são hidrocarbonetos que possuem cadeia aberta e ligações triplas. Utiliza-se para os alcinos as mesmas regras de nomenclatura dos alcenos, mas com sufixo in (+0, sufixo geral dos hidrocarbonetos).
Fórmula Geral: CnH2n-2
Exemplos:
| hept-2-ino |
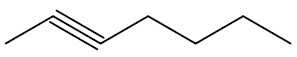 |
| 4-metil-hept-1,5-diino |
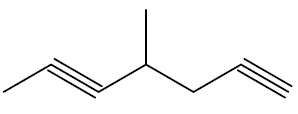 |
Alcadienos ou dienos: são alcenos que possuem duas duplas ligações.
Fórmula Geral: CnH2n-2
Exemplo:
| hex-2,4-dieno |
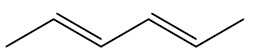 |
Hidrocarbonetos cíclicos: apresentam cadeia fechada e podem ou não possuir insaturações. Sua nomenclatura segue a regra dos hidrocarbonetos de cadeia aberta, apenas adicionando a palavra ciclo na frente.
Exemplos:
| Ciclopropano |
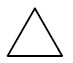 |
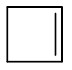
| Ciclobuteno |
 |
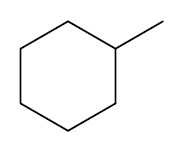
| Metil-ciclohexano |
 |
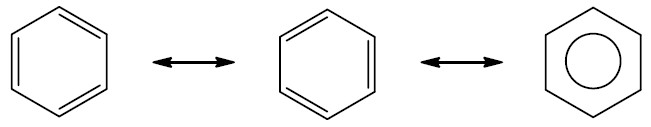
Aromáticos: são hidrocarbonetos cíclicos que possuem três ligações duplas alternadas que permanecem em ressonância, formando um anel aromático, mais conhecido como benzeno. O benzeno pode se ligar a outros anéis e formar outros compostos aromáticos.
Exemplo:
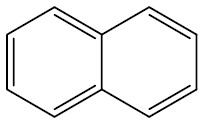
| Naftaleno |
 |
| Antraceno |
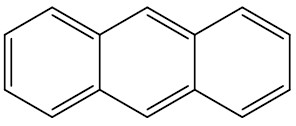 |
| Fenantraceno |
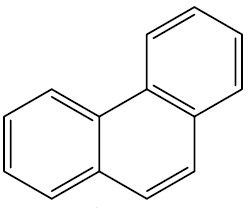 |
Nos anéis aromáticos ramificados, é comum utilizar a seguinte designação para as posições das ramificações:
| 1,2-dimetil-benzeno ou orto-dimetil-benzeno |
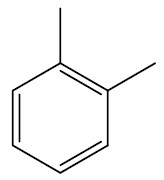 |
| 1,3-dimetil-benzeno ou meta-dimetil-benzeno |
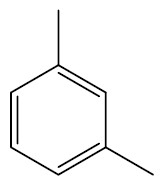 |
Funções oxigenadas
São funções que apresentam o oxigênio na sua estrutura.
Álcoois: são compostos que apresentam o grupo hidroxila (‒OH) em sua estrutura. Podem possuir insaturações, cadeias cíclicas e ramificações. São solúveis em água e até onze carbonos são líquidos.
Na nomenclatura, a contagem da cadeia principal deve iniciar na extremidade mais próxima do grupo funcional.
Grupo Funcional: ‒OH
Nomenclatura: terminação –OL
Exemplos:
| etanol |
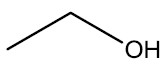 |
| 4-metil-hexan-2-ol |
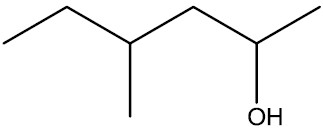 |
| 2-metil-pent-3-enol |
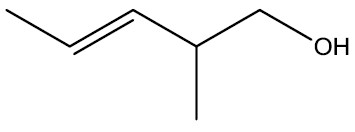 |
Fenóis: são álcoois onde a hidroxila está ligada diretamente ao anel aromático. São antibacterianos e fungicidas, mas podem ser tóxicos aos seres vivos.
Grupo Funcional: Caromático‒OH
Nomenclatura: Fenol ou hidroxi-benzeno
Nota: na nomenclatura de fenóis ramificados, deve-se iniciar a contagem no grupo funcional e girar no sentido horário ou anti-horário, de acordo com a menor numeração para a ramificação, a partir da hidroxila.
| Fenol ou hidroxi-benzeno |
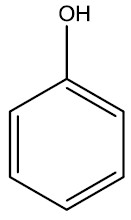 |
| 3-metil-fenol ou 1-hidroxi-3-metil-benzeno ou meta-metil-fenol |
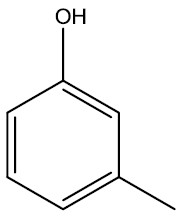 |
Éteres: são compostos que possuem um átomo de oxigênio ligado a dois átomos de carbono. Podem ser formados pela desidratação intermolecular de álcoois.
Grupo Funcional: ‒O‒
Nomenclatura: prefixo que indica o número de carbonos do menor radical + OXI + nome do hidrocarboneto correspondente ao maior radical.
Exemplos:
| Metoxi-propano |
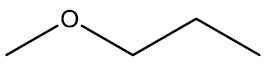 |
| Propoxi-propano |
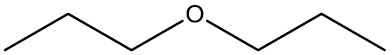 |
Aldeídos: são compostos que apresentam o grupamento carbonila (C=O) na extremidade da cadeia. O odor dos aldeídos que têm baixo peso molecular é irritante, porém, à medida que o número de carbonos aumenta, torna-se mais agradável.
Grupo funcional: 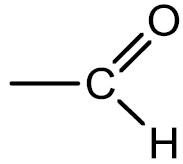
Nomenclatura: terminação -AL
Exemplos:
| Butanal |
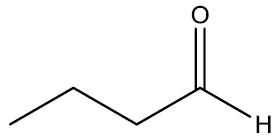 |
| 4-etil-hexanal |
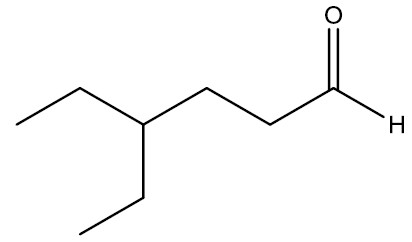 |
Cetonas: são compostos que apresentam o grupamento carbonila (C=O) no meio da cadeia. São formadas pela oxidação de álcoois secundários, onde um átomo de hidrogênio (ligado ao oxigênio) é retirado e o átomo de oxigênio passa a fazer uma ligação dupla com o carbono da cadeia.
Grupo funcional: 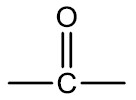
Nomenclatura: terminação -ONA
Exemplos:
| Propanona ou acetona |
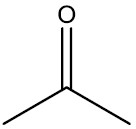 |
| 3-metil-pentan-2-ona |
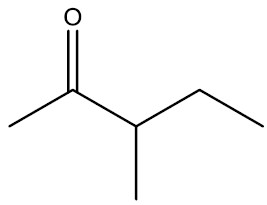 |
Ácidos Carboxílicos: são compostos que possuem o grupamento carboxila (carbonila + hidroxila) na extremidade da cadeia. Em geral são mais fracos que os ácidos inorgânicos e dão origem aos ácidos graxos e lipídeos.
Grupo funcional: 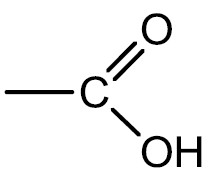
Nomenclatura: Ácido + terminação -ÓICO
Exemplos:
| Ácido propanóico |
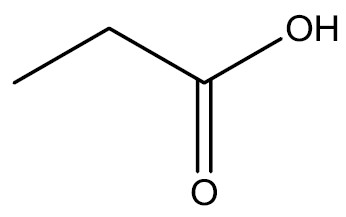 |
| Ácido 2-metil-butanóico |
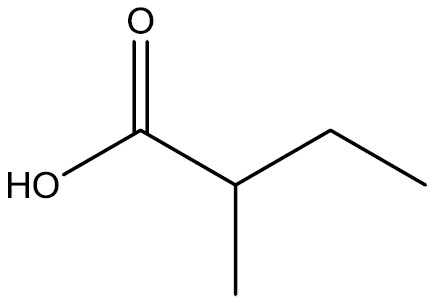 |
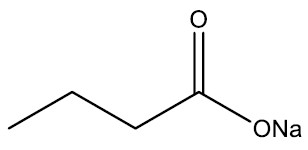
Sais de ácidos carboxílicos: são compostos derivados de uma neutralização do ácido carboxílico com uma base. Sendo o metal (Me) incorporado na cadeia carbônica enquanto há liberação de água.
Grupo funcional: 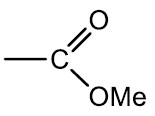
Nomenclatura: terminação –ATO de nome do metal
Exemplo:
| Butanoato de sódio |
 |
Ésteres: originam-se a partir da substituição do hidrogênio da hidroxila de um ácido por um radical orgânico. Podem ser produzidos pela esterificação de um ácido carboxílico com um álcool.
Grupo funcional: 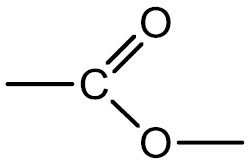
Nomenclatura: terminação –ATO de nome do radical carbônico
Exemplos:
| Propanoato de metila |
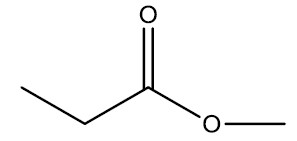 |
| Propanoato de propila |
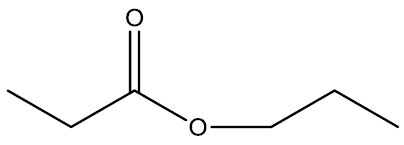 |
 Funções nitrogenadas
Funções nitrogenadas
São funções que possuem o nitrogênio em sua estrutura.
Aminas: são bases orgânicas, obtidas a partir da substituição de um ou mais hidrogênios da amônia (NH3) por radicais orgânicos. Os aminoácidos são compostos que possuem o grupamento amina e ácido carboxílico na mesma molécula.
Grupo Funcional: ‒NH2 ou ‒NH‒ ou ‒N<
Nomenclatura: terminação -AMINA
Exemplos:
| Etilamina |
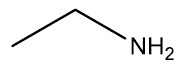 |
| Etil-metilamina |
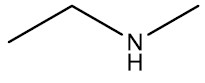 |
| Dietil-metilamina |
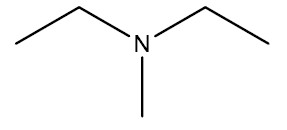 |
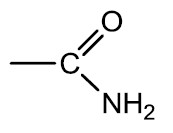
Amidas: São compostos orgânicos derivados de ácidos carboxílicos pela substituição da hidroxila (‒OH) pelo grupamento amino (‒NH2). A ureia, de fórmula CO(NH2)2, é uma diamida que é eliminada pela urina por ser produto final do metabolismo dos animais superiores.
Nomenclatura: terminação -AMIDA
Exemplos:
| Propanoamida |
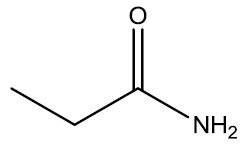 |
| 2-metil-propanoamida |
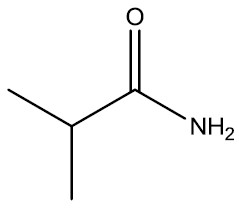 |
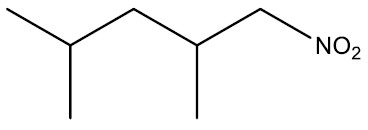
Nitrocompostos: São compostos que apresentam o radical nitro (‒NO2). Tem larga aplicação em explosivos e agrotóxicos.
Grupo Funcional: ‒‒NO2
Nomenclatura: NITRO + nome do hidrocarboneto
Exemplos:
| Nitrobutano |
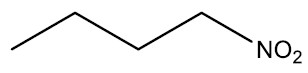 |
| 2,4-dimetil-nitropentano |
 |
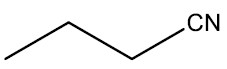
Nitrilas ou cianetos: são compostos que apresentam o radical nitrila (‒CN). São o resultado da substituição do átomo de hidrogênio do cianeto de hidrogênio ou ácido cianídrico (HCN) por um radical orgânico.
Grupo funcional: ‒CN
Nomenclatura: terminação -NITRILA
Exemplos:
| Butanonitrila |
 |
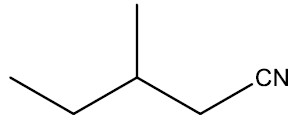
| 3-metil-pentanonitrila |
 |
 Funções halogenadas
Funções halogenadas
São funções que possuem em sua estrutura um halogênio (F, Cl, Br ou I).
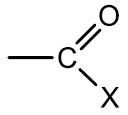
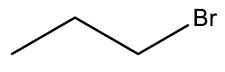
Haletos Orgânicos ou derivados halogenados: são compostos formados a partir da substituição de um átomo de hidrogênio de um hidrocarboneto por um halogênio. São insolúveis em água e em geral tóxicos e danosos aos organismos vivos.
Grupo Funcional: ‒X (F, Cl, Br ou I)
Nomenclatura: nome do halogênio + nome do hidrocarboneto
Exemplos:
| Bromo-propano |
 |
| Cloro-benzeno |
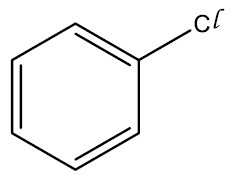 |
Haletos de Ácidos ou haletos de acila: são compostos derivados de ácidos carboxílicos onde a hidroxila foi substituída por um halogênio. Os cloretos de ácidos mais simples são líquidos de cheiro forte e irritante, tóxicos, insolúveis e mais densos que a água.
Nomenclatura: nome do halogênio + -ETO de nome do hidrocarboneto + ILA
Exemplos:
| Iodeto de hexanoíla |
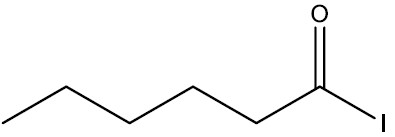 |
| Fluoreto de butanoíla |
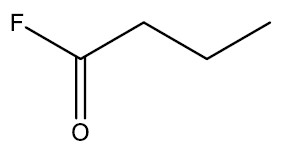 |
Ácidos sulfônicos
São compostos orgânicos derivados do ácido sulfúrico (H2SO4) pela substituição de uma hidroxila por um radical orgânico. São largamente aplicados na obtenção de surfactantes (espumantes), que estão presentes em xampus, detergentes e cremes dentais.
Grupo Funcional: ‒SO3H
Nomenclatura: ÁCIDO + nome do hidrocarboneto + SULFÔNICO
Exemplos:
| Ácido propanosulfônico |
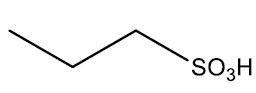 |
| Ácido 5-metil-3-hexasulfônico |
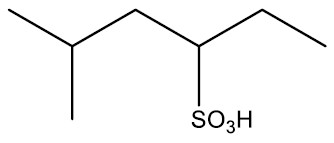 |
Compostos de Grignard
São compostos organometálicos que apresentam pelo menos um átomo de um metal ligado diretamente ao átomo de carbono.
Grupo Funcional: ‒MgX (F, Cl, Br, I)
Nomenclatura: halogênio + ETO de radical + MAGNÉSIO
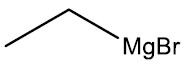
Exemplos:
| Brometo de etil-magnésio |
 |
| Fluoreto de ciclohexil-magnésio |
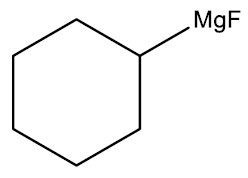 |
Compostos Organometálicos
Os compostos organometálicos são aqueles que apresentam pelo menos um átomo de um metal ligado diretamente ao átomo de carbono.
Organometálicos são os compostos orgânicos que possuem pelo menos um átomo de metal ligado a um átomo de carbono. Normalmente os metais que formam esse tipo de substância são: magnésio (Mg), zinco (Zn), chumbo (Pb) e mercúrio (Hg).
Dentre os organometálicos mais comuns estão os organomagnésios, mais conhecidos como compostos ou reagentes de Grignard, cujo metal ligado ao carbono é o magnésio, e ele, por sua vez, está ligado a um halogênio, que pode ser um dos seguintes elementos da família 17 da Tabela Periódica: flúor (F), cloro (Cl), bromo (Br) e iodo (I).
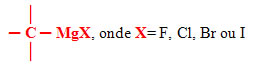
Os compostos organometálicos são normalmente tóxicos, pois possuem metais que se acumulam no organismo e são mais solúveis em compostos orgânicos do que outros compostos inorgânicos que têm a presença desses metais. Um exemplo em que isso pode ser visto é quando garimpeiros ou indústrias jogam compostos organometálicos em lagos e rios. Os resultados são graves problemas para a saúde dos usuários dessas águas (tanto humanos como animais), como também outros problemas ecológicos.
A seguir temos três exemplos de compostos organometálicos presentes em nosso dia a dia:
• Cloreto de etil-mercúrio (H3C ─ CH2 ─ HgCl): esse composto pode ser usado como fungicida na preservação de sementes. Entretanto, seu uso é muito perigoso, pois, por possuir mercúrio, ele é altamente tóxico, principalmente para o sistema nervoso;
• Butil-lítio (H3C ─ CH2 ─ CH2 ─ CH2 ─ Li): esse composto é usado como iniciador de polimerização para a produção de elastômeros, isto é, polímeros com propriedades elásticas;
• Tetraetil-chumbo (ou chumbotetraetila): por muito tempo esse composto foi usado como antidetonante na gasolina, pois aumentava sua octanagem e o rendimento do motor. No entanto, junto com a queima da gasolina, esse composto liberava chumbo para o meio ambiente, causando a poluição da atmosfera. Esse chumbo é tóxico, polui o meio ambiente e é especialmente perigoso porque afeta o cérebro, ocasionando efeitos na coordenação motora.
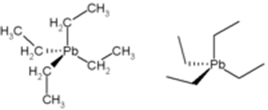
Estrutura do Tetraetil-chumbo.
Assim, em seu lugar está sendo usado outro organometálico: o ferroceno, que possui em sua estrutura dois anéis ciclopentadienila em cada lado de um ferro, conforme mostrado nas estruturas químicas abaixo:
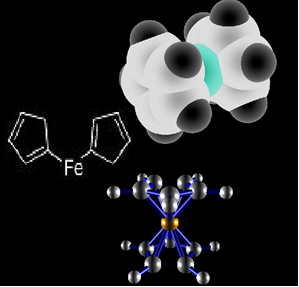
Estrutura do ferroceno.
A nomenclatura dos organometálicos segue o seguinte esquema:

Exemplos:
CH3
│
CH2
│
H3C ─ CH2 ─Al : trietilalumínio
│
CH2
│
CH3
H3C ─ CH2 ─ CH2 ─ Li : propil-lítio
Se for um composto de Grignard, temos:

Exemplos:
H3C ─ CH2 ─ MgCl : Cloreto etil-magnésio
H2C ═ CH ─ MgBr : Brometo de vinil-magnésio
Compostos Organometálicos
QUÍMICA
Os compostos organometálicos são aqueles que apresentam pelo menos um átomo de um metal ligado diretamente ao átomo de carbono.Organometálicos são os compostos orgânicos que possuem pelo menos um átomo de metal ligado a um átomo de carbono. Normalmente os metais que formam esse tipo de substância são: magnésio (Mg), zinco (Zn), chumbo (Pb) e mercúrio (Hg).
Dentre os organometálicos mais comuns estão os organomagnésios, mais conhecidos como compostos ou reagentes de Grignard, cujo metal ligado ao carbono é o magnésio, e ele, por sua vez, está ligado a um halogênio, que pode ser um dos seguintes elementos da família 17 da Tabela Periódica: flúor (F), cloro (Cl), bromo (Br) e iodo (I).
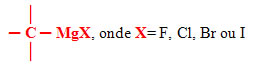
Os compostos organometálicos são normalmente tóxicos, pois possuem metais que se acumulam no organismo e são mais solúveis em compostos orgânicos do que outros compostos inorgânicos que têm a presença desses metais. Um exemplo em que isso pode ser visto é quando garimpeiros ou indústrias jogam compostos organometálicos em lagos e rios. Os resultados são graves problemas para a saúde dos usuários dessas águas (tanto humanos como animais), como também outros problemas ecológicos.
A seguir temos três exemplos de compostos organometálicos presentes em nosso dia a dia:
• Cloreto de etil-mercúrio (H3C ─ CH2 ─ HgCl): esse composto pode ser usado como fungicida na preservação de sementes. Entretanto, seu uso é muito perigoso, pois, por possuir mercúrio, ele é altamente tóxico, principalmente para o sistema nervoso;
• Butil-lítio (H3C ─ CH2 ─ CH2 ─ CH2 ─ Li): esse composto é usado como iniciador de polimerização para a produção de elastômeros, isto é, polímeros com propriedades elásticas;
• Tetraetil-chumbo (ou chumbotetraetila): por muito tempo esse composto foi usado como antidetonante na gasolina, pois aumentava sua octanagem e o rendimento do motor. No entanto, junto com a queima da gasolina, esse composto liberava chumbo para o meio ambiente, causando a poluição da atmosfera. Esse chumbo é tóxico, polui o meio ambiente e é especialmente perigoso porque afeta o cérebro, ocasionando efeitos na coordenação motora.

Estrutura do Tetraetil-chumbo.
Assim, em seu lugar está sendo usado outro organometálico: o ferroceno, que possui em sua estrutura dois anéis ciclopentadienila em cada lado de um ferro, conforme mostrado nas estruturas químicas abaixo:

Estrutura do ferroceno.
A nomenclatura dos organometálicos segue o seguinte esquema:

Exemplos:
CH3
│
CH2
│
H3C ─ CH2 ─Al : trietilalumínio
│
CH2
│
CH3
H3C ─ CH2 ─ CH2 ─ Li : propil-lítio
Se for um composto de Grignard, temos:

Exemplos:
H3C ─ CH2 ─ MgCl : Cloreto etil-magnésio
H2C ═ CH ─ MgBr : Brometo de vinil-magnésio
Por Jennifer Fogaça
Graduada em Química

Gostaria de fazer a referência deste texto em um trabalho escolar ou acadêmico? Veja:
FOGAçA, Jennifer Rocha Vargas. “Compostos Organometálicos”; Brasil Escola. Disponível em: https://brasilescola.uol.com.br/quimica/compostos-organometalicos.htm. Acesso em 07 de setembro de 2019.
Indique a nomenclatura do composto de Grignard mostrado a seguir:
H3C ─ CH2 ─ MgCl
a) cloreto de fenil magnésio
b) propil-magnésio-cloro
c) cloreto de etil-magnésio
d) etil-cloreto de magnésio
e) cloreto de magnésio etílico
Considere as reações genéricas a seguir:
R ─ X + Mg → R ─ MgX
R ─ MgX + RX →R ─ R+ MgX2
Com base nessas reações, complete as equações indicando os nomes de A e B.
H3C ─ CH2 ─ Br + Mg → A
A + H3C ─ CH2 ─ Br → B + MgBr2
a) brometo de metil-magnésio e butano.
b) brometo de etil-magnésio e etano.
c) brometo de magnésio etílico e butano.
d) brometo de magnésio etílico e etano.
e) brometo de etil-magnésio e butano

FOGAçA, Jennifer Rocha Vargas. “Compostos Organometálicos”; Brasil Escola. Disponível em: https://brasilescola.uol.com.br/quimica/compostos-organometalicos.htm. Acesso em 07 de setembro de 2019.
Indique a nomenclatura do composto de Grignard mostrado a seguir:
H3C ─ CH2 ─ MgCl
a) cloreto de fenil magnésio
b) propil-magnésio-cloro
c) cloreto de etil-magnésio
d) etil-cloreto de magnésio
e) cloreto de magnésio etílico
Considere as reações genéricas a seguir:
R ─ X + Mg → R ─ MgX
R ─ MgX + RX →R ─ R+ MgX2
Com base nessas reações, complete as equações indicando os nomes de A e B.
H3C ─ CH2 ─ Br + Mg → A
A + H3C ─ CH2 ─ Br → B + MgBr2
a) brometo de metil-magnésio e butano.
b) brometo de etil-magnésio e etano.
c) brometo de magnésio etílico e butano.
d) brometo de magnésio etílico e etano.
e) brometo de etil-magnésio e butano
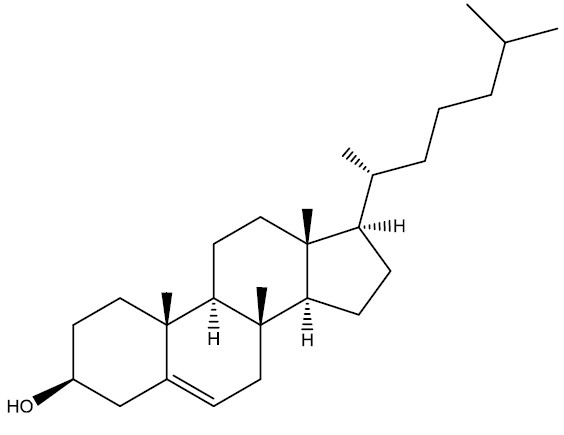
Funções mistas
São compostos que apresentam diversas funções na estrutura. Em geral, possuem nomenclatura IUPAC mais complexa, por esta razão são mais conhecidos por seus nomes usuais.
Exemplos:
| Colesterol |
 |
| Aspartame |
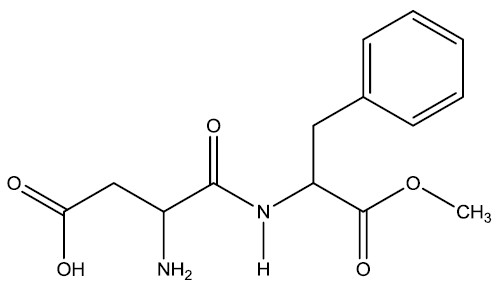 |
Bibliografia
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/materiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf


ISOMERIA
Referencia: https://www.infoescola.com/quimica/quimica-inorganica/
http://bebraga.blog-dominiotemporario.com.br/wp-content/uploads/2018/07/Destila%C3%A7%C3%A3o-fraccionada.mp4?_=1