Os números átomos.
Existem quatro números quânticos: quânticos descrevem a posição (e a energia) dos elétrons nos
Número quântico principal: indica o nível (camada) de energia.
Número quântico secundário ou azimutal: indica o sub-nível de energia.
Número quântico magnético: indica o orbital.
Número quântico de spin: indica a orientação do elétron no orbital.
Dois elétrons nunca terão os quatro números quânticos iguais, pois mesmo que estejam no mesmo nível, no mesmo sub-nível e no mesmo orbital, terão spins opostos. Assim, qualquer par de elétrons pode ter até três números quânticos iguais.
- Número quântico principal, n
O número quântico principal terá como valores 1, 2, 3, 4…de acordo com o nível eletrônico que o elétron se encontra.
- Número quântico azimutal, l
O número quântico azimutal, informa-nos sobre a forma dos orbitais (s, p, d, f). Para um dado valor de n, l pode ter como valores possíveis os números inteiros de 0 a (n − 1). Para os sub-níveis s, p d, f, temos:
s = 0, p = 1 , d = 2 , f = 3
- Número quântico magnético, ml
O número quântico magnético especifica a orientação permitida para uma nuvem eletrônica no espaço, sendo que o número de orientações permitidas está diretamente relacionado à forma da nuvem (designada pelo valor de l). Dessa forma, este número quântico pode assumir valores inteiros de -l, passando por zero, até +l. Para os sub-níveis s, p d, f, temos:
| s | 0 | ||||||
| p | -1 | 0 | +1 | ||||
| d | -2 | -1 | 0 | +1 | +2 | ||
| f | -3 | -2 | -1 | 0 | +1 | +2 | +3 |
- Número quântico de spin, ms
O número quântico de spin indica a orientação do elétron ao redor do seu próprio eixo. Como existem apenas dois sentidos possíveis, este número quântico assume apenas os valores -1/2 e +1/2.
- Exemplos: Quais os nºs quânticos do último elétron (elétron diferencial, verificador) de cada átomo abaixo?
Al = 1s 2s 2p6 3s2 3p1
Logo os nºs quânticos são referentes ao elétron de 3p1:
n = 3 (terceiro nível)
l = 1 (sub-nível p)
ml = -1 (primeiro orbital p)
ms = -1/2 (rotação)
Fe = 1s22s22p63s23p64s23d6
Logo os nºs quânticos são referentes ao elétron de 3d6:
n = 3 (terceiro nível)
l = 2 (sub-nível d)
ml = -2 (primeiro orbital d)
ms = +1/2 (rotação)
Aula 18
Semana
Camada de valência.
A camada de valência é o nível mais afastado do núcleo de um átomo e pode ser determinada por meio de distribuição eletrônica ou pela tabela periódica.
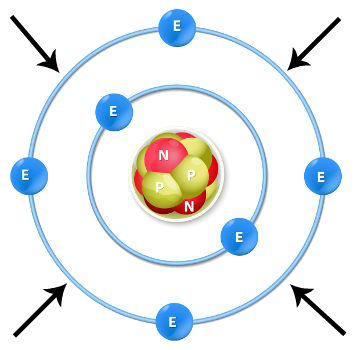
A camada de valência é a camada mais externa que um átomo pode apresentar, ou seja, é a camada mais distante do núcleo de um átomo. Uma das formas de determiná-la é por meio da distribuição eletrônica fundamental no diagrama de Linus Pauling. Como podemos observar no diagrama de Linus Pauling acima, um átomo apresenta sete níveis de energia (1 a 7). Quando realizamos a distribuição eletrônica, a camada de valência será sempre a última. Veja os exemplos a seguir:
Como podemos observar no diagrama de Linus Pauling acima, um átomo apresenta sete níveis de energia (1 a 7). Quando realizamos a distribuição eletrônica, a camada de valência será sempre a última. Veja os exemplos a seguir:
Exemplo 1: Átomo de sódio (11Na)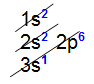 Analisando a distribuição eletrônica acima, é possível constatar que a camada de valência (o nível mais afastado do núcleo) é o terceiro nível e apresenta um elétron (no subnível s).Exemplo 2: Átomo de germânio (32Ge)
Analisando a distribuição eletrônica acima, é possível constatar que a camada de valência (o nível mais afastado do núcleo) é o terceiro nível e apresenta um elétron (no subnível s).Exemplo 2: Átomo de germânio (32Ge)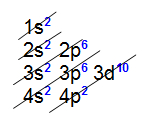 Analisando a distribuição acima, é possível constatar que a camada de valência (nível mais afastado do núcleo) é o quarto nível e possui quatro elétrons (nos subníveis s e p).Exemplo 3: Átomo de urânio (92U)
Analisando a distribuição acima, é possível constatar que a camada de valência (nível mais afastado do núcleo) é o quarto nível e possui quatro elétrons (nos subníveis s e p).Exemplo 3: Átomo de urânio (92U).jpg) Analisando a distribuição eletrônica do urânio, é possível constatar que a camada de valência é o sétimo nível e apresenta dois elétrons (no subnível s).
Analisando a distribuição eletrônica do urânio, é possível constatar que a camada de valência é o sétimo nível e apresenta dois elétrons (no subnível s).
Aula 22
Semana
Regra do Octeto
A Regra do Octeto estabelece que os átomos dos elementos ligam-se uns aos outros na tentativa de completar a sua camada de valência (última camada da eletrosfera). A denominação “regra do octeto” surgiu em razão da quantidade estabelecida de elétrons para a estabilidade de um elemento, ou seja, o átomo fica estável quando apresentar em sua camada de valência 8 elétrons.Para atingir tal estabilidade sugerida pela Regra do Octeto, cada elemento precisa ganhar ou perder (compartilhar) elétrons nas ligações químicas, dessa forma eles adquirem oito elétrons na camada de valência. Exemplo: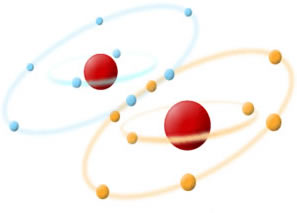 Repare que os átomos de Oxigênio se ligam para atingirem a estabilidade sugerida pela Regra do Octeto. As diferentes cores de eletrosfera mostradas na figura nos ajudam a interpretar o seguinte:1. Átomos de Oxigênio possuem seis elétrons na camada de valência (anel externo na figura).2. Para se tornarem estáveis precisam contar com 8 elétrons, o que fazem então? Compartilham dois elétrons (indicado na junção dos dois anéis), formando uma molécula de gás Oxigênio (O2).A justificativa para essa regra é que as moléculas ou íons tendem a ser mais estáveis quando a camada de elétrons externa de cada um dos seus átomos está preenchida com oito elétrons (configuração de um gás nobre). É por isso que os elementos tendem sempre a formar ligações na busca de tal estabilidade.Existem exceções para a Regra do Octeto, alguns compostos não precisam ter oito elétrons na camada de valência para atingir a estabilidade, vejamos quais:Berílio (Be)
Repare que os átomos de Oxigênio se ligam para atingirem a estabilidade sugerida pela Regra do Octeto. As diferentes cores de eletrosfera mostradas na figura nos ajudam a interpretar o seguinte:1. Átomos de Oxigênio possuem seis elétrons na camada de valência (anel externo na figura).2. Para se tornarem estáveis precisam contar com 8 elétrons, o que fazem então? Compartilham dois elétrons (indicado na junção dos dois anéis), formando uma molécula de gás Oxigênio (O2).A justificativa para essa regra é que as moléculas ou íons tendem a ser mais estáveis quando a camada de elétrons externa de cada um dos seus átomos está preenchida com oito elétrons (configuração de um gás nobre). É por isso que os elementos tendem sempre a formar ligações na busca de tal estabilidade.Existem exceções para a Regra do Octeto, alguns compostos não precisam ter oito elétrons na camada de valência para atingir a estabilidade, vejamos quais:Berílio (Be)
Átomo capaz de formar compostos com duas ligações simples, sendo assim, estabiliza-se com apenas quatro elétrons na camada de valência.Boro (B)
Forma substâncias moleculares com três ligações simples, ficando estável com seis elétrons na última camada.Alumínio (Al)
É uma exceção à Regra do Octeto pelos mesmos motivos que o Boro, atinge a estabilidade com seis elétrons na camada de valência.
Aula 23
Semana
Ligação Iônica
Ligação iônica é uma interação entre átomos na qual ocorre a perda e o ganho de elétrons, resultando em compostos com características e fórmulas bem particulares.

O cloreto de sódio é um exemplo de composto formado a partir de ligação iônica entre os átomosLigação iônica é o nome dado a uma das três formas como os átomos podem interagir entre si. As outras formas de interação entre átomos são a ligação covalente, que ocorre entre átomos de ametais, hidrogênios, ou ametal e hidrogênio, e a ligação metálica, a qual acontece somente entre átomos de um mesmo metal.Os átomos dos elementos químicos que participam da ligação iônica devem apresentar, obrigatoriamente, a natureza de ganhar ou perder elétrons, assim, a ligação iônica pode ocorrer entre:
- um metal e um ametal;
- um metal e o hidrogênio.
As fórmulas dos compostos formados a partir de ligação iônica sempre apresentam um padrão YX, em que o Y sempre será o elemento metálico.Dessa forma, para identificar um composto iônico, basta verificar se a fórmula inicia com um elemento metálico.Princípio da ligação iônica Para um melhor entendimento de como ocorre uma ligação iônica, vamos utilizar a substância iônica mais conhecida entre nós, o cloreto de sódio (NaCl).Nesse composto iônico, estão os elementos:
- Sódio: elemento metálico, pois possui característica de perder elétron; pertencente à família IA, de número atômico 11, com um elétron na camada de valência, como podemos observar na distribuição eletrônica abaixo:
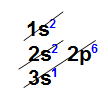 Distribuição eletrônica do elemento sódio A perda de elétron ocorre com relação aos elétrons que estão na camada de valência, logo, o átomo de sódio perde apenas um elétron. Com isso, ele passa a ter uma nova camada de valência, a segunda, que contém oito elétrons (obedecendo, assim, a regra do octeto).
Distribuição eletrônica do elemento sódio A perda de elétron ocorre com relação aos elétrons que estão na camada de valência, logo, o átomo de sódio perde apenas um elétron. Com isso, ele passa a ter uma nova camada de valência, a segunda, que contém oito elétrons (obedecendo, assim, a regra do octeto).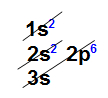 Nova camada de valência do elemento sódio
Nova camada de valência do elemento sódio
- Cloro: elemento ametálico, pois possui característica de ganhar elétron; pertencente à família VIIA, de número atômico 17, com sete elétrons na camada de valência, como podemos observar na distribuição eletrônica abaixo:
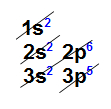 Distribuição eletrônica do elemento cloroO ganho de elétron ocorre na camada de valência, dessa forma, o átomo de cloro ganha um elétron, pois falta apenas um para atingir a regra do octeto. Com isso, ele passa a ter oito elétrons na sua camada de valência.
Distribuição eletrônica do elemento cloroO ganho de elétron ocorre na camada de valência, dessa forma, o átomo de cloro ganha um elétron, pois falta apenas um para atingir a regra do octeto. Com isso, ele passa a ter oito elétrons na sua camada de valência. Nova camada de valência do elemento cloro
Nova camada de valência do elemento cloro
Obs.: Assim, de uma forma geral, seguindo a regra do octeto, na ligação iônica, o metal, ao perder seus elétrons na camada de valência, torna-se estável, pois passará a ter uma nova camada de valência com dois (desde que seja no primeiro nível) ou oito elétrons.Com os ametais ou o hidrogênio não é diferente, pois, ao ganhar elétrons, passarão a ter dois ou oito elétrons na camada de valência.
Construção das fórmulas químicas dos compostos formados por ligação iônicaPara construir a fórmula de uma substância formada a partir da ligação iônica, devemos obedecer o seguinte padrão:
- Determinar a carga do cátion;
- Determinar a carga do ânion;
- Cruzar as cargas, de forma que a carga do cátion seja o índice atômico (número à direita da sigla) do ânion, e vice-versa.
1º Exemplo: Fórmula com os elementos alumínio e bromo.
- Alumínio: é um metal, por isso, tem a tendência de perder elétron; da família IIIA, pois possui três elétrons na camada de valência, logo, sua carga é +3;
- Bromo: é um ametal, por isso, tem a tendência de ganhar elétron; da família VIIA, pois possui sete elétrons na camada de valência, logo, sua carga é -1;
- O número 3, referente à carga do alumínio, será o índice do bromo, e o número 1, referente à carga do bromo, será o índice do alumínio.
Como a carga do alumínio é +3 e a do bromo é -1, assim, a fórmula do composto iônico será AlBr3.2º Exemplo: Fórmula com os elementos magnésio e hidrogênio.
- Magnésio é um metal, por isso, tem a tendência de perder elétron; da família IIA, pois possui dois elétrons na camada de valência, portanto, sua carga é +2;
- Hidrogênio: não é ametal, porém, quando próximo a um metal, apresenta a tendência de ganhar elétron; não pertence a nenhuma família, pois possui um elétron na camada de valência. Assim, sua carga é -1;
- O número 2, referente à carga do magnésio, será o índice do hidrogênio, e o número 1, referente à carga do hidrogênio, será o índice do magnésio.
Como a carga do magnésio é +2 e a do hidrogênio é -1, logo, a fórmula do composto iônico será MgH2.
Características dos compostos químicos formados por ligação iônica
De uma forma geral, os compostos iônicos, isto é, substâncias formadas mediante ligação iônica, apresentam as seguintes características:
- São sólidos à temperatura ambiente;
- Seus átomos organizam-se de uma maneira a produzir um retículo cristalino (um cristal).
Obs.: Nos compostos iônicos, os átomos aglomeram-se de forma a ocupar os vértices de estruturas cristalinas. No cloreto de sódio, por exemplo, um ânion cloreto (esfera roxa) interage ao mesmo tempo com seis cátions sódio (esferas verdes):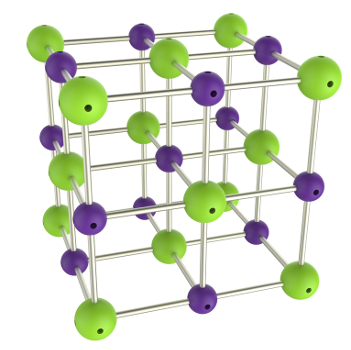 Representação da estrutura cristalina do cloreto de sódio
Representação da estrutura cristalina do cloreto de sódio
- São solúveis em água;
- São capazes de realizar o fenômeno da dissociação (liberação de íons) quando sofrem fusão, ou seja, quando passam do estado sólido para o estado líquido, ou quando estão dissolvidos em água;
- Apresentam elevados pontos de fusão e de ebulição;
- Possuem brilho;
- Conduzem corrente quando dissolvidos em água ou após sofrerem o processo de fusão.
Exercícios Sobre Ligações Iônicas. Ligações Iônicas
As ligações iônicas são formadas pela atração eletrostática entre íons de cargas opostas, cátions e ânions, com a transferência definitiva de elétrons.
Questão 1
-
-
Dos compostos abaixo, qual não realiza ligação iônica?
a) NaCl
b) Mg(Cl)2
c) CaO
d) HCl
e) Na2O
-
-
- Questão 2
Considere os seguintes elementos químicos e as suas respectivas famílias ou grupos na Tabela Periódica:
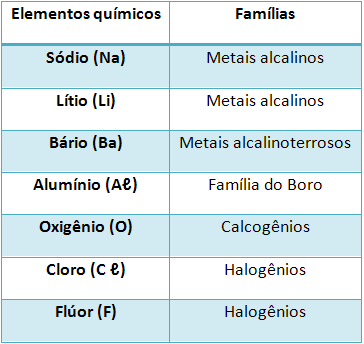
Alguns elementos químicos e suas respectivas famíliasAlguns desses elementos realizam ligações iônicas entre si, formando compostos. Indique qual das fórmulas unitárias dos compostos formados a seguir está incorreta:
a) Al3O2
b) NaCl
c) Li2O
d) MgCl2
e) AlF3
- Questão 2
-
- Questão 3
(UEL-PR) Da combinação química entre os átomos de magnésio (Z=12) e nitrogênio (Z=7) pode resultar a substância de fórmula:
a) Mg3N2
b) Mg2N3
c) MgN3
d) MgN2
e) MgNQuestão 4
(FATEC-SP) A propriedade que pode ser atribuída à maioria dos compostos iônicos (isto é, aos compostos caracterizados predominantemente por ligações iônicas entre as partículas) é:
a) dissolvidos em água, formam soluções ácidas.
b) dissolvem-se bem em gasolina, diminuindo sua octanagem.
c) fundidos (isto é, no estado líquido), conduzem corrente elétrica.
d) possuem baixos pontos de fusão e ebulição.
e) são moles, quebradiços e cristalinos.
- Questão 3
Respostas
-
- Resposta Questão 1
Alternativa “d”.
a) O sódio doa um elétron para o cloro: Na+ + Cl– → NaCl;
b) O magnésio doa dois elétrons para dois átomos de cloro: Mg2+ + Cl– → Mg(Cl)2;
c) Cada cálcio doa um elétron para cada oxigênio: Ca2+ + O2- → CaO;
d) Nesse caso, tanto o hidrogênio quanto o cloro precisam receber um elétron cada um para ficarem estáveis. Assim, realiza-se uma ligação covalente, em que eles compartilham um par de elétrons → HCl;
e) Dois átomos de sódio doam um elétron cada um para um átomo de oxigênio: Na+ + O2- → Na2O.
- Resposta Questão 1
-
- Resposta Questão 2
Alternativa “a”.
O “Al” é da família do boro ou 3, o que significa que ele possui 3 elétrons na camada de valência, precisando doá-los para ficar estável. Assim, ele forma o cátion Al3+. Já o “O” é da família dos calcogênios ou 16, ou seja, possui 6 elétrons na camada de valência e precisa receber mais dois elétrons para ficar estável. Portanto, ele forma o ânion: O2-.
Desse modo, são necessários dois átomos de Al para estabilizar três átomos de O, sendo doados, no total, seis elétrons para os átomos de oxigênio: Al2O3.
Uma forma mais simples é apenas trocar os números das cargas, como é mostrado abaixo:
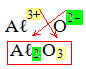
Fórmula de ligação iônicaResposta Questão 3
Alternativa “a”.
Visto que o número atômico do magnésio é 12, realizando a sua distribuição eletrônica (2-8-2), vemos que ele é da família 2 e possui 2 elétrons na camada de valência, formando o cátion bivalente: Mg2+. Enquanto isso, o nitrogênio tem a seguinte distribuição eletrônica: 2-5, ou seja, possui 5 elétrons na camada de valência, sendo da família 15 e precisando receber mais 3 elétrons para ficar estável. Por isso, ele forma o ânion trivalente: N3-.
Desse modo, a fórmula unitária do composto será:
Mg2+ + N3- → Mg3N2
voltar a questão
- Resposta Questão 2
- Resposta Questão 4
Alternativa ‘c’.
Os compostos iônicos na fase líquida (fundidos) conduzem corrente elétrica porque os íons ficam livres (cátions e ânions separados). Na fase sólida, não conduzem porque os íons estão firmemente ligados uns aos outros.
voltar a questão
Aula 24
semana
Ligação CovalenteA ligação covalente é um tipo de ligação química realizada entre os átomos de hidrogênio, ametais e semimetais que compartilham entre si pares de elétrons.
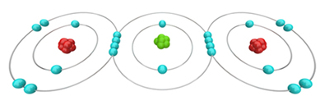
O dióxido de carbono é formado por ligações covalentes entre o carbono e dois átomos de oxigênio
A ligação covalente é um tipo de ligação química que ocorre com o compartilhamento de pares de elétrons entre átomos que podem ser o hidrogênio, ametais ou semimetais.
Segundo a teoria ou regra do octeto, os átomos dos elementos ficam estáveis quando atingem a configuração eletrônica de um gás nobre, ou seja, quando eles possuem oito elétrons em sua camada de valência (camada mais externa) ou dois elétrons — no caso de possuírem somente a camada eletrônica K.
Assim, seguindo essa regra, os átomos dos elementos mencionados possuem a tendência de ganhar elétrons para alcançarem a estabilidade.
Por exemplo, o hidrogênio no estado fundamental possui somente um elétron na sua camada eletrônica; assim, para ficar estável, ele precisar receber mais um elétron de outro átomo.
Se tivermos dois átomos de hidrogênio, ambos precisarão receber um elétron cada.Por isso, em vez de transferirem elétrons (como ocorre na ligação iônica), eles farão uma ligação covalente em que compartilharão um par de elétrons.Desse modo, ambos ficarão com dois elétrons, adquirindo a estabilidade: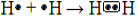
Ligação covalente de formação do gás hidrogênioEssa forma de representar as ligações químicas, em que os elétrons da camada de valência são colocados ao redor do símbolo do elemento como “pontinhos”, é chamada de fórmula eletrônica de Lewis.Nela, cada par de elétrons compartilhado em uma ligação covalente é representado por um “enlaçamento” entre os dois pontinhos.Existe outra forma de representar as ligações covalentes, que é por meio da fórmula estrutural.Nessa fórmula, cada par compartilhado é representado por um traço.Veja:
Representação das ligações covalentes em fórmulas estruturais.Assim, a ligação que forma o gás hidrogênio é representada da seguinte forma:H─H.E sua fórmula molecular é H2.Visto que o hidrogênio é capaz de realizar somente uma ligação covalente, dizemos que ele é monovalente.Veja na tabela a seguir a quantidade de ligações covalentes que os principais ametais e semimetais podem realizar: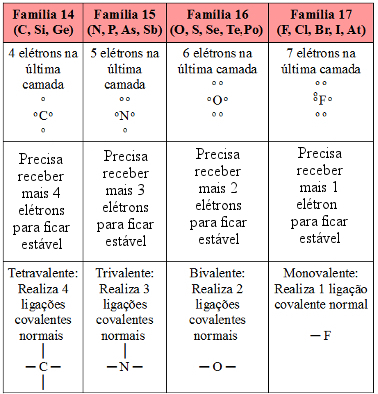
Possibilidades de realização de ligação covalente dos ametais e semimetais principais da Tabela Periódica.Com base nisso, consideremos agora a molécula de dióxido de carbono (CO2).
O carbono, que pertence à família 14, possui quatro elétrons na última camada, como mostrado na tabela, e precisa fazer quatro ligações covalentes para ficar estável.Já o oxigênio é da família 16, possui seis elétrons na camada de valência e precisa realizar duas ligações.
Desse modo, o carbono compartilha dois pares de elétrons ou faz duas ligações duplas com cada átomo de oxigênio.
Veja como ficam as fórmulas eletrônica e estrutural, respectivamente, do dióxido de carbono:Fórmula eletrônica e estrutural do dióxido de carbono 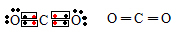
Exemplos de ligações covalentes (fórmulas eletrônicas)Veja mais exemplos a seguir:
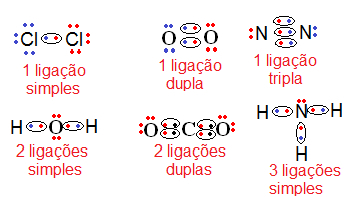
Exercícios Sobre Ligações Covalentes
As ligações covalentes são aquelas em que os átomos dos elementos que precisam receber elétrons para ficar estáveis realizam um compartilhamento por pares de elétrons.Questão 1Abaixo temos as fórmulas de Lewis para átomos de cinco elementos químicos.
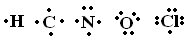 Fórmulas eletrônicas de Lewis para alguns elementos Podemos afirmar que a única estrutura que não se forma é:
Fórmulas eletrônicas de Lewis para alguns elementos Podemos afirmar que a única estrutura que não se forma é:a) HCl
b) Cl2
c) H2O
d) NH3
e) HC4
.jpg)
Fórmulas eletrônica e estrutural do metano
Questão 2
8B: 2 – 6
Representação da fórmula eletrônica de Lewis de uma molécula genéricaPortanto, a fórmula molecular nesse caso é: AB2.
.jpg)
|
C
//
O Cl
Questão 4
Formação do íon hidrônio
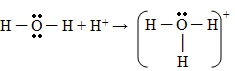
Ligação covalente dativa
A ligação covalente dativa ocorre quando um átomo transfere elétrons, essa transferência é indicada pelo vetor (seta).
Ligação covalente dativa ocorre quando um átomo compartilha seus elétrons. Essa ligação obedece à Teoria do Octeto, onde os átomos se unem tentando adquirir oito elétrons na camada de valência para atingir a estabilidade eletrônica.Exemplo: formação de dióxido de enxofre (SO2)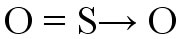 O átomo de enxofre (S) adquire seu octeto através da ligação com o oxigênio localizado à esquerda (ligação dupla coordenada). O oxigênio à direita necessita de elétrons para completar a camada de valência, e então o enxofre doa um par de elétrons para esse oxigênio. Essa transferência de elétrons é indicada pelo vetor (seta) e corresponde à ligação covalente dativa.Vejamos o compartilhamento de elétrons na formação do composto Sulfato, onde um átomo central de enxofre estabelece ligações covalentes com quatro átomos de oxigênio.
O átomo de enxofre (S) adquire seu octeto através da ligação com o oxigênio localizado à esquerda (ligação dupla coordenada). O oxigênio à direita necessita de elétrons para completar a camada de valência, e então o enxofre doa um par de elétrons para esse oxigênio. Essa transferência de elétrons é indicada pelo vetor (seta) e corresponde à ligação covalente dativa.Vejamos o compartilhamento de elétrons na formação do composto Sulfato, onde um átomo central de enxofre estabelece ligações covalentes com quatro átomos de oxigênio.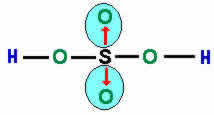 As setas vermelhas indicam as ligações dativas e os traços indicam o compartilhamento de elétrons. Na ligação dativa, o átomo de enxofre “doa” um par de elétrons para cada átomo de oxigênio, estes, por sua vez, atingem a estabilidade eletrônica.
As setas vermelhas indicam as ligações dativas e os traços indicam o compartilhamento de elétrons. Na ligação dativa, o átomo de enxofre “doa” um par de elétrons para cada átomo de oxigênio, estes, por sua vez, atingem a estabilidade eletrônica.
24ª semana
ligação metálica?O que é ligação metálica? Trata-se da forma como os átomos de um elemento metálico interagem entre si, o que origina diversas propriedades importantes, como a maleabilidade e a ductibilidade.

O metal ouro é constituído a partir de ligações metálicas
Os metais são elementos químicos que apresentam como principal característica física a capacidade de perder elétrons e, consequentemente, formar cátions metálicos. Por essa razão, eles podem realizar dois tipos de ligações químicas: a ligação iônica e a ligação metálica.A ligação iônica ocorre quando um metal interage com um elemento de natureza ametálica, que pode ser um ametal ou o hidrogênio. Nesse tipo de ligação, temos a perda de elétrons por parte dos metais e o ganho de elétrons por parte dos ametais ou do hidrogênio.Já a ligação metálica é estabelecida entre os átomos de um único elemento metálico. Esse tipo de ligação ocorre apenas entre os átomos de um único metal e exclusivamente porque um metal não pode estabelecer ligação química com outro elemento metálico diferente.Características gerais dos metais
- Sólidos em temperatura ambiente, com exceção do mercúrio
- São brilhantes;
- Apresentam elevados pontos de fusão e de ebulição;
- Apresentam, em geral, cor prateada, com exceção do ouro, que é dourado, e do cobre, que é avermelhado;
- Os metais puros são formados por aglomerados de átomos (de um único elemento químico) denominados de retículos cristalinos.
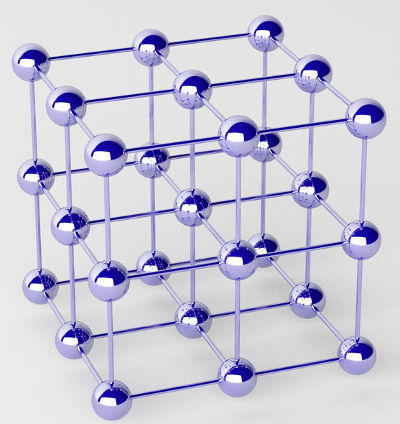
Representação do retículo cristalino de um metalPrincípios da ligação metálicaNa ligação metálica, os retículos cristalinos que formam os metais são, na verdade, um aglomerado iônico (composto apenas por cátions e elétrons). Os elétrons presentes na camada de valência dos átomos do metal são deslocalizados, ou seja, saem da camada de valência, fazendo com que o átomo se torne um cátion (deficiente em elétrons).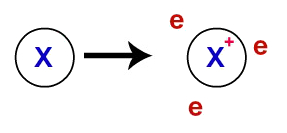
Representação dos elétrons deslocalizados da camada de valênciaApós serem deslocalizados, os elétrons provenientes dos átomos do metal passam a rodear os cátions, formando um verdadeiro “mar de elétrons”. Cada um dos elétrons presentes nesse mar possui capacidade de mover-se por meio do retículo cristalino do metal livremente.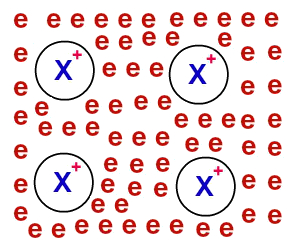
Representação do modelo do mar de elétronsOBS.: Os elétrons “do mar” não são capazes de abandonar o retículo cristalino e movimentam-se por ele.Propriedades dos metais justificadas pela ligação metálicaa) MaleabilidadePor meio de um metal, é possível produzir chapas de diversas espessuras e lâminas. É graças a essa propriedade dos metais que podemos construir diversos objetos, como facas, espadas etc.
A lâmina de uma espada é feita a partir de um metalb) CondutibilidadeOs metais, de uma forma geral, são bons condutores de corrente elétrica e calor. Quando um metal qualquer está em contato com uma fonte de calor ou com uma fonte de corrente elétrica, ele é capaz de conduzi-los.
Uma panela de alumínio na chama de um fogão fica inteiramente quente em virtude da condutividadec) DuctibilidadePor meio de um metal, podemos produzir fios. A utilização de um metal na forma de fios facilita a sua utilização, principalmente em relação à condutibilidade elétrica.
Um metal, como o cobre, pode ser utilizado para a produção de fios
Ligação Metálica

As propriedades de uma ligação são diferentes das propriedades dos seus elementos constituintes. Os metais quando analisados separadamente possuem características únicas que os diferem das demais substâncias: eles são sólidos à temperatura ambiente (25°C) e apresentam cor prateada.
A estrutura atômica dos metais é a Cristalina, que se constitui por cátions do metal envolvidos por uma nuvem de elétrons.
A capacidade que os metais têm de conduzir eletricidade se explica pela presença dessa nuvem de elétrons, que conduz corrente elétrica nos fios de eletricidade, não só neles, mas em qualquer objeto metálico.
As ligas metálicas possuem algumas particularidades que os metais puros não apresentam. Justamente por isso, são produzidas e utilizadas em abundância.
Vejamos as propriedades das ligações metálicas Aumento da dureza: se pegarmos, por exemplo, o elemento Ouro (Au) da forma como é encontrado na natureza não conseguiríamos fabricar nenhum objeto consistente, pois ele é mais maleável que a grande maioria dos metais.
Mas se adicionarmos a ele a prata (Ag) e o cobre (Cu) formaremos uma ligação metálica, aumentando a dureza e permitindo sua utilização para fabricar joias, como anéis, pulseiras, relógios, etc.
Essa liga metálica é também conhecida por Ouro 18 quilates e apresenta 75% em massa de ouro e os outros 25% correspondem à prata e ao cobre.Aumento da resistência mecânica: para fabricar materiais que tenham maior resistência ao manuseio, é preciso recorrer à ligação entre os metais.
O aço, por exemplo, é formado por ferro (Fe) e carbono (C).
Essa liga fica tão resistente que é usada na fabricação de peças metálicas que sofrem tração elevada.
Exemplos:Aço cirúrgico: é usado para a obtenção de instrumentos cirúrgicos, por apresentar alta resistência à oxidação.Aço inox: é uma liga dos metais ferro (Fe), carbono (C), cromo (Cr) e níquel (Ni); é usada para fabricar talheres para cozinha, peças de carro, etc.


