Polaridade das moléculas
Ao estudar a polaridade das moléculas, isto é, se elas são polares ou apolares, entendemos melhor a solubilidade e as forças intermoleculares.
A polaridade das moléculas, ou polaridade de íon-fórmula, é uma propriedade física determinante na compreensão da solubilidade de um material em outro ou na compreensão de como suas moléculas interagem (forças intermoleculares) umas com as outras.De forma mais simples, determinar a polaridade de uma molécula é identificar se ela apresenta polos negativos e positivos (molécula polar) ou não (molécula apolar). Para isso, é necessário conhecer o tipo de ligação que forma a substância:Ligação iônica
Toda substância que é originada por ligações iônicas automaticamente já é caracterizada como sendo polar. Isso porque sua formação provém da interação entre cátions e ânions, logo, apresenta polo positivo e negativo.
OBS.: Vale ressaltar que substâncias iônicas não são compostas por moléculas, mas, sim, por íons-fórmula.
Quando a substância é formada por ligações covalentes, podemos utilizar duas formas:
- Relação entre o número de nuvens eletrônicas no átomo central da molécula e os átomos (tipos de elementos) ligados a ele;
- Soma dos vetores momento dipolar presentes entre o átomo central e os átomos ligados a ele, levando em consideração a geometria molecular. Nesse caso, é fundamental conhecer a ordem decrescente de eletronegatividade, já que o vetor indica qual átomo está atraindo os elétrons da ligação com o outro.
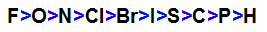
Ordem decrescente de eletronegatividade
Determinação da polaridade das moléculas a partir do número de nuvens e átomos iguais
a) Molécula polar:
Uma molécula é polar quando o número de nuvens eletrônicas no átomo central é diferente do número de átomos (do mesmo elemento químico) ligados a esse átomo.
Exemplos:
→ Molécula de água (H2O)
.jpg)
Fórmula estrutural da água
O oxigênio apresenta seis elétrons na camada de valência e utiliza esses elétrons em cada uma das ligações simples com os átomos de hidrogênio. Logo, sobram quatro elétrons não ligantes no oxigênio, os quais formam duas nuvens eletrônicas (par de elétrons).
Como a molécula de água apresenta no seu átomo central 4 nuvens eletrônicas e há 2 átomos do mesmo elemento (hidrogênio) ligados a ele, ela é polar.
→ Molécula de triclorometano (CHCl3)
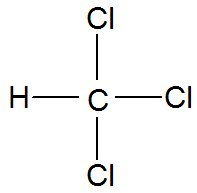
Fórmula estrutural do triclorometano
O carbono apresenta quatro elétrons na camada de valência e utiliza esses elétrons em cada uma das ligações simples com os átomos de cloro e com o átomo de hidrogênio, não sobrando elétrons não ligantes no átomo central (carbono).
Como a molécula de triclorometano apresenta no seu átomo central 4 nuvens eletrônicas (4 ligações simples) e 3 átomos do mesmo elemento (cloro) ligados a ele, ela é polar.
b) Molécula apolar
Uma molécula é apolar quando o número de nuvens eletrônicas no átomo central é igual ao número de átomos (do mesmo elemento químico) ligados a esse átomo.
Exemplos:
→ Molécula de gás carbônico (CO2)
.jpg)
Fórmula estrutural do gás carbônico
O carbono apresenta quatro elétrons na camada de valência e utiliza dois desses elétrons em cada uma das ligações duplas com os átomos de oxigênio, não sobrando elétrons não ligantes no átomo central (carbono).
Como a molécula de gás carbônico apresenta no seu átomo central 2 nuvens eletrônicas (2 ligações duplas) e 2 átomos do mesmo elemento (oxigênio) ligados a ele, ela é apolar.
→ Molécula de gás trióxido de enxofre (SO3)
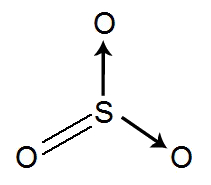
Fórmula estrutural do trióxido de enxofre
O enxofre apresenta seis elétrons na camada de valência e utiliza dois desses elétrons na ligação dativa e na dupla com o oxigênio, não sobrando elétrons não ligantes no átomo central (oxigênio).a molécula de trióxido de enxofre apresenta no seu átomo central 3 nuvens eletrônicas (2 ligações dativas e uma ligação dupla) e 3 átomos do mesmo elemento (oxigênio) ligados a ele, ela é apolar.
Determinação da polaridade das moléculas pelo vetor momento dipolar
Podemos determinar a polaridade de uma molécula utilizando a soma dos vetores momento dipolar (μR). Um vetor momento dipolar é uma seta que indica para qual átomo os elétrons de uma ligação estão deslocando-se (eletronegatividade).
- Quando a soma vetorial é zero, molécula apolar.
μR= o
- Quando a soma vetorial é diferente de zero, molécula polar.
μR≠ O
Exemplos:
.jpg)
Fórmula estrutural do ácido clorídrico
O HCl é uma molécula de geometria linear, e o átomo de cloro é mais eletronegativo que o átomo de hidrogênio, logo, os elétrons da ligação entre eles tendem a se aproximar do cloro, criando nele um polo negativo e, no hidrogênio, um polo positivo. Como temos somente um vetor na molécula linear, a soma vetorial é diferente de zero (μR ≠ O) e, por isso, a molécula é polar.
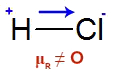
Fórmula estrutural do ácido clorídrico com vetor e polos
OBS.: Se a soma vetorial de uma molécula for igual a zero (μR = O), ela será apolar.
Veja mais exemplos:
→ Molécula de água
Na molécula de água, temos duas ligações entre o oxigênio e os hidrogênios. Como o oxigênio é mais eletronegativo que o hidrogênio, o vetor momento dipolar é direcionado para ele. Assim, temos dois vetores (setas azuis) na estrutura da água:
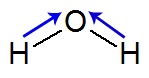
Fórmula estrutural da água com vetores
A geometria molecular da água é angular e, por isso, os vetores são posicionados na diagonal. Assim sendo, devemos fazer a decomposição desses dois vetores utilizando a regra do paralelogramo. Vamos formar um losango com os vetores, surgindo, assim, um único vetor resultante (seta vermelha) voltado para o átomo de oxigênio.
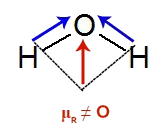
Formação do vetor resultante na molécula de água
Temos somente um vetor na molécula de água, logo, a soma vetorial é diferente de zero (μR ≠ O) e, por isso, a molécula é polar.
→ Molécula de gás metano
Na molécula de metano, temos quatro ligações entre o carbono e os hidrogênios. Como o carbono é mais eletronegativo que o hidrogênio, o vetor momento dipolar é direcionado a ele. Assim, temos quatro vetores (setas azuis) na estrutura do metano:
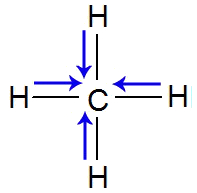
Fórmula estrutural do gás metano com vetores
A geometria molecular do metano é tetraédrica e, por isso, os vetores são posicionados na vertical (dois) e na horizontal (dois). Os vetores na vertical estão na mesma direção, mas em sentidos opostos, logo, eles se anulam. O mesmo ocorre com os vetores da horizontal (mesma direção e sentidos opostos). Assim, a soma vetorial é igual a zero (μR = O) e a molécula é apolar.
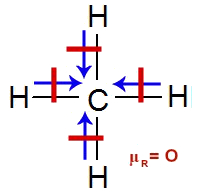
Anulação dos vetores na molécula do metano
A amônia é um exemplo de molécula polar
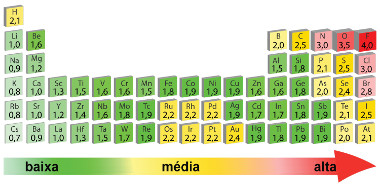
Esse mesmo texto mostra que Linus Pauling criou uma escala dos elementos mais eletronegativos, que pode ser de ajuda para determinar a intensidade da polarização de diferentes ligações:
F > O > N > C? > Br > I > S > C > P > H
Valores das eletronegatividades: 4,0 > 3,5 > 3,0 > 3,0 > 2,8 > 2,5 > 2,5 > 2,5 < 2,1
Existe um “macete” para lembrar a fila de eletronegatividade, basta dizer a seguinte frase: “Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital”. A inicial de cada palavra corresponde ao símbolo dos elementos em questão.