A água é uma substância que possui inúmeras propriedades físico-químicas próprias interessantes que beneficiam muito a vida, dentre elas a adesão e coesão, capilaridade e a tensão superficial. Podemos dizer que, sem água, a vida não existiria! Existem forças de atração intermolecular devido a alta tensão superficial da água e baixa interação com a superfície. Na água liquida temos interações intermoleculares fortes, as ligações de hidrogênio. Isso faz com que a água possui uma alta tensão superficial. Ao colocarmos água sobre uma superfície, caso ela interaja com a mesma, ela irá se espalhar formando um filme fino. Todavia, quando a água não interage com a superfície, há formação de gotas, devido a alta tensão superficial, caso que observamos ao derrubarmos água no chão.Quando derrubamos água no chão ela fica unida em aglomeradas.
Como se formam as bolhas de sabão?

Existem forças de atração intermolecular que mantêm as bolhas de sabão
Crianças e até mesmo adultos em todo o mundo gostam de brincar com bolhas de sabão. Mas, você já se perguntou o que será que as formam? O que mantém suas moléculas unidas? Por que elas sempre são esféricas? Como fazer para conseguir bolhas de sabão mais resistentes?As respostas para todas essas perguntas se baseiam no tipo de força intermolecular existente entre as moléculas de água: a ligação de hidrogênio. Essas ligações ocorrem na água pela atração do polo positivo de uma molécula (hidrogênio) com o polo negativo de outra (oxigênio).
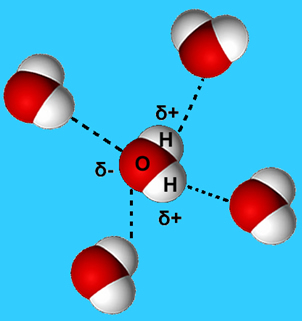
Essas interações ocorrem em todas as direções, no entanto, elas se tornam ainda mais intensas na superfície da água, pois como não existem moléculas na parte de cima, somente dos lados e abaixo, a desigualdade de atrações provoca a contração do líquido, dando a impressão de existir uma fina película na sua superfície. Esse fenômeno é chamado de tensão superficial. As bolhas se formam graças à intensidade dessa tensão superficial. As moléculas de água que estão na superfície da bolha realizam ligações de hidrogênio somente com moléculas ao seu lado, aumentando ainda mais a força dessa ligação. Para diminuir essa superfície ao mínimo, a bolha adquire um formato com a menor relação entre área superficial e volume, que é a forma esférica.

As moléculas do detergente se interpõem às moléculas de água. A elasticidade é resultante da interação entre as moléculas de água restantes. No entanto, elas acabam por evaporar e, como consequência, a bolha estoura.Mas, se você quiser aumentar a resistência das bolhas de sabão, basta acrescentar qualquer produto formado por substâncias que contenham o grupo OH em suas moléculas. Dessa forma, se estabelecerá ligações de hidrogênio com a água e ela permanecerá por mais tempo no estado líquido. Exemplos de substâncias assim são o açúcar (sacarose), a glicerina, a glicose e a frutose. Algo que dá certo é adicionar xarope de milho à mistura de água e detergente, porque ele é constituído basicamente de 20% de glicose e 80 % de frutose.

A tensão superficial é a força com que as moléculas de água estão ligadas uma a outra formando uma superfície e essa superfície tem uma resistência que permite que insetos, por exemplo, andem por cima da água. A tensão superficial da água é resultado das ligações de hidrogênio, ou seja, é resultado de forças intermoleculares causadas pela atração dos hidrogênios de determinadas moléculas de água com os oxigênios das moléculas de água vizinhas (Figura 1). Contudo, esta atração das moléculas é diferente no interior do líquido, sendo a força de atração das moléculas encontradas na superfície da água maior que a força de atração das moléculas abaixo da superfície.
As moléculas da água são atraídas entre si através das ligações de Hidrogênio. Essas ligações permitem que os insetos fiquem sobre a água.As moléculas abaixo da superfície são atraídas e atraem outras moléculas de água em todas as direções: para cima, para baixo, para a esquerda, para a direita, para frente e para trás, isto é, se atraem mutuamente com a mesma força. Já as moléculas da superfície estão em contato com o ar e, portanto, não há moléculas acima delas, restringindo suas ligações de hidrogênio às moléculas ao lado e abaixo. Essa desigualdade de atrações na superfície cria uma força sobre essas moléculas e provoca a contração do líquido, causando a chamada tensão superficial, que funciona como uma fina película na superfície da água. A tensão superficial da água nos explica a forma esférica das gotas de água, o fato de alguns insetos serem capazes de pousar ou “andar” sobre a água (Figura 1) e o fato de alguns objetos pequenos e leves não se afundarem se colocados com cuidado e na horizontal.
Material necessário
- Detergente
- Água
- Purpurina
- Recipiente Transparente grande
Passo-a-passo
1º Coloque a água em um recipiente transparente para melhor visualização do experimento;
2º Coloque a purpurina aos poucos;
3º Pingue o detergente no lugar onde há maior quantidade de purpurina.Neste experimento, os alunos poderão ver o detergente quebrando a tensão superficial da água pelo movimento da purpurina, que é menos densa do que a água (1). Além de explorar a tensão superficial da água, o professor pode explorar a presença da química em várias atividades do cotidiano do aluno. Explique a finalidade do detergente, como ele atua e sua composição química.
Referência
1. Medeiros RVB, Resende RR. ESTUDANDO A SOLUBILIDADE E A DENSIDADE DE LÍQUIDOS E OBJETOS. Nanocell News. 2015 02/19/2015;2(7). Epub 02/19/2015.
2. Maia, SRR. et. al. MANUAL DE AULAS PRÁTICAS DE UM LABORATÓRIO DE QUÍMICA COM MATERIAIS ALTERNATIVOS. Subprojeto PIBID/Química/FAEC-UECE, 2013.
Por que o gelo cola nas mãos?
Porque ele acaba congelando a própria umidade da mão de quem o segura, unindo-se a ela. Tanto as moléculas da água do gelo, quanto as contidas na umidade natural da mão, ficam mais próximas umas das outras, chegando a aderir
– mas apenas por alguns segundos. Se você for agora ao congelador para conferir, saiba que terá mais sucesso com os cubos de gelo do freezer
– que ficam a cerca de 20ºC negativos – do que com os de um congelador normal, com apenas um ou dois graus negativos. Afinal, quanto maior o frio, maior a aderência. Claro que não é só com cubos de gelo que isso acontece. Afinal, quem já não viu, em algum daqueles filmes de comédia pastelão, um sujeito prender a língua num daqueles postes cobertos de gelo, ocorrência comum em países de inverno mais rigoroso? “No caso da língua, a adesão é ainda maior, porque ela tem muito mais umidade que a mão”, diz o físico Mikiya Muramatsu, da Universidade de São Paulo (USP).



