Postulados da teoria atômica de Dalton
A teoria atômica de Dalton foi baseada em experimentos, mas nenhum desses experimentos conseguiu revelar o átomo claramente. Por isso, Dalton denominava o átomo como a menor parte da matéria.
A teoria de Dalton apresenta muito mais postulados do que comprovações. Veja alguns deles:
- Os átomos são maciços e apresentam forma esférica (semelhantes a uma bola de bilhar);
- Os átomos são indivisíveis;
- Os átomos são indestrutíveis;
- Um elemento químico é um conjunto de átomos com as mesmas propriedades (tamanho e massa);
- Os átomos de diferentes elementos químicos apresentam propriedades diferentes uns dos outros;
- O peso relativo de dois átomos pode ser utilizado para diferenciá-los;
- Uma substância química composta é formada pela mesma combinação de diferentes tipos de átomos;
- Substâncias químicas diferentes são formadas pela combinação de átomos diferentes.
Representações do modelo atômico de Dalton
Dalton representava os átomos dos elementos conhecidos em sua época por meio de símbolos esféricos.
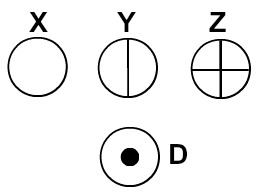
Átomos representados segundo a teoria atômica de Dalton
Cada representação atômica que apresenta um detalhe específico indica um elemento químico diferente. Didaticamente os livros e exercícios de nível fundamental e médio representam os átomos apenas por esferas com cores diferentes.
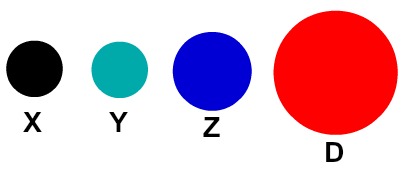
Representação didática dos átomos
Contribuições da teoria atômica de Dalton
- Compreensão da Lei da conservação da massa de Lavoisier
O químico francês Lavoisier afirmou, em 1785, que “em uma reação química massa se conserva porque não ocorre criação nem destruição de átomos ”. A teoria atômica de Dalton comprovou esse fato, já que um dos seus postulados afirma que o átomo é indestrutível.
Sendo assim, se realizarmos a combustão do carvão (C) na presença de gás oxigênio (O2), teremos uma reação química entre um átomo de carbono e dois átomos de oxigênio. Essa reação formará o gás carbônico (CO2), que possui exatamente os mesmos átomos que compunham as substâncias antes da reação.
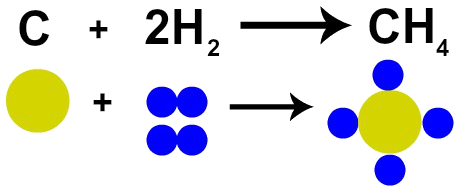
Representação da Lei de Lavoisier pelo modelo atômico de Dalton
- Compreensão das substâncias simples
Utilizando o modelo atômico de Dalton, podemos compreender uma substância simples, isto é, aquela que possui átomos de mesma característica formando uma molécula. Logo, temos átomos pertencentes a um mesmo elemento químico.
Na substância F2, por exemplo, temos dois átomos de flúor, por isso, devemos utilizar dois tipos de átomos iguais na representação segundo a teoria atômica de Dalton.

Representação de substância simples segundo o modelo atômico de Dalton
- Compreensão das substâncias compostas
Em uma substância composta, temos átomos de características diferentes formando a molécula. Logo, temos elementos químicos diferentes formando a substância.
A substância H2O, por exemplo, apresenta três átomos: dois de hidrogênio e um de oxigênio. Veja sua representação segunda o modleo atômico de Dalton:

Representação de uma substância composta segundo o pelo modelo atômico de Dalton
- Compreensão das misturas
A compreensão de uma mistura (união de duas ou mais substâncias diferentes) por intermédio da teoria atômica de Dalton é simples: basta colocarmos duas moléculas diferentes em um mesmo recipiente.

Representação de uma mistura segundo o modelo atômico de Dalton
Outras contribuições científicas de John Dalton
- Introduziu o conceito de massa atômica;
- Formulou a lei das pressões parciais dos gases (Lei de Dalton);
- Descobriu a deficiência visual denominada de daltonismo;
- Estudou o comportamento de vapores e gases em diferentes temperaturas;
- Descobriu que todos os gases expandem-se (procuram ocupar um determinado local) no espaço da mesma forma.
Fonte:https://www.youtube.com/watch?v=V8SS6O2Sb-g
Modelo atômico de Thomson
Com os experimentos de Faraday e outros, gerou-se a necessidade de um novo modelo e, Thompson o propôs com a existência do elétron.
Em 1891, o físico irlandês George Johnstone Stoney propôs para a unidade natural de eletricidade o nome de elétron e o cientista inglês William Crookes foi quem identificou essa partícula através de uma invenção de ampola de raios catódicos que continha em seu interior gás ou ar em baixa pressão que submetido a uma corrente elétrica produzia raios luminosos que saiam de uma extremidade da ampola identificada como pólo negativo e caminhavam até a outra extremidade que era o pólo positivo, caracterizando um fluxo de moléculas.
A palavra eletricidade deriva do grego “elektron”, que significa “âmbar”.
Em 1898, o físico inglês John Thomson, realizou experimentos com a ampola de Crookes e conclui que os raios catódicos são constituídos de cargas elétricas negativas, transportadas por partículas de matéria. Thomson descobriu que existiam partículas negativas que compunham a matéria. Isso significava que o modelo de Dalton estava errado porque o átomo seria divisível, tendo em vista que ele teria partículas ainda menores negativas chamadas de elétrons. Assim propôs que os elétrons seriam uma parte constituinte dos átomos e que o átomo seria uma esfera carregada positivamente, na qual estariam incrustados os elétrons com carga negativa.
Esse modelo ficou conhecido como pudim de passas, onde o pudim seria a carga positiva do átomo e as passas seriam os elétrons incrustados nele.
Visto que o átomo é neutro, cargas positivas também deveriam existir. Assim, J. J. Thomson propôs o seguinte em 1898:
“ O átomo é constituído de uma partícula esférica de carga positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total é nula.”

O modelo atômico de Thomson parecia com um pudim ou bolo de passas
Fonte:https://www.youtube.com/watch?v=V8SS6O2Sb-g
Modelo atômico de Rutherford – Geiger
No final do século XIX, o físico neozelandês Ernest Rutherford estudando a radioatividade descobriu que existem dois tipos de radiações distintos, uma que é rapidamente Absorvida, conhecida como radiação alfa e outra com maior poder de penetração, conhecida como beta. Em 1911, realizou um experimento em que ele bombardeou uma finíssima lâmina de ouro com partículas alfa (α) emitidas por uma amostra de polônio (material radioativo) que ficava dentro de um bloco de chumbo com um pequeno orifício pelo qual as partículas passavam.
Por meio dos resultados desse experimento, Rutherford percebeu que, na verdade, o átomo não seria maciço como propôs os modelos de Dalton e Thomson.
Ele propôs um novo modelo atômico foi idealizado com um átomo divisível, onde teria duas regiões: uma central chamada núcleo constituído pela parte positiva, os prótons e por partículas sem carga, e uma região ao redor da central denominada eletrosfera uma grande região vazia constituída pelas cargas negativas chamadas elétrons que ficam girando ao redor do núcleo. Ele imaginou o seu modelo semelhante a um sistema solar, em que os elétrons girariam ao redor do núcleo, em órbitas como as planetárias.

O modelo atômico de Rutherford fazia uma analogia ao sistema solar
Em 1932, o cientista Chadwick descobriu a terceira partícula subatômica, o nêutron. Dessa forma, o modelo de Rutherford passou a ter os nêutrons no núcleo junto aos prótons, ficando assim:
.jpg)
Modelo atômico de Rutherford incluindo os nêutrons no núcleo
Uma vez estabelecido em Manchester, Rutherford encontrou como assistente o jovem alemão Hans Geiger (1882-1945), famoso por ter criado o Contador Geiger, instrumento utilizado para detectar radioatividade. Ambos publicaram vários trabalhos associados aos estudos das partículas alfa. Rutherford e Geiger publicaram em 1908 dois importantes artigos na Proceedingsof the Royal Society of London. O primeiro deles, intitulado “Um Método Elétrico de Contagem de Partículas α de Substâncias Radioativas” (An Electrical Method of Counting the Number of α – Particles from Radio-active Substances), Rutherford e Geiger relatam dois métodos criados por eles de contagem de partículas alfa emitidas por substâncias radioativas: o método elétrico e o método de cintilações. Geiger estudou um método elétrico de contagem de uma única partícula alfa. A grande dúvida em relação a isso era o fato dos diferentes valores encontrados da carga unitária. Isso fica evidente com a justificativa dada pelos autores no artigo: Houve a necessidade de um método de contar as partículas de alfa diretamente sem qualquer suposição da carga carregada por cada uma […]. Se o número de partículas alfa expelida de uma quantidade definida de material radioativo pudesse ser determinado por um método direto, a carga carregada por cada partícula poderia ser conhecida imediatamente medindo a carga positiva total carregada pelas partículas alfa. E deste modo, deveria ser possível lançar alguma luz na pergunta se a partícula alfa carrega uma carga e ou 2e, e assim resolver o problema mais urgente emradioatividade, […] se a partícula alfa é um átomo de hélio. (RUTHERFORD e GEIGER, 1908, p. 141. Tradução nossa). Geiger utilizou um método conhecido como ionização por colisão. Era um método desenvolvido por J. A. Thownsend que consistia na formação de íons a partir de um potencial elétrico muito grande.
Fonte;https://www.youtube.com/watch?v=cbF1UwtyriI&t=68s
Modelo atômico de Rutherford-Bohr
Esse modelo recebeu esse nome porque, em 1913, o cientista Niels Bohr (1885-1962) propôs um modelo que se baseou no de Rutherford, apenas o aprimorando. Entre seus principais postulados, propôs um novo modelo atômico após o estudo do espectro do átomo de hidrogênio. Aperfeiçoou o modelo atômico de Rutherford onde os elétrons se organizam na eletrosfera na forma de camadas ao redor do núcleo em órbitas circulares, designadas pelas letras maiúsculas K, L, M, N, O, P e Q representando os 7 níveis de energia da eletrosfera. Cada órbita seria um nível de energia que teria uma determinada quantidade de elétrons, o mais próximo do núcleo, menor sua energia e quanto mais afastado do núcleo maior sua energia. Um átomo tem seus elétrons nos níveis de energia mais baixos, mais próximos do núcleo. Se esse átomo, receber energia, sendo por exemplo aquecido, um elétron pode absorvê-la e mudar para um nivel de energia maior. Quando retornar para o nível de energia menor, esse elétron liberará a mesma quantidade de energia antes absorvida e poderá ser, por exemplo, na forma de luz.
“Os elétrons movem-se em órbitas circulares, e cada órbita apresenta uma energia bem definida e constante (nível de energia) para cada elétron de um átomo.”
Essas camadas eletrônicas ou níveis de energia passaram a ser representadas pelas letras K, L, M, N, O, P e Q, respectivamente, no sentido da camada mais próxima ao núcleo para a mais externa.
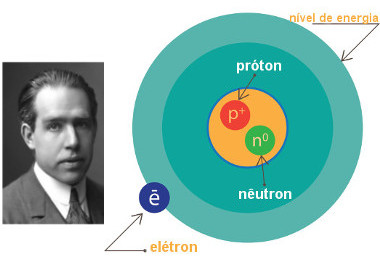
Representação do modelo atômico de Rutherford-Bohr
Veja na figura a seguir que, segundo esse modelo, as órbitas vão progressivamente sendo preenchidas pelos elétrons. Os átomos mostrados a seguir são dos primeiros oito elementos da Tabela Periódica:
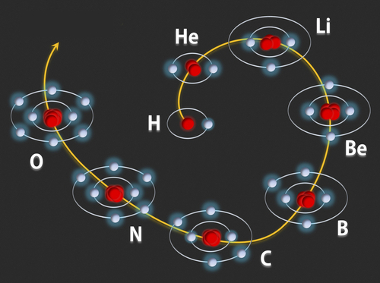
Forma como os níveis energéticos são progressivamente preenchidos por elétrons nos primeiros oito átomos da Tabela Periódica dos elementos
Atualmente, o modelo mais moderno para o átomo é o MODELO QUÂNTICO, que indica que os elétrons não giram em órbitas. Os estudos quânticos demonstram que só é possível a presença de um determinado número de elétrons em cada nivel energético. A maneira como estão distribuídos é conhecida como distribuição eletrônica. Os elétrons da ultima camada são responsáveis pelo comportamento químico do elemento e consequentemente chamados de elétrons de valência.



