Número de Oxidação (NOX)
O número de oxidação (NOX) de um elemento é a carga elétrica que ele adquire quando faz uma ligação iônica ou o caráter parcial (δ) que ele adquire quando faz uma ligação predominantemente covalente.
Isso significa que corresponde à tendência de um átomo de atrair os elétrons envolvidos nas ligações que realiza. Por isso, a maioria dos elementos químicos apresenta diversos números de oxidação, dependendo do composto que ele está formando.
No entanto, existem alguns elementos, que normalmente são os mais eletropositivos ou mais eletronegativos, que apresentam o mesmo NOX em uma série de compostos diferentes. Esses elementos estão na tabela abaixo:
.jpg)
Com base nesses valores e nas regras a seguir, é possível determinar qual será o NOX dos outros elementos presentes em diferentes substâncias:
- O NOX de substâncias simples é sempre igual a zero. Exemplos: N2, O2, H2, Na, Fe, Al.
- O NOX de íons é igual a sua carga. Exemplos:
Na1+: NOX= +1
O2-: NOX= -2
F1-: NOX= -1
- A soma dos NOX dos elementos de um composto sempre dá igual a zero;
- A soma dos NOX dos elementos em um íon composto é sempre igual à carga do íon.
Veja como usar essas informações para calcular o NOX de vários elementos:
1. H2SO4:
- O NOX do H é igual a +1;
- O NOX do O é igual a -2;
- A soma dos NOX desses compostos é igual a zero;
- Precisamos saber apenas o NOX do enxofre (S), que chamaremos de x:
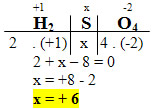
2. Na4P2O7:
- O Na é um metal alcalino, então seu NOX é igual a +1;
- O NOX do O é igual a -2;
- A soma dos NOX desses compostos é igual a zero;
- Precisamos saber apenas o NOX do fósforo (P), que chamaremos de x. Não se esquecendo de multiplicar pelo índice 2:
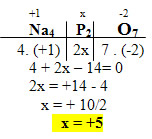
3. NH41+:
- Nesse caso temos um íon composto, então a soma dos NOX será igual à carga, que é +1:
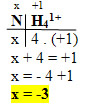
Oxidação e Redução
A oxidação ocorre quando o elemento perde elétrons e o seu número de oxidação (Nox) aumenta.
O Nox, como poderá ser visto no texto Número de Oxidação (Nox), é a carga elétrica que o elemento adquire quando faz uma ligação iônica ou o caráter parcial que ele adquire quando faz uma ligação predominantemente covalente.
Já a redução ocorre quando o elemento ganha elétrons e o seu número de oxidação diminui.
Veja um exemplo: na formação do sal de cozinha (cloreto de sódio – NaCl), o sódio cede definitivamente um elétron para o cloro, formando o cátion Na+, ou seja, ele sofre oxidação, pois perdeu um elétron e seu Nox aumentou de zero para +1. Simultaneamente, o cloro recebe um elétron, formando o ânion cloreto (Cl–), ou seja, sofre redução, pois seu Nox passou de zero para -1.
0 0 +1 -1
2 Na(s) + 1 Cl2(g) → 2 NaCl(s)
Nesse exemplo, o sódio é chamado de agente redutor, pois foi ele quem forneceu o elétron para o cloro, provocando a sua redução. Já o cloro é o agente oxidante, pois ele provocou a oxidação do sódio, recebendo o elétron dele.
Resumidamente, temos:
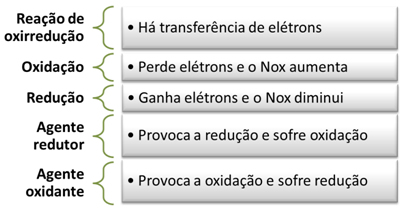
As reações de oxirredução são bastante comuns em nosso cotidiano, como quando um prego enferruja. O prego é feito de ferro, que com o tempo se oxida em contato com o oxigênio e com a água, formando o Fe2O3 . 3H2O, que é a ferrugem:
Fe(s) → Fe2+ + 2e– (oxidação do ferro)
O2 + 2H2O + 4e– → 4OH– (redução do oxigênio)
2Fe + O2 + 2H2O → 2Fe(OH)2 ou Fe2O3 . 3H2O (equação geral da formação da ferrugem)
Portanto, nessa reação, o ferro sofre oxidação, sendo o agente redutor; e o oxigênio sofre redução, sendo o agente oxidante.

Na formação da ferrugem, o ferro sofre oxidação e o oxigênio sofre redução
Balanceamento por oxirredução
QUÍMICA
Todo balanceamento de reações por oxirredução leva em conta que o número de elétrons cedidos deve ser igual ao número de elétrons doados.
O balanceamento de uma equação de oxirredução se baseia na igualdade do número de elétrons cedidos com o número de elétrons recebidos. Um método simples de se realizar esse balanceamento é dado pelos passos a seguir:
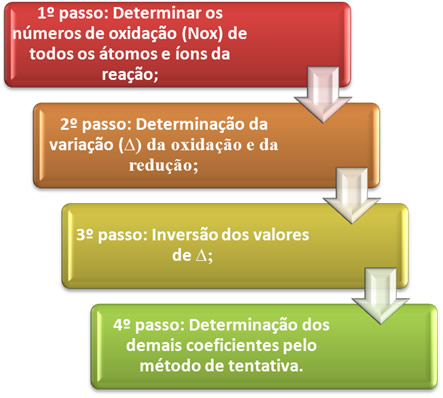
Vejamos na prática como aplicar esses passos, por meio do seguinte exemplo:
Reação entre uma solução aquosa de permanganato de potássio e ácido clorídrico:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*1º passo: Determinar os números de oxidação:
Esse passo é importante porque normalmente não conseguimos visualizar rapidamente quais são as espécies que sofrem oxidação e redução.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*2º passo: Determinação da variação da oxidação e da redução:
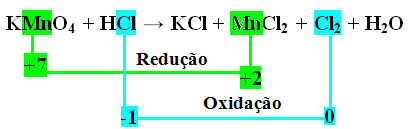
Observe que o manganês (Mn) sofre redução e o cloro (Cl) sofre oxidação.
MnCl2 = ∆Nox = 5
Cl2 = ∆Nox = 2
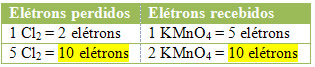
No caso do cloro, podemos notar que o HCl originou 3 compostos (KCl, MnCl2, e Cl2), mas o que nos interessa é o Cl2, pois é o seu Nox que sofreu variação. Cada cloro que forma Cl2 perde 1 elétron; como são necessários 2 cloros para formar cada Cl2, são perdidos então dois elétrons.
3º passo: Inversão dos valores de ∆:
Nesse passo, os valores de ∆ são trocados entre as espécies citadas, tornando-se os coeficientes delas:
MnCl2 = ∆Nox = 5 → 5 será o coeficiente de Cl2
Cl2 = ∆Nox = 2→ 2 será o coeficiente de MnCl2
KMnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Nesse momento já é possível conhecer dois coeficientes da equação.
Observação: normalmente, na maioria das reações, essa inversão de valores é efetuada no 1º membro. Mas, como regra geral, isso deve ser feito no membro que tiver maior número de átomos que sofrem oxirredução. Se esse critério não puder ser observado, invertemos os valores no membro que tiver maior número de espécies químicas. Foi isso o que foi realizado aqui, pois o 2º membro possui mais substâncias.
4º passo: Balanceamento por tentativa:
KMnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Visto que no segundo membro há dois átomos de manganês, conforme mostrado pelo coeficiente, no primeiro também deverá haver. Portanto, temos:
2 KMnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
- Com isso, a quantidade de potássio (K) no 1º membro ficou de 2, que será o mesmo coeficiente para esse átomo no segundo membro:
2 KMnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- A quantidade de cloros (Cl) no 2º membro é de 16 no total, por isso o coeficiente do HCl do 1º membro será:
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
- O número de hidrogênios do 1º membro é 16, por isso o coeficiente da água (H2O) do 2º membro será igual a 8, pois a multiplicação do índice do hidrogênio (2) por 8 é igual a 16:
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
- Para conferir se a equação está corretamente balanceada podemos ver dois critérios:
1º) Verificar se a quantidade de cada átomo nos dois membros está igual:
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
K =2 K =2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2º) Ver se o número total de elétrons perdidos é igual ao número total de elétrons recebidos:
Por Jennifer Fogaça
Graduada em Química

FOGAçA, Jennifer Rocha Vargas.
Faça o balanceamento da equação a seguir:
K2Cr2O7(aq) + H2O(l) + S(g) → KOH(aq) + Cr2O3(s) + SO2(g)
As reações a seguir representam as etapas envolvidas na obtenção de ácido acético (CH3CO2H) a partir de eteno (C2H4).
C2H4(aq) + O2(g) → CH3CHO(l)
eteno acetaldeído
CH3CHO(l)+ O2(g) → CH3CO2H
acetaldeído ácido acético
A seguir são dadas as fórmulas estruturais do eteno, acetaldeído e do ácido acético:
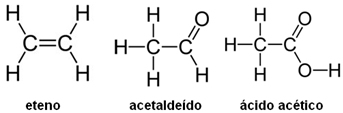
Determine:
a) o Nox dos átomos de carbono nos compostos orgânicos;
b) os agentes redutor e oxidante em ambas as reações;
c) balanceie as duas equações químicas.
QUESTÃO 1
Faça o balanceamento da equação a seguir:
K2Cr2O7(aq) + H2O(l) + S(g) → KOH(aq) + Cr2O3(s) + SO2(g)
QUESTÃO 2
As reações a seguir representam as etapas envolvidas na obtenção de ácido acético (CH3CO2H) a partir de eteno (C2H4).
C2H4(aq) + O2(g) → CH3CHO(l)
eteno acetaldeído
CH3CHO(l)+ O2(g) → CH3CO2H
acetaldeído ácido acético
A seguir são dadas as fórmulas estruturais do eteno, acetaldeído e do ácido acético:

Determine:
a) o Nox dos átomos de carbono nos compostos orgânicos;
b) os agentes redutor e oxidante em ambas as reações;
c) balanceie as duas equações químicas.
QUESTÃO 3
(PUC-SP modificada) Sabe-se que cobre metálico reage com ácido nítrico diluído e produz óxido de nitrogênio IV, água e um composto iônico no qual o cobre tem seu maior número de oxidação, dentre os dois mais comuns. Formule e ajuste a equação da reação entre cobre e ácido nítrico diluído.
QUESTÃO 4
Em 1856, Berthelot preparou metano segundo a reação representada pela equação abaixo, não balanceada:
CS2 + H2S + Cu → Cu2S + CH4
a) Acerte os coeficientes estequiométricos pelo método da oxidorredução.
b) Indique o elemento que se oxida mostrando a variação dos números de oxidação.
RESPOSTAS
Questão 1
2 K2Cr2O7(aq) + 2 H2O(l) + 3 S(g) → 4 KOH(aq) + 2 Cr2O3(s) + 3 SO2(g)
Passos:
1º passo: Determinar os números de oxidação:
+1 +6 -2 +1 -2 0 +1 -2 +1 +3 -2 +4 -2
K2Cr2O7(aq) + H2O(l) + S(g) → KOH(aq) + Cr2O3(s) + SO2(g)
2º passo: Determinar a variação da oxidação e da redução:
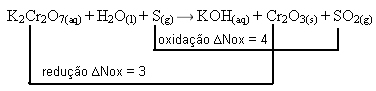
3º passo: Inversão dos valores de ∆:
K2Cr2O7= ∆Nox = 2 . 3 = 6 → 6 será o coeficiente de S
S= ∆Nox = 1 . 4 = 4→ 4 será o coeficiente de K2Cr2O7
4K2Cr2O7(aq) + H2O(l) + 6 S(g) → KOH(aq) + Cr2O3(s) + SO2(g)
4º passo: Balanceamento por tentativa:
4 K2Cr2O7(aq) + 4 H2O(l) + 6 S(g) → 8 KOH(aq) + 4 Cr2O3(s) + 6 SO2(g)
* Dividindo todos os coeficientes por 2 para ficar com os menores coeficiente inteiros:
2 K2Cr2O7(aq) + 2 H2O(l) + 3 S(g) → 4 KOH(aq) + 2 Cr2O3(s) + 3 SO2(g)
Questão 2
a)
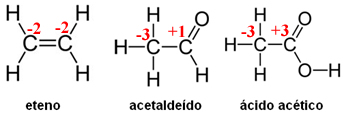
b) Em ambas as equações, o O2 (sofre redução) é o agente oxidante. Na primeira equação, o agente redutor é o eteno e na segunda, o acetaldeído.
c) 2 C2H4(aq) + 1 O2(g) → 2 CH3CHO(l)
2 CH3CHO(l)+ 1 O2(g) → 2 CH3CO2H
Questão 3
1 Cu(s) + 4 HNO3(aq) → 2 NO2(g) + 1 Cu(NO3)2(aq) + 2 H2O(l)
Passos:
1º passo: Determinar os números de oxidação:
0 +1 +5 -2 +4 -2 +2 +5 -2 +1 -2
Cu(s) + HNO3(aq) → NO2(g) + Cu(NO3)2(aq) + H2O(l)
2º passo: Determinar a variação da oxidação e da redução: ∆
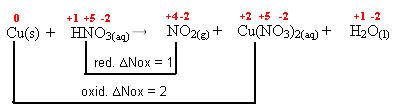
3º passo: Inversão dos valores de ∆:
NO2= ∆Nox = 1 . 1 = 1 → 1 será o coeficiente de Cu(NO3)2
Cu(NO3)2= ∆Nox = 1 . 2 = 2→ 2 será o coeficiente de NO2
Cu(s) + HNO3(aq) → 1 NO2(g) + 2 Cu(NO3)2(aq) + H2O(l)
4º passo: Balanceamento por tentativa:
1 Cu(s) + 4 HNO3(aq) → 2 NO2(g) + 1 Cu(NO3)2(aq) + 2 H2O(l)
Questão 4
1 CS2 + 2 H2S + 8 Cu → 4 Cu2S + 1 CH4
Passos:
1º passo: Determinar os números de oxidação:
+4 -2 +1 -2 0 +1 -2 -4 +1
CS2 + H2S + Cu → Cu2S + CH4
2º passo: Determinar a variação da oxidação e da redução: ∆
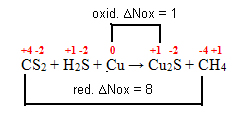
3º passo: Inversão dos valores de ∆:
CS2= ∆Nox = 1 . 8 = 8 → 8 será o coeficiente de Cu
Cu = ∆Nox = 1 . 1 = 1→ 1 será o coeficiente de CS2
1CS2 + H2S + 8Cu → Cu2S + CH4
4º passo: Balanceamento por tentativa:
1 CS2 + 2 H2S + 8 Cu → 4 Cu2S + 1 CH4
RESPOSTAS
Questão 1
2 K2Cr2O7(aq) + 2 H2O(l) + 3 S(g) → 4 KOH(aq) + 2 Cr2O3(s) + 3 SO2(g)
Passos:
1º passo: Determinar os números de oxidação:
+1 +6 -2 +1 -2 0 +1 -2 +1 +3 -2 +4 -2
K2Cr2O7(aq) + H2O(l) + S(g) → KOH(aq) + Cr2O3(s) + SO2(g)
2º passo: Determinar a variação da oxidação e da redução:

3º passo: Inversão dos valores de ∆:
K2Cr2O7= ∆Nox = 2 . 3 = 6 → 6 será o coeficiente de S
S= ∆Nox = 1 . 4 = 4→ 4 será o coeficiente de K2Cr2O7
4K2Cr2O7(aq) + H2O(l) + 6 S(g) → KOH(aq) + Cr2O3(s) + SO2(g)
4º passo: Balanceamento por tentativa:
4 K2Cr2O7(aq) + 4 H2O(l) + 6 S(g) → 8 KOH(aq) + 4 Cr2O3(s) + 6 SO2(g)
* Dividindo todos os coeficientes por 2 para ficar com os menores coeficiente inteiros:
2 K2Cr2O7(aq) + 2 H2O(l) + 3 S(g) → 4 KOH(aq) + 2 Cr2O3(s) + 3 SO2(g)
Questão 2
a)

b) Em ambas as equações, o O2 (sofre redução) é o agente oxidante. Na primeira equação, o agente redutor é o eteno e na segunda, o acetaldeído.
c) 2 C2H4(aq) + 1 O2(g) → 2 CH3CHO(l)
2 CH3CHO(l)+ 1 O2(g) → 2 CH3CO2H
Questão 3
1 Cu(s) + 4 HNO3(aq) → 2 NO2(g) + 1 Cu(NO3)2(aq) + 2 H2O(l)
Passos:
1º passo: Determinar os números de oxidação:
0 +1 +5 -2 +4 -2 +2 +5 -2 +1 -2
Cu(s) + HNO3(aq) → NO2(g) + Cu(NO3)2(aq) + H2O(l)
2º passo: Determinar a variação da oxidação e da redução: ∆
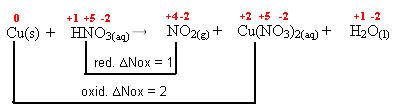
3º passo: Inversão dos valores de ∆:
NO2= ∆Nox = 1 . 1 = 1 → 1 será o coeficiente de Cu(NO3)2
Cu(NO3)2= ∆Nox = 1 . 2 = 2→ 2 será o coeficiente de NO2
Cu(s) + HNO3(aq) → 1 NO2(g) + 2 Cu(NO3)2(aq) + H2O(l)
4º passo: Balanceamento por tentativa:
1 Cu(s) + 4 HNO3(aq) → 2 NO2(g) + 1 Cu(NO3)2(aq) + 2 H2O(l)
Questão 4
1 CS2 + 2 H2S + 8 Cu → 4 Cu2S + 1 CH4
Passos:
1º passo: Determinar os números de oxidação:
+4 -2 +1 -2 0 +1 -2 -4 +1
CS2 + H2S + Cu → Cu2S + CH4
2º passo: Determinar a variação da oxidação e da redução: ∆

3º passo: Inversão dos valores de ∆:
CS2= ∆Nox = 1 . 8 = 8 → 8 será o coeficiente de Cu
Cu = ∆Nox = 1 . 1 = 1→ 1 será o coeficiente de CS2
1CS2 + H2S + 8Cu → Cu2S + CH4
4º passo: Balanceamento por tentativa:
1 CS2 + 2 H2S + 8 Cu → 4 Cu2S + 1 CH4


