Conteúdos e temas: transformações químicas; energia em processos endo/exotérmicos; tempo envolvido nas transformações; revertibilidade de algumas transformações.·
Competências e habilidades: reconhecer a importância dos fatores tempo, energia e revertibilidade nas interações e transformações químicas que ocorrem no dia a dia e no sistema produtivo.·
Estratégias de ensino: levantamento das ideias dos alunos; aula expositiva dialógica; experimento; problemas, questões abertas e questões de classificação.·
Recursos: materiais e reagentes para realização do experimento. Sugestão de avaliação: respostas às questões e aos problemas e participação na discussão do experimento.
FATORES QUE PODEM SE ANALISADOS NAS TRANSFORMAÇÕES QUÍMICAS.
O tempo gasto.
Avaliar o tempo em que as transformações ocorrem é especialmente relevante no sistema produtivo em seus mais diversos setores: indústrias, agropecuária e serviços. Há na natureza transformações que podem ser rápidas ou lentas e que esse aspecto pode ser controlado ou modificado.
Os processos de calcinação usados durante o período colonial em alguns países, duravam cerca de três dias para completar a transformação do calcário em gás carbônico e cal viva.
Com a modernização dos fornos, o tempo de produção diminuiu para apenas algumas horas.o que para a indústria é muito mais produtivo e lucrativo.
O tempo também é importante no nosso dia-a-dia, porque algumas reações são desejáveis que demorem mais tempo para ocorrerem:
Exemplo: a deterioração de uma fruta ou vegetal que é um processo químico, é interessante que demorem mais tempo para apodrecerem, para isto retardamos o processo do envelhecimento colocando-os na geladeira, fazendo com que tenham mais tempo de vida. Em outras queremos reduzir o tempo de cozimento dos alimentos, usando uma panela de pressão.
Lembrar que as transformações químicas ocorrem em tempos diferentes, algumas demoram centésimos de segundos, outras podem levar horas, dias, meses ou até anos.
Transformações instantâneas: Queima de diversos materiais, explosão de fogos de artifício, efervescência de água oxigenada em contato com uma ferida.
Transformações não instantâneas: Corrosão de estátuas de mármore, apodrecimento de alimentos, cozimento de alimentos.
A possibilidade de se reverter esses processos.
Transformação revertível: É quando os reagentes são facilmente recuperáveis sem a adição de novos materiais. Exemplo: derretimento da parafina na produção de vela e a desidratação do sulfato de cobre pentaidratado. Os reagentes voltam a ser exatamente o que eram.
Transformação irrevertível: É quando não se consegue recuperar os reagentes, a não ser pela adição de outros materiais e por meio de outros procedimentos.
Exemplo: corrosão de um portão de ferro, a dissolução de um comprimido efervescente de sal de fruta, queima do carvão.
Nas transformações reversíveis a formação do produto e a regeneração do reagente ocorrem ao mesmo tempo e seguem os mesmos caminhos.
Exemplo: gelo, amassar um papel, transformar tecido em roupa.
Nas transformações revertíveis o caminho de reação da regeneração dos reagentes não precisa ser o mesmo da formação do produto nem a reação precisa se processar nos dois sentidos ao mesmo tempo.
- REVERTIBILIDADE:
As transformações, podem ser revertidas, embora grande parte das transformações serem irrevertíveis, uma vez que o reagente se transforma em produto.
Podemos classificar os processos que são revertidos sem a adição (acréscimo) de novos materiais como REVERTÍVEIS, por exemplo: o derretimento da parafina na produção da vela e a desidratação (retirada de água) do sal sulfato de cobre pentaidratado (CuSO4.5H2O):
-Parafina sólida- + energia térmica ——à parafina líquida (derretimento) = absorveu calor
-Parafina líquida—–à parafina sólida + energia térmica ( solidificação) = liberou calor
-Sulfato de cobre pentaidratado + energia térmica——à sulfato de cobre anidro (CuSO4) + água (desidratação) = absorveu calor
-Sulfato de cobre anidro + água —-à sulfato de cobre pentaidratado + energia térmica (hidratação) = absorveu calor
- IRREVERTÍVEL: Classificamos como processos irreversíveis aqueles que, para se recuperar os reagentes, requeiram o uso de outros materiais e processos, exemplo: a corrosão de um portão de ferro e a dissolução de um comprimido efervescente de sal de fruta.
A corrosão do portão posso recuperar fazendo adição de novos produtos na ferrugem, já a dissolução do comprimido não existe possibilidade de reverter o processo.
- REVERSÍVEIS: Não é a mesma coisa que revertível, são significados diferentes. Estas transformações químicas são as que ocorrem nos dois sentidos: os reagentes formam os produtos e os produtos automaticamente formam os reagentes simultaneamente. (estudaremos com detalhes na 3ª série do E.M)
Exemplo:
A ionização é reversível, e por isso utiliza-se duas setas na reação.
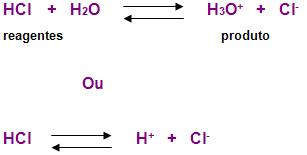
O fator energia
As reações podem absorver ou liberar energia
Exemplos: Queima da madeira ——–à libera energia térmica (calor)
Cozimento de um ovo —–à absorve energia térmica ( calor)
A produção de qualquer forma de energia é chamada de EXOERGÔNICAS e as que envolvem o consumo de energia são chamadas de ENDOERGÔNICAS.
Quando a energia liberada ou absorvida for TÉRMICA, diz-se que são:
EXOTÉRMICAS——-à as que LIBERAM energia
ENDOTÉRMICAS–—à as que ABSORVEM energia
O fator custo:
É um dos temas de maior importância dentro de uma análise de viabilidade econômica, servindo como indicativo para a escolha das melhores alternativas de produção visando sempre a maximização dos retornos.
O fator mercado:
É aquele em que há um grande número de compradores de um fator de produção, como trabalho ou matéria-prima.
Fator meio ambiente:
Se for prejudicar o meio ambiente, não deve ser produzido.
O cidadão comum espera que o poder público faça legislações que sejam cada vez mais restritivas e severas para disciplinar as condutas ambientais e que fiscalizem de forma eficaz o cumprimento destas leis.
No entanto a Constituição coloca o meio ambiente como um direito fundamental essencial para a dignidade da pessoa humana e impõem ao Poder Público e a coletividade o dever de proteger e preservar.
Transformações químicas e físicas:
Nem todas as misturas de substâncias são transformações químicas.
Exemplo: água e sal, nesta mistura não ocorre reação química, ocorre apenas a dissolução do sal na água, porém o sal continua sendo sal e a água continua sendo água, neste caso ocorreu apenas uma transformação física, ou seja, o sal (sólido ) se dissolveu na água, mudou apenas a sua aparência física.
Transformações químicas
- A calcinação do calcário (CaCO3) e a hidratação (acréscimo de água) na cal (CaO) são exemplos de transformação química.
- Digestão, fotossíntese, ferrugem são transformações químicas.
- Nem sempre é necessário se ter uma mistura para que ocorra uma reação química
Exemplo:
CaCO3 (calcário) + energia( calor)——–à CaO (cal viva) + CO2 (gás carbônico)
Aqui partimos de 1 única substância e ocorreu uma transformação química
- Na confecção de velas a parafina é aquecida em panela , passando do estado sólido para líquido, sendo moldado no formato que se deseja—–àtransformação física
- Na queima da vela temos uma transformação química, porque ao ser queimada ela forma: CO2 (gás carbônico), vapor de água e fuligem, e este processo também libera energia térmica e luminosa.
- Uma transformação química é sempre um processo na qual ocorre a formação de novas substâncias.
- Uma transformação química pode ser representada por equações químicas.
Exemplo: A hidratação da cal viva para obtenção da cal extinta é representada pela equação:
CaO(s) (cal viva sólida) + H2O(l) (água líquida)—–à Ca(OH)2(s) (cal extinta sólida) + energia térmica
QUESTÕES DO CADERNO DO ALUNO: 1ª série = volume 1:
a) Queima do gás de cozinha.
É uma transformação química em que o gás reage com oxigênio, e não uma simples mudança de estado físico. Os
materiais formados também são gases, ou seja, existem transformações químicas que ocorrem sem que haja mudança de estado físico dos materiais envolvidos.
b) Evaporação do álcool em contato com a pele.
Nesse fenômeno não ocorre transformação química, apenas uma mudança de estado físico em que o álcool líquido se
torna álcool gasoso.
5. Uma ideia muito comum é a de que são necessárias, pelo menos, duas substâncias interagindo para que ocorra uma transformação química.
a) Você concorda com essa ideia? Justifique.
Alguns alunos já poderão perceber que a ideia está equivocada, pois existem transformações químicas que ocorrem
com um único reagente, como a decomposição do calcário.
b) Considere os casos de transformações químicas a seguir:
São transformações químicas:
Explosão de uma bombinha de pólvora
Corrosão de um cano de cobre
Apodrecimento de um pedaço de madeira
Corrosão de uma pia de mármore pelo vinagre
Queima de uma vela
1) Transformações exotérmicas são as que liberam energia térmica (calor)
Transformações endotérmicas são as que absorvem energia térmica (calor)
Página 18: respostas
Atividade 3:
1) As transformações revertíveis são aquelas que podem ser recuperadas, ou seja, podemos recuperar os reagentes sem a adição de novos materiais.
2) São as transformações ou processos nos quais não se consegue recuperar os reagentes
3)Fenômeno Classificação
Queima de uma vela irrevertível
Amadurecimento de legumes irrevertível
Hidratação da cal viva revertível
Corrosão do magnésio ou zinco pó ácido irrevertível
Cozimento de um ovo irrevertível
Página 19: respostas:
2) ETAPA Forma de energia Envolvida classificação É uma transformação química?
Queima de carvão térmica e luminosa exotérmica sim
Secagem do calcário térmica endotérmica não
Aquecimento do calc. térmica endotérmica depende da temperatura do aquecimento*
Decomposição do calc. térmica endotérmica sim
Hidratação da cal térmica exotérmica sim
*O aquecimento do calcário pode causar a transformação química se a temperatura ultrapassar 900ºC, onde ocorre a decomposição do calcário formando um novo produto – este caso é uma exceção.
3) Processo irrevertível é a queima do carvão, todos os demais processos acima são revertíveis.
Bibliografia
Fonte: Material de apoio ao currículo do Estado de São Paulo: Caderno do Professor, Química, Ensino Médio, 1ª Série. São Paulo: SE, 2014.


