-
de 10
(FUVEST SP/2017)
Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
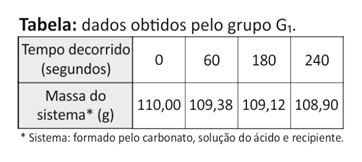
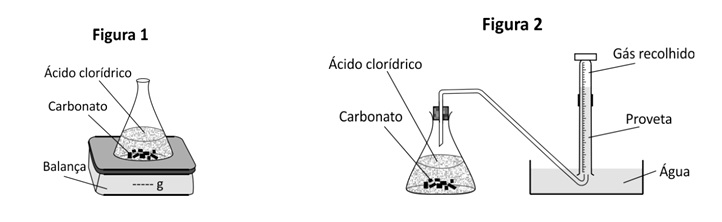
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2após 60, 180 e 240 segundos devem ter sido, respectivamente,
(UEA AM/2017)
Frequentemente, ouve-se falar no método de datação por carbono-14 para estimar a idade de fósseis. O número 14 corresponde ao número de ————— desse isótopo do carbono.
Assinale a alternativa que preenche corretamente a lacuna do texto.
(UEM PR/2017)
Na bioquímica, estudam-se as diferentes formas nas quais os compostos de carbono se apresentam nos seres vivos. Duas características dessas moléculas, diretamente ligadas à estrutura da cadeia carbônica e à presença de outros átomos, são a polaridade e a acidez (ou basicidade).
Assinale a(s) alternativa(s) que trazem uma correta descrição dessas moléculas e de suas propriedades.
(UECE/2017)
Nos compostos orgânicos, os átomos de carbono se ligam entre si ou com outros átomos e formam as cadeias carbônicas, que podem ser: abertas, fechadas ou mistas; normais ou ramificadas; saturadas ou insaturadas; homogêneas ou heterogêneas. O composto 3,7-dimetil-2,6-octadienal, conhecido como citral, usado na indústria alimentícia e para fortalecer o óleo de limão, possui a seguinte fórmula molecular: C9H15COH.
A classificação correta da sua cadeia carbônica é
(UECE/2017)
O carbono é um dos elementos mais característicos da tabela periódica. Mesmo não sendo tão abundante quanto o oxigênio e o nitrogênio, é facilmente encontrado. Atente ao que se diz a seguir sobre o carbono e suas propriedades:
I. O carbono ativado usado para a absorção de gases do organismo é obtido pela destilação da madeira.
II. O diamante puro é transparente, formado por cristais coloridos e é bom condutor de calor.
III. O mais novo alótropo do carbono descoberto é o buckminster fulereno cuja fórmula é C60.
IV. O grafite, usado como lubrificante, risca materiais mais duros que ele como o papel, por exemplo.
V. O isótopo do carbono utilizado na datação de fósseis possui oito nêutrons.
Está correto o que se afirma somente em
(UEA AM/2017)
Em uma cadeia carbônica, um átomo de carbono é considerado quaternário quando está ligado diretamente a quatro
(PUC Camp SP/2017)
Uma revista traz a seguinte informação científica:
O gás carbônico no estado sólido é também conhecido como “gelo seco”. Ao ser colocado na temperatura ambiente, ele sofre um fenômeno chamado sublimação, ou seja, passa diretamente do estado sólido para o estado gasoso.
É correto afirmar que a sublimação é um fenômeno
(UEG GO/2017)
Hidrocarbonetos contendo apenas uma ligação dupla entre átomos de carbono são classificados como alcenos e podem apresentar isomeria e diferentes propriedades físicas. A seguir, são fornecidas as estruturas de algumas dessas moléculas.
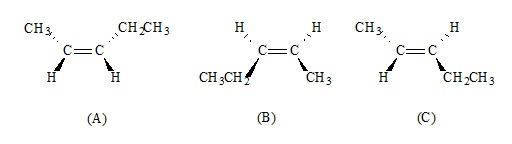
A análise das estruturas químicas apresentadas indica que
(FUVEST SP/2017)
No preparo de certas massas culinárias, como pães, é comum adicionar-se um fermento que, dependendo da receita, pode ser o químico, composto principalmente por hidrogenocarbonato de sódio (NaHCO3), ou o fermento biológico, formado por leveduras. Os fermentos adicionados, sob certas condições, são responsáveis pela produção de dióxido de carbono, o que auxilia a massa a crescer.
Para explicar a produção de dióxido de carbono, as seguintes afirmações foram feitas.
I. Tanto o fermento químico quanto o biológico reagem com os carboidratos presentes na massa culinária, sendo o dióxido de carbono um dos produtos dessa reação.
II. O hidrogenocarbonato de sódio, presente no fermento químico, pode se decompor com o aquecimento, ocorrendo a formação de carbonato de sódio (Na2CO3), água e dióxido de carbono.
III. As leveduras, que formam o fermento biológico, metabolizam os carboidratos presentes na massa culinária, produzindo, entre outras substâncias, o dióxido de carbono.
IV. Para que ambos os fermentos produzam dióxido de carbono, é necessário que a massa culinária seja aquecida a temperaturas altas (cerca de 200 ºC), alcançadas nos fornos domésticos e industriais.
Dessas afirmações, as que explicam corretamente a produção de dióxido de carbono pela adição de fermento à massa culinária são, apenas,
No preparo de certas massas culinárias, como pães, é comum adicionar-se um fermento que, dependendo da receita, pode ser o químico, composto principalmente por hidrogenocarbonato de sódio (NaHCO3), ou o fermento biológico, formado por leveduras. Os fermentos adicionados, sob certas condições, são responsáveis pela produção de dióxido de carbono, o que auxilia a massa a crescer.
Para explicar a produção de dióxido de carbono, as seguintes afirmações foram feitas.
I. Tanto o fermento químico quanto o biológico reagem com os carboidratos presentes na massa culinária, sendo o dióxido de carbono um dos produtos dessa reação.
II. O hidrogenocarbonato de sódio, presente no fermento químico, pode se decompor com o aquecimento, ocorrendo a formação de carbonato de sódio (Na2CO3), água e dióxido de carbono.
III. As leveduras, que formam o fermento biológico, metabolizam os carboidratos presentes na massa culinária, produzindo, entre outras substâncias, o dióxido de carbono.
IV. Para que ambos os fermentos produzam dióxido de carbono, é necessário que a massa culinária seja aquecida a temperaturas altas (cerca de 200 ºC), alcançadas nos fornos domésticos e industriais.
Dessas afirmações, as que explicam corretamente a produção de dióxido de carbono pela adição de fermento à massa culinária são, apenas,
(UEFS BA/2017)
Desde a antiguidade, o homem utiliza metais para a fabricação de utensílios diversos. A partir do século XVIII, a metalurgia tornou-se uma ciência, em que os processos metalúrgicos passaram a ser estudados e explicados, alavancando a obtenção dos metais a partir de minérios. A metalurgia é uma sequência de processos que visa à obtenção de um elemento metálico a partir de seu minério. Quanto maior a tendência do metal para sofrer corrosão, maior é a dificuldade de obtê-lo a partir do minério.
Sobre a obtenção de metais na metalurgia, é correto afirmar:
I. O alumínio é um metal de fácil obtenção a partir de seu minério, a bauxita, pois esse, por possuir baixa tendência em oxidar, é facilmente reduzido de Al3+ para Al0, se comparado a outros metais menos nobres, como o ferro e o chumbo.
II. Metais, como o ferro e o zinco, para serem obtidos a partir de seus minérios, devem ser aquecidos na presença de uma substância que vai provocar a redução desses metais, como o monóxido de carbono, que é um agente redutor.
III. O alumínio possui inúmeras aplicações, mas, por ser um metal pouco nobre, é difícil de ser obtido e sua redução é realizada em um processo denominado eletrólise.
IV. A prata é um metal nobre, sua principal fonte é o minério argentita (Ag2S), sendo que o processo de obtenção da prata metálica é realizado pelo aquecimento desse minério, que reage com o oxigênio, provocando a oxidação da prata.
A alternativa em que todas as afirmativas indicadas estão corretas é a


