Conteúdos e temas: ligação química; modelo explicativo para a transformação química; energia de ligação; modelo explicativo para transformações químicas exotérmicas e endotérmicas.
Competências e habilidades: empregar a linguagem química; interpretar a transformação química como
a quebra e formação de ligações; compreender e identificar a energia envolvida na quebra e formação de
ligações químicas; fazer previsões a respeito da energia envolvida numa transformação química.
Estratégias de ensino: aula expositiva dialogada; resolução de problemas; trabalho individual.
Recursos: texto; materiais de laboratório; roteiro experimental.
Avaliação: respostas às questões.
Ligação Iônica

A ligação iônica, também chamada de ligação eletrovalente ou heteropolar, é um tipo de ligação química que ocorre quando o átomo de um metal cede definitivamente um ou mais elétrons para o átomo de um ametal, semimetal ou hidrogênio.
Quando isso acontece, formam-se íons (daí a origem do termo “ligação iônica”), ou seja, formam-se espécies químicas carregadas eletricamente. O átomo que doou um ou mais elétrons se torna um íon positivo, denominado de cátion, enquanto o átomo que recebeu os elétrons se torna um íon carregado negativamente, isto é, um ânion. Visto que cargas opostas se atraem, esse tipo de ligação que se estabelece é bem forte.
Os átomos dos elementos doam ou recebem definitivamente elétrons nas ligações para ficarem estáveis. Segundo a regra do octeto, para ficar estável, o átomo deve possuir 8 elétrons na sua camada de valência (última camada eletrônica) ou 2 no caso de átomos que só possuem a camada K. Desse modo, o átomo fica com a mesma configuração de um gás nobre, tornando-se estável. É por isso que os gases nobres são os únicos elementos químicos encontrados isolados na natureza.
Para você entender como esse tipo de ligação se estabelece, vejamos um exemplo: a formação do cloreto de sódio (NaCl), isto é, o sal de cozinha.
O átomo de sódio (Na) possui no estado fundamental o número atômico igual a 11, o que significa que ele também possui 11 elétrons distribuídos em suas três camadas eletrônicas, como é mostrado abaixo:

Átomo de sódio
Por outro lado, o cloro possui número atômico igual a 17, tendo seus 17 elétrons distribuídos em suas três camadas eletrônicas da seguinte forma:
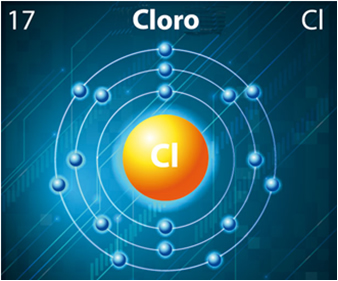
Átomo de cloro
Observe que o sódio possui um elétron na sua camada de valência (é por esse motivo que ele pertence à família 1 da Tabela Periódica). Assim, o átomo desse elemento tem a tendência de doar esse elétron, ficando com oito elétrons na sua última camada e formando o cátion com carga +1 (Na+1), porque ele perdeu somente um elétron, ficando com um próton (carga positiva) a mais.
Já o cloro possui sete elétrons em sua camada de valência (ele pertence à família 7A ou 17), precisando receber mais um elétron para ficar estável. Assim, ele tem a tendência de ganhar um elétron e tornar-se um ânion de carga -1(Cl-1):
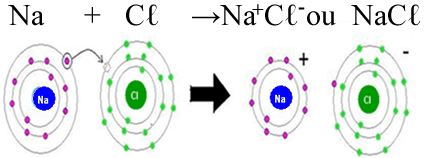
Formação do cloreto de sódio por meio de ligação iônica
Aqui foi representada somente uma ligação. No entanto, na realidade, vários íons desses se atraem, formando aglomerados de forma geométrica definida, denominados de retículos cristalinos. É por isso, por exemplo, que o sal tem a forma de pequenos cristaizinhos:
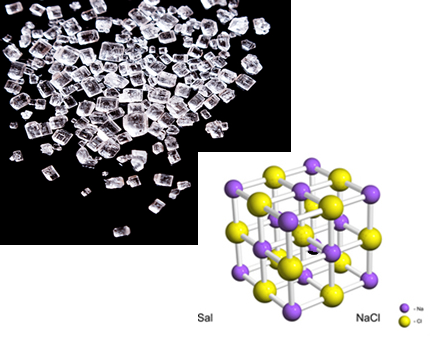
Cristais de sal e retículo cristalino
Aproveite para conferir nossas videoaulas relacionadas ao assunto:


