Atividade 3 – Propriedades Específicas da Matéria
TEMPERATURA DE FUSÃO, TEMPERATURA EBULIÇÃO, DENSIDADE E A SOLUBILIDADE
Conteúdos e temas: propriedades das substâncias – temperaturas de ebulição e fusão, densidade, solubilidade; importância das propriedades para caracterizar substâncias.
Competências e habilidades: empregar a linguagem química para representar transformações químicas; construir e interpretar tabelas e gráficos com dados de propriedades das substâncias.
Estratégias de ensino: levantamento das ideias dos alunos; leitura e discussão do texto e das
questões para a interpretação do texto; atividade experimental; uso de objetos de aprendizagem (simulação).
Sugestão de recursos: material para experimentos e textos.
Sugestão de avaliação: atividades e questões propostas.
A temperatura em que uma substância sofre fusão e aquela em que há vaporização por ebulição são características de cada substância, portanto, importantes para identificá-las.
O que é ponto de ebulição? É a temperatura na qual um liquido vence a pressão atmosférica, passando para o estado gasoso (mudança de estado).
Em altitudes diferentes, uma mesma substância apresenta pontos de ebulição diferentes. Quanto maior a altitude, menor é a pressão atmosférica, e menor é o ponto de ebulição. Além da pressão atmosférica, o ponto de ebulição depende da polaridade das substâncias: Para substâncias apolares – Quanto maior o peso molecular, maior será o ponto de ebulição – Para substâncias de peso molecular próximo, a ramificação abaixa o ponto de ebuliçãoPara substâncias polares – Para substâncias de peso molecular próximo, a mais polar tem maior ponto de ebulição – Substâncias que estabelecem ligações de hidrogênio (pontes de hidrogênio) têm ponto de ebulição extremamente elevado.

Substância pura
É qualquer material que apresenta as propriedades físicas definidas, determinadas e praticamente invariáveis nas mesmas condições de temperatura e pressão.
Misturas
São constituídos por mais de uma substância (componentes) e cujas propriedades físicas variam para cada amostra nas mesmas condições de temperatura e pressão. Exemplo: sangue.
Para o estudo das temperaturas de ebulição e fusão, acompanhe a construção de um gráfico de temperatura versus tempo de aquecimento de uma amostra de água no estado sólido até chegar ao estado gasoso.




Mudanças de Estado Físico

O que caracteriza e define um estado físico da matéria são as forças atuantes em seu interior; coesão, a qual tende a aproximar as partículas, e repulsão, a qual tende a afastá-las. Quando a força de coesão supera a de repulsão, a substância se apresentará na fase de agregação chamada de sólido, quando as forças apresentarem a mesma intensidade, teremos um líquido, quando a de repulsão superar a de coesão, teremos então um gás.
 Cada um desses estados físicos distingue-se dos outros, entre outros fatores, por sua forma e volume. O estado sólido apresenta forma e volume constante, o líquido forma variável e volume constante, e o gasoso, forma e volume variáveis.
Cada um desses estados físicos distingue-se dos outros, entre outros fatores, por sua forma e volume. O estado sólido apresenta forma e volume constante, o líquido forma variável e volume constante, e o gasoso, forma e volume variáveis.

Na fase de agregação sólida, as partículas não apresentam liberdade de movimento, cabendo-lhes apenas movimentos de ordem vibracional, e a matéria terá maior densidade molecular. No estado líquido, as partículas podem literalmente “rolar” umas sobre as outras. Já na fase gasosa, as partículas terão ampla liberdade de movimento, e a matéria estará em sua fase de menor densidade molecular possível.
A matéria pode apresentar-se em qualquer estado físico, dependendo dos fatores pressão e temperatura. Assim, de modo geral, o aumento de temperatura e a redução de pressão favorecem o estado gasoso, e pode-se dizer que o inverso favorece ao estado sólido.
DENSIDADE E A SOLUBILIDADE
Por que um isopor flutua em uma poça de água? Por que um lápis afunda em uma bacia com água? Por que a esponja flutua no início e depois afunda? Essas são perguntas relacionadas à densidade de um objeto qualquer e está relacionada ao líquido em que ele é colocado para flutuar ou afundar.
DENSIDADE: é a relação entre a massa de um determinado material e o volume que este material ocupa, ou seja, a densidade determina a quantidade de matéria que está presente em uma unidade de volume. Por exemplo, se colocamos um objeto que tem uma massa de 200 gramas e ocupa a área de 150 cm2, um celular, por exemplo, dentro de uma bacia com água ele afundará, e o volume de água deslocada por ele será igual a sua massa. A densidade pode ser calculada pela seguinte fórmula e é expressa em gramas por centímetro cúbico, que corresponde ao volume de água descolocada (g/cm3):
Densidade = massa / volume
Cada substância possui uma determinada densidade, podendo uma substância ser mais densa ou menos densa do que a outra. Mas para que saber isso? Se eu te disser que o chumbo é mais denso do que o alumínio, o que isso significaria? Significa que em um dado volume de chumbo há mais matéria que o mesmo volume de alumínio. Ou, de outra forma, se dois objetos feitos de materiais distintos (diferentes) de mesmo tamanho, possuírem pesos diferentes, significa que o de maior peso terá mais matéria ou material do que o de menor peso. A densidade nos auxilia na caracterização de uma substância.
Quando se trata de substâncias líquidas, a substância menos densa ficará acima da substância mais densa, como acontece com a água e o óleo. Mas a diferença na densidade dessas duas substâncias é fácil de ser percebida, pois o óleo não é solúvel ou miscível com a água.
Figura 1: Diferentes líquidos, de cores diferentes, demonstrando a densidade deles e de objetos, como as bolas de gude. Quanto mais em cima o líquido, menor a sua densidade. Quanto maior sua densidade, mais o líquido ou objeto se afunda. (imagem: http://www.invivo.fiocruz.br/)
Material necessário
- 1 Frasco cilíndrico alto, transparente e com tampa. Pode ser um vidro de maionese, por exemplo;
- Xarope de milho ou mel;
- Óleo vegetal;
- Álcool contendo algumas gotas de corante alimentício, para que sua separação possa ser visível;
- Água com corante alimentício de outra cor, também para ser visível e se diferenciar do álcool;
- Objetos pequenos de materiais diversos: bolinha de gude, pedaço de vela, bolinha de naftalina, rolha de cortiça…
Passo-a-passo
1º Coloque no frasco o xarope de milho ou mel;
2º Adicione cuidadosamente uma pequena quantidade semelhante de água contendo algumas gotas de corante, escorrendo-as pelas paredes do frasco;
3º Adicione a mesma quantidade de óleo vegetal por cima da água com corante;
4º Cuidadosamente adicione o álcool contendo algumas gotas de corante em cima do óleo;
5º Coloque pequenos pedaços de plástico, rolhas de cortiça, pedaços de vela, bolinhas de gude, e bolinha de naftalina, etc… Observe no cilindro que cada objeto flutuará em uma camada.
Observação: cuidado com a ordem de adição dos líquidos, pois apenas o óleo é imiscível com a água (não se misturam entre si). Assim a ordem de adição dos líquidos é importante para que estes não se misturem. O xarope pode se dissolver na água, porém, o processo é muito lento. Já o álcool só não se mistura com a água, pois estão separados pela camada de óleo. Os líquidos foram colocados na ordem decrescente de suas densidades, com o xarope de milho tendo a maior e o álcool a menor densidade de todos os líquidos. Os objetos irão flutuar apenas em um líquido que apresente uma densidade maior que a sua.
SOLUBILIDADE: Sempre ao abordar o tema solubilidade, existe uma afirmação que diz: “semelhante dissolve semelhante”, ou seja, uma substância polar tende a se dissolver num solvente polar e uma substância apolar tende a se dissolver em um solvente apolar. Assim, fica fácil de entender porque substâncias inorgânicas, como sais e ácidos, se dissolvem tão bem em água, ou porque o álcool e a água se misturam de maneira irreversível, já que, depois de mistura-los não podemos mais os perceber em separados, somente com os olhos, como acontece com o óleo e a água. Todos os sais são ácidos são polares. Em contrapartida, as substâncias orgânicas se dissolvem muito bem em solventes apolares, como a parafina na gasolina ou óleos no querosene. E é por esse mesmo motivo que água e óleo não se misturam (Figura 1).
Ovo que flutua na água
A densidade (d) é uma grandeza que relaciona a massa (m) de um material com o volume (V) por ele ocupado e pode ser expressa pela divisão abaixo:
densidade = massa ou d = m
volume V
Se um material possuir densidade menor que outro, ele irá flutuar sobre ele. O contrário também ocorre, quando o material tem densidade maior, ele afunda.
Para testar isso, vamos fazer uma experiência bem simples. Você vai precisar de:
- 3 ovos crus (você também pode usar o mesmo ovo se quiser);
- 3 copos de vidro;
- Sal;
- Colher;
- Água;
- Caneta;
- Etiquetas.
Siga os seguintes passos:
1. Usando a caneta e as etiquetas, identifique os dois copos, colocando os seguintes dizeres em cada um: “água sem sal”, “água com sal” e “mistura”;
2. Coloque água no primeiro copo;
3. Coloque o ovo e observe se ele afunda ou flutua;
4. Coloque a mesma quantidade de água no segundo copo;
5. Adicione sal e misture bem;
6. Acrescente o ovo e observe se dessa vez ele afunda ou flutua;
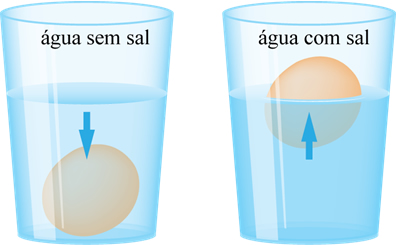
Esquema do experimento de densidade do ovo: na água pura, o ovo afunda; na água com sal, ele flutua.
7. Agora, você irá colocar no terceiro copo partes iguais da água sem sal e da água com sal;
8. Adicione o ovo cru e visualize onde ele se posicionará;
9- Adicione mais água doce e veja o que acontece;
10- Adicione mais água salgada e observe.
Explicação:
O ovo cru afundou no primeiro caso porque a sua densidade é maior que a da água. No momento em que acrescentamos sal na água, aumentamos a sua densidade e, dessa forma, o ovo flutua, pois sua densidade passou a ser menor que a da mistura de água e sal. Quando mais sal colocarmos, mais a densidade da água aumentará.
Isso pode ser visualizado no caso do mar Morto, em Israel, o corpo de água mais salgado do planeta (30% de salinidade). Em virtude disso, ele não consegue sustentar vida. Quando pessoas tomam banho no mar Morto, elas podem flutuar facilmente, como mostra a figura abaixo:

Mulher flutua facilmente em mar Morto
Os sais que ele contém são basicamente cloretos de magnésio, de sódio e de cálcio, que são levados até ele pelo rio Jordão e por outros rios, riachos e fontes menores. Só o rio Jordão deposita nele cerca de 850 mil toneladas de sal todo ano! Além disso, como ele se situa em uma região de baixa altitude, ele não escoa para nenhum lugar, apenas evapora, e os sais permanecem. Em um dia quente, pode acontecer de 7 milhões de toneladas de água evaporarem e, por isso, ele é o mar mais salgado que existe.

Sal do mar Morto na mão de uma pessoa
Agora, quando dosamos cuidadosamente a mistura da água com e sem sal, conseguimos produzir um líquido de densidade exatamente igual à do ovo, por isso ele não afunda nem flutua, mas permanece em suspensão no meio do líquido.
Dica:
Você pode usar esse experimento para verificar se o ovo está próprio para o consumo ou se está estragado. Se o ovo afundar, significa que você pode consumi-lo, está fresco. Isso acontece porque assim que é posto, ele preenche quase todo o volume no interior da casca e tem apenas uma pequena bolsa de ar.
No entanto, com o passar do tempo, o ovo vai perdendo água de seu interior pelos poros da casca e fica menos denso. Dentro de cerca de uma ou duas semanas, ele flutua o suficiente para se manter na vertical, no fundo do copo com água, mas ainda pode ser usado.
Mas quanto mais o tempo passa, mais a bolsa de ar vai crescendo e menos denso o ovo fica. Portanto, se ele flutua na superfície da água pura, ele não deve ser usado, pois pode causar uma intoxicação alimentar grave.
Referência
-
Maia, SRR. et. al. MANUAL DE AULAS PRÁTICAS DE UM LABORATÓRIO DE QUÍMICA COM MATERIAIS ALTERNATIVOS. Subprojeto PIBID/Química/FAEC-UECE, 2013.





