Conteúdos e temas: natureza elétrica da matéria – condutibilidade elétrica dos materiais, isolantes e
condutores.
Competências e habilidades: classificação e estabelecimento de critérios; controle de variáveis; elaboração
de modelo explicativo; ideias de Thomson, Rutherford e Bohr para o átomo; tabela periódica – estrutura
e propriedades dos elementos.
Estratégias de ensino: levantamento dos conhecimentos prévios; leitura de textos; experimentação para coleta de dados; organização dos dados em tabelas; proposição de questões para análise dos resultados; elaboração de conclusões; discussão geral.
Recursos: material experimental, cópias de roteiros e textos para os alunos.
Avaliação: respostas às questões e exercícios, elaboração de textos e outros
Modelo Atômico de Rutherford-Bohr

O modelo atômico de Rutherford dizia que o átomo seria formado por um núcleo com partículas positivas (prótons) e partículas neutras (nêutrons), além de uma eletrosfera, que seria uma região vazia onde os elétrons ficariam girando ao redor do núcleo. Porém, se o átomo fosse realmente assim, os elétrons, que são partículas negativas, iriam adquirir um movimento na forma de espiral e chocariam-se com o núcleo.
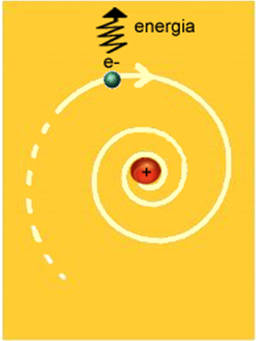
Mas isso não ocorre na prática. Por isso, em 1913, o cientista Niels Bohr (1885-1962) propôs um modelo que se baseou no modelo de Rutherford, apenas aprimorando-o, por isso ele passou a ser chamado de modelo atômico de Rutherford-Bohr.
Bohr se baseou também na teoria quântica da energia de Max Planck e nos espectros de linhas dos elementos para criar os seguintes princípios fundamentais:
- Os elétrons não se movem aleatoriamente ao redor do núcleo, mas sim em órbitas circulares, sendo que cada órbita apresenta uma energia bem definida e constante (nível de energia) ou camada eletrônica. para cada elétron de um átomo. Quanto mais próximo do núcleo, menor a energia do elétron, e vice-versa;
- Os níveis de energia são quantizados, ou seja, só são permitidas certas quantidades de energia para o elétron cujos valores são múltiplos inteiros do fóton (quantum de energia);
- Ele também mostrou que quando todos os elétrons dos átomos estão se movimentando em seus níveis respectivos de menor energia, o átomo está no seu estado fundamental, que é o mais estável. Para passar de um nível de menor energia para um de maior energia, o elétron precisa absorver uma quantidade apropriada de energia. Quando isso ocorre, dizemos que o elétron realizou um salto quântico e atingiu um estado excitado. Mas ele é instável e o elétron logo emite a energia excedente, retornando para o nível original de menor energia (estado fundamental), ele libera a energia que havia absorvido na forma de onda eletromagnética.
Esse último postulado explica porque os fogos de artifício emitem cores diferentes. Cada sal presente nos fogos de artifício possui um cátion de elementos químicos diferentes. Quando são aquecidos, os elétrons desses elementos saltam de nível de energia, mas quando voltam para o nível original, eles emitem a energia que foi absorvida na forma visível. Cada cor corresponde a uma quantidade de energia característica. Por exemplo, se usarmos um sal de cobre veremos a cor azul, já se usarmos um sal de bário, a cor emitida será a verde e assim por diante. Outras cores podem ser vistas no texto Química dos Fogos de Artifício.
Mas o estudo da natureza da luz proporcionou novas descobertas que ajudaram no desenvolvimento do modelo atômico. Os cientistas descobriram que, quando os gases dos elementos químicos diferentes passam por um prisma, eles produzem espectros descontínuos com linhas ou raias finas de cores diferentes. As cores são, na realidade, ondas eletromagnéticas visíveis, sendo que cada cor possui um comprimento de onda diferente. Assim, cada uma das linhas observadas nos espectros dos elementos corresponde a um comprimento de onda.
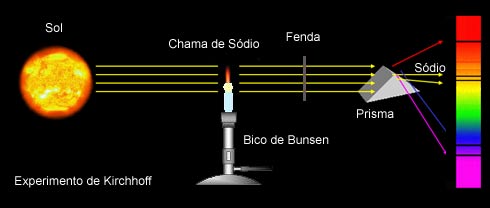
Por exemplo, se diferentes sais formados por diferentes elementos químicos forem colocados em uma chama de um Bico de Bunsen, notar-se-á que cada sal terá uma chama de uma cor diferente, conforme mostrado na figura abaixo:

Teste de chamas com cores diferentes (verde: cobre, rosa: lítio e amarelo: sódio)
Conforme a imagem seguinte mostra, para os elementos conhecidos até o momento, a quantidade máxima de níveis de energia são sete, sendo representados pelas letras K, L, M, N, O, P e Q:
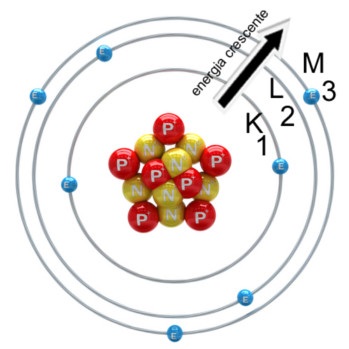
Modelo atômico de Rutherford-Bohr
Esse modelo, chamado de modelo atômico de Rutherford-Bohr, explica todos os fatos mencionados anteriormente. Por exemplo, cada elemento possui um espectro descontínuo porque os níveis de energia são quantizados, ou seja, possuem quantidades de energia definidas. Cada energia corresponde a um comprimento de onda.
Além disso, no experimento do teste de chama mencionado ocorre o seguinte: quando colocamos no fogo, os elétrons recebem energia e saltam para um nível mais externo. Mas como esse nível é instável, eles perdem essa energia na forma de radiação eletromagnética visível, que é a luz de cor distinta que visualizamos. Como os níveis de energia são diferentes de elemento para elemento, cada um emite uma cor em um comprimento de onda diferente.
Só para citar um exemplo, veja a figura abaixo. Observe que quando o elétron volta da órbita 4 para a 1, a luz emitida é de cor azul, quando ele volta da órbita 3 para a 1, a cor é verde, e da 2 para a 1, produz luz vermelha:
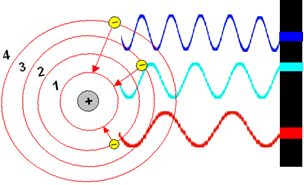
Três possíveis saltos do elétron de um elemento químico genérico
Videoaulas relacionadas:


