Conteúdos e temas: processos que permitem a obtenção de produtos a partir da água do mar: separação do sal por evaporação, eletrólise ígnea do cloreto de sódio, eletrólise da salmoura e processo Solvay para obtenção do carbonato de sódio; conceitos retomados: solubilidade de sais, constante de solubilidade, eletrólise e equilíbrio químico; conceito novo: perturbação de equilíbrios químicos por mudanças nas concentrações de espécies participantes.
Competências e habilidades: fazer uso da linguagem química para representar e expressar sistemas químicos em equilíbrio químico e transformações de oxirredução; interpretar dados apresentados em tabelas relativos à composição, à produção e ao consumo do cloreto de sódio e aplicar as informações obtidas para entender a importância da água do mar como fonte de matérias-primas; interpretar esquemas que representam processos industriais e relacioná-los com os conhecimentos que já possuem ou recém-aprendidos; reconhecer como fatores que afetam o equilíbrio químico são importantes na obtenção de produtos – processo Solvay; entender a importância da ingestão de iodo para a saúde; entender a importância de órgãos de fiscalização; refletir sobre como saberes escolares podem fundamentar escolhas e atitudes na vida cotidiana.
Estratégias de ensino: levantamento de ideias prévias, leitura de textos, discussões, resolução de problemas, pesquisa, trabalho individual, apresentação oral e aulas expositivo-dialogadas.
Recursos: textos, questões abertas e tabelas.
Avaliação: respostas às questões, participação na discussão de textos e realização de trabalhos individuais.
COBREAÇÃO
Introdução:
A eletrólise é uma reação de oxirredução não espontânea que é iniciada pela passagem de corrente elétrica em um meio em que os íons estejam livres. Isso pode ser conseguido por meio da fusão de substâncias iônicas (eletrólise ígnea) ou sendo feita em meio aquoso (eletrólise aquosa).
Entre outras aplicações, a eletrólise é muito usada para revestir peças com metais que se oxidam mais facilmente que o metal constituinte da peça, protegendo-o contra a corrosão. O nome desse processo é eletrodeposição e pode se dar de duas maneiras principais: por eletrólise de purificação e também por galvanoplastia.
A galvanoplastia reveste a peça, colocando-a como o cátodo em um circuito de eletrólise. Já a eletrólise de purificação é um tratamento metalúrgico do minério. O mais utilizado na indústria é a purificação do cobre, que pode ser vista com mais detalhes no texto “Eletrólise com Eletrodos Ativos” .
Esse efeito é conseguido resumidamente porque o cobre metalúrgico de uma placa funciona como o ânodo, liberando cátions que migram e se depositam sobre o outro polo, à medida que a corrente elétrica passa.
Nesse experimento iremos fazer uma cobreação, é o nome dado à galvanização de um metal realizada com Cobre. em que revestiremos uma chave de cobre. Esse experimento também pode ser feito com outros materiais feitos de metal, como moedas, parafusos.
Objetivo:
Mostrar uma das possíveis aplicações da eletrólise, identificando as reações envolvidas.
Materiais e reagentes:
- Bateria conectada a dois fios de cobre (o fio também pode ser conectado a uma placa de cobre, como mostrado nos objetos da imagem abaixo);
- Solução aquosa de sulfato de cobre (CuSO4);
- Frasco transparente (pode ser um copo ou um béquer);
- Uma chave.
Procedimento experimental:

- Coloque no frasco transparente a solução de sulfato de cobre;
2. Prenda a chave a um dos fios que saem da bateria;
3. Mergulhe-a na solução;
4. Coloque a ponta do outro fio na solução. Se você tiver um fio conectado na placa, mergulhe essa placa na solução;
5. Anote o que é observado tanto na cor da chave, como na cor da solução.
Resultados e Discussão:
A partir do que foi realizado e das explicações dadas em sala de aula sobre o conteúdo de eletrólise, o professor pode explorar dos alunos aspectos como: quem foi o cátodo, quem foi o ânodo, qual era o papel da solução aquosa de sulfato de cobre, quais foram as semirreações envolvidas, qual é a reação global, entre outros pontos relacionados.
A eletrólise é um processo em que se passa uma corrente elétrica sobre uma substância e, por meio de reações de oxirredução, o composto decompõe-se. Se a substância estiver no estado líquido (fundida), temos uma eletrólise ígnea, mas se estiver em solução aquosa, temos uma eletrólise em meio aquoso.
Materiais
a) 1 fonte de corrente contínua de 15V;
b) 2 conectores com bico de jacaré;
c) 1 frasco transparente;
d) 1 chave;
e) Sulfato de Cobre (CuSO4) concentração de 0,5 mol/L.
Procedimentos
Colocou-se no frasco transparente 55mL da solução de Sulfato de Cobre. Em seguida, com auxílio do conector com bico de jacaré, prendeu-se a chave ao pólo negativo da fonte de corrente contínua de 15V e introduziu-o na solução.
Logo após, usou o outro conector com bico de jacaré para ligá-lo ao pólo positivo da fonte de corrente contínua de 15V e introduziu-o na solução.
Ligou-se a fonte de corrente contínua e baixou-se a voltagem para evitar que o recipiente estourasse, deixou-se a chave imersa na solução por 10 minutos.
Passado o tempo,retirou-se a chave da solução e verificou-se os resultados.
Procedimento Experimental:
• Ligamos o fio de cobre na bateria;
• Em seguida, colocamos uma moeda presa ao lado preto do fio;
• Mergulhamos os fios em uma solução de CuSo4 . 5 H2O;
•Assim, a moeda foi mudando de cor, ficando cobreada;
• O cobre sofreu redução, liberando gás oxigênio;
• Determinamos que a solução formada na equação global, era ácida após colocarmos o papel de tornassol e observarmos que ele ficou de coloração rosa.
Esquema:
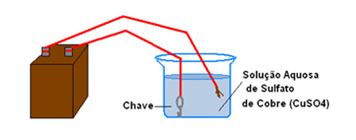
Resultados:
CuSO4 → Cu+² + SO4-²
2H2O → 2H+ + 2OH- (x2)
Cu+² + 2e → Cu (redução;cátodo (-))
2OH → H2O + ½ O2 + 2e (oxidação; ânodo; (+))
➢ Equação global
CuSO4 + H2O → 2H+ + SO4-² + Cu + ½O2
ELETRÓLISE DO CLORETO DE SÓDIO
A eletrólise do cloreto de sódio na forma ígnea produz gás cloro e sódio, já a eletrólise do sal em meio aquoso produz os gases cloro, hidrogênio e soda cáustica.?
A eletrólise é um processo em que se passa uma corrente elétrica sobre uma substância e, por meio de reações de oxirredução, o composto decompõe-se. Se a substância estiver no estado líquido (fundida), temos uma eletrólise ígnea, mas se estiver em solução aquosa, temos uma eletrólise em meio aquoso.
Uma das eletrólises de maior importância comercial é a do cloreto de sódio (NaCl), o sal de cozinha.
* Eletrólise ígnea do cloreto de sódio:
A eletrólise ígnea do sal produz o gás cloro (Cl2) e o sódio metálico (Na), substâncias que não são encontradas na natureza nessa forma. O sal funde-se a uma temperatura aproximada de 800ºC e, no estado líquido, o NaCl sofre disssociação, produzindo os seguintes íons:
NaCl → Na+ + Cl–
Na eletrólise ocorre a passagem da corrente elétrica segundo o esquema a seguir:
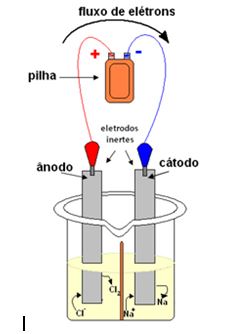
Esquema de processo de eletrólise ígnea do cloreto de sódio (sal de cozinha)
O polo negativo da bateria fornece elétrons para um dos eletrodos, que se torna o cátodo ou polo negativo.
Visto que ele é negativo, ele atrai os cátions Na+ que estão no líquido. Esses íons recebem os elétrons do cátodo e, nesse eletrodo, ocorre a seguinte semirreação de redução:
Semirreação no cátodo: redução: Na+(l) + e– → Na(s)
Nesse eletrodo foi formado o primeiro produto, que é o sódio metálico.
Por outro lado, o outro eletrodo torna-se o ânodo, pois está carregado positivamente, atraindo os ânions Cl–, que perderão seus elétrons, sofrendo oxidação:
Semirreação no ânodo: oxidação: 2Cl–(l) → 2 e– + 1Cl2(g)
Esse gás cloro fica borbulhando ao redor do ânodo, como mostra a reação a seguir. Ele é coletado por meio de um tubo de vidro adaptado ao sistema:
Esquema de processo de eletrólise do cloreto de sódio (sal de cozinha)
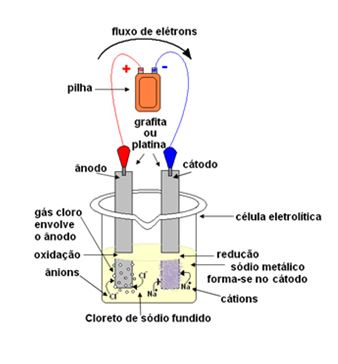
Assim, a reação global da eletrólise ígnea do sal é:
Cátodo: Na+(l) + e– → Na(s)
Ânodo: 2Cl–(l) → 2 e– + 1Cl2(g)____________
Reação Global: Na+(l) + 2Cl–(l) → Na(s) + 1Cl2(g)

Gás cloro e sódio metálico – produtos da eletrólise ígnea do sal de cozinha
* Eletrólise aquosa do cloreto de sódio:
Nesse caso, além da dissociação iônica do NaCl, formando os íons Na+ e Cl–, existe também a reação de autoionização da água, conforme a equação a seguir:
2 H2O(l)→ 1 H3O+(aq) + OH1-(aq)
Então, surgem as dúvidas: Qual cátion será descarregado primeiro no cátodo, o Na+ou o H3O+? E no ânodo, o Cl– ou o OH– será descarregado primeiro?
Basicamente, podemos dizer que o íon menos reativo será o que descarregará em cada eletrodo.
O texto Eletrólise em meio aquoso explica detalhadamente como verificar qual é o cátion ou o ânion menos reativo e determinar como ocorre a eletrólise.
Entre o Na+ e o H3O+, o Na+ é um metal alcalino, sendo mais reativo. Por isso, a água recebe os elétrons do cátodo:
Semirreação no cátodo: 2 H+ + 2e– → H2
Agora, no caso dos ânions, o Cl– é menos reativo que o OH– e, por isso, sofre oxidação:
Semirreação no ânodo: 2 Cl– → Cl2 + 2e–
Veja a reação global dessa eletrólise:
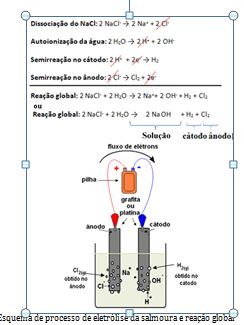
Esquema de processo de eletrólise da salmoura e reação global
Observe que a eletrólise de uma solução aquosa de NaCl produz soda cáustica (NaOH), gás hidrogênio (H2) e gás cloro (Cl2). Em virtude da presença da base NaOH, o meio permanece básico.


