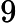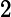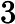Conteúdos e temas: dissolução de ácidos e bases em água; retomada do conceito de Arrhenius; construção empírica da expressão da constante de equilíbrio químico; relação entre o valor da constante de equilíbrio e a extensão de uma transformação química; extensão da dissociação iônica – força de ácidos e de bases.
Competências e habilidades: interpretar e analisar textos e tabelas que utilizam dados referentes à acidez de soluções; relacionar valores de pH com a extensão do processo de dissociação iônica; compreender o significado da constante de equilíbrio e saber aplicá-la na previsão da extensão das transformações.
Estratégias de ensino: discussão desencadeada por perguntas e análise de textos, fluxogramas, tabelas e esquemas.
Recursos: textos, tabelas, questões e esquemas.
Avaliação: respostas às questões e atividades propostas.
Como saber as quantidades de produtos e de reagentes que coexistem em equilíbrio QUÍMICO?
EQUILÍBRIO QUÍMICO
O equilíbrio químico é atingido quando, na mistura reacional, as velocidades das reações direta (reagentes formando produtos) e inversa (produtos formando regenerando os reagentes) ficam iguais.
Mas, em primeiro lugar, é importante entender que reação química é um processo onde reagentes se combinam e formam novas substâncias com propriedades diferentes. Algumas reações se processam totalmente, enquanto outras parecem parar antes de estarem completas. Isso tem a ver com a reversibilidade da reação. Em uma reação reversível os reagentes formam os produtos, mas os produtos reagem entre si e regeneram os reagentes.
Por exemplo, a produção da amônia ocorrendo em recipiente fechado, sob pressão e temperatura constantes:
N2 + 3H2 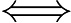 2NH3
2NH3
O processo é dinâmico, ou seja, a reação ocorre nos dois sentidos. Consideremos a reação hipotética entre a mols de A e b mols de B, formando c mols de C e d mols de D:
aA + bB 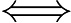 cC + dD
cC + dD
Inicialmente, observando uma determinada quantidade de A e B e concentrações de C e D nulas. No decorrer da reação, as concentrações de A e B diminuem e de C e D aumentam. A velocidade da reação inversa, que é nula a princípio, cresce continuamente com o tempo. A velocidade da reação direta diminui e da inversa aumenta, até que atinjam a igualdade. Nesse momento as substâncias A e B se formam na mesma velocidade em que são consumidas. As concentrações de reagentes e produtos não mais se alteram. Este é o instante no qual a mistura reacional atingiu o equilíbrio.
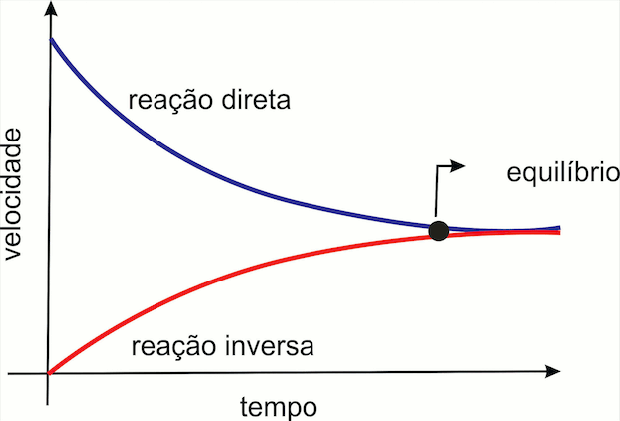
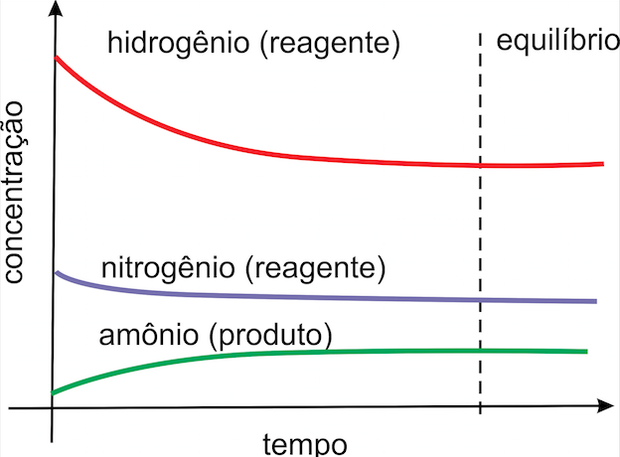
No estado de equilíbrio, mesmo com o sistema aparentando estar parado, as reações diretas e inversas continuam a ocorrer, com velocidades iguais. Por isso as concentrações das substâncias permanecem constantes. Por exemplo, na reação de produção de amônia:
CONSTANTES DE EQUILÍBRIO
Cálculo da constante de equilíbrio Kc
QUÍMICA
O cálculo da constante de equilíbrio Kc é realizado a partir da quantidade de reagentes que restou em equilíbrio e da quantidade de produtos formados.
As reações reversíveis geralmente iniciam com uma quantidade determinada de reagentes. Como a reação direta se inicia, com o passar do tempo, esses reagentes vão sendo consumidos para a formação dos produtos, consequentemente a concentração dos reagentes diminui enquanto a concentração dos produtos aumenta. Então, a reação inversa também começa, produzindo também os reagentes, até que a taxa de desenvolvimento (velocidade) das reações direta e inversa permanece a mesma, atingindo o chamado equilíbrio químico.
No equilíbrio, há a constante de equilíbrio Kc, que é expressa basicamente por:
| Kc = [produtos]coeficiente na equação química balanceada [reagentes]coeficiente na equação química balanceada |
Ou seja, considerando a seguinte reação genérica em equilíbrio:
a A + b B ↔ c C + d D
Tendo que as letras minúsculas são os coeficientes, e as letras maiúsculas são as substâncias, a constante de equilíbrio dessa reação será:
Kc = [C]c . [D]d
[A]a . [B]b
Mais detalhes sobre isso podem ser vistos no texto Constantes de equilíbrio Kc e Kp. Esse texto mostra-nos também algo importante: que os valores de Kc podem nos mostrar se a concentração dos reagentes e a dos produtos são iguais ou se uma é maior que a outra e, como consequência, se o equilíbrio químico está deslocado para algum sentido da reação.
Então, precisamos determinar o valor de Kc. Para tal, lembre-se de que esses cálculos são experimentais e, por isso, vamos analisar alguns exemplos de reações e os dados obtidos nelas.
Algo que serve muito de ajuda para realizar esses cálculos é escrever uma tabela semelhante à mostrada abaixo e seguir os passos mencionados nela:
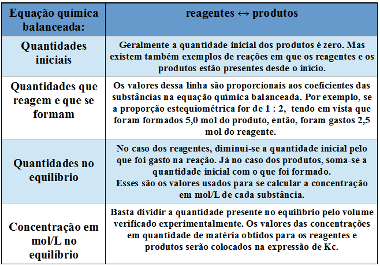
Tabela para organizar os dados usados no cálculo da constante de equilíbrio
Agora, vamos para a prática:
Exemplo 1:
Em um recipiente fechado, com capacidade de 2 L, em temperatura de 100ºC, há 20 mol de N2O4. Começa a ocorrer a seguinte reação reversível:
N2O4 ↔ NO2.
Após certo tempo, verificou-se que a reação atingiu o equilíbrio químico e que 8 mol de NO2 haviam se formado. Qual é o valor da constante de equilíbrio Kc em temperatura de 100ºC?
Vamos usar a tabela:
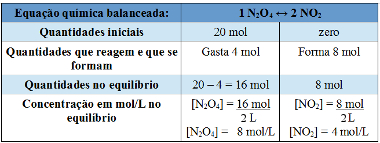
Tabela usada para resolver exemplo de cálculo da constante de equilíbrio
Observe que na linha em que foram escritas as quantidades que reagem e que se formam, sabemos que foram gastos 4 mol de N2O4, porque a proporção é de 1 : 2, e que foram formados 8 mol de NO2.
Agora basta substituir os valores encontrados na expressão da constante de equilíbrio Kc dessa reação:
Kc = [NO2]2
[N2O4]
Kc = (4 mol/L) 2
(8 mol/L)
Kc = 2 mol/L
O valor de Kc é adimensional, não possui unidade relacionada à alguma grandeza.
Agora, vejamos um exemplo, que contém também produtos desde o início:
Exemplo 2:
Em um recipiente fechado, com capacidade de 5 L, em temperatura T, há 2 mol de gás hidrogênio, 3 mol de gás iodo e 4 mol de iodeto de hidrogênio . A reação entra em equilíbrio químico, em temperatura T, e verifica-se que há 1 mol de gás hidrogênio no recipiente. Qual é o gráfico que representa esse equilíbrio e qual o valor da constante de equilíbrio Kc em temperatura de T?
Resolução:
Usando tabela:
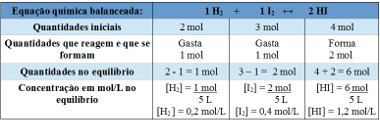
Tabela usada para determinação da constante de equilíbrio
O gráfico que mostra as variações das concentrações em mol/L dos reagentes e dos produtos até atingirem o equilíbrio pode ser dado por:
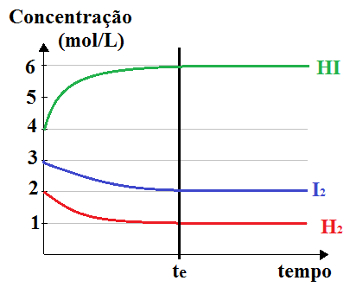
Gráfico do equilíbrio químico que mostra as variações das concentrações dos reagentes e dos produtos
Agora descobrimos o valor da constante de equilíbrio:
Kc =__[HI]2__
[H2 ] . [I2]
Kc = (1,2)2
0,2 . 0,4
Kc = 18
(UFPB) Se 1 mol de H2(g) e 1 mol de I2(g), em um recipiente de 1 litro, atingirem a condição de equilíbrio a 500 ºC, a concentração de HI no equilíbrio será:
Dado: Kc = 49.
a) 2,31.
b) 5,42.
c) 1,56.
d) 3,29.
e) 4,32.
(PUC-RS) Um equilíbrio envolvido na formação da chuva ácida está representado pela equação:
2SO2(g) + O2(g) ↔ 2SO3(g)
Em um recipiente de 1 litro, foram misturados 6 mols de dióxido de enxofre e 5 mols de oxigênio. Depois de algum tempo, o sistema atingiu o equilíbrio; o número de mols de trióxido de enxofre medido foi 4. O valor aproximado da constante de equilíbrio é:
a) 0,53
b) 0,66
c) 0,75
d) 1,33
e) 2,33
EXERCÍCIO
(PUC-RJ 2008) Reações químicas dependem de energia e colisões eficazes que ocorrem entre as moléculas dos reagentes. Em sistema fechado, é de se esperar que o mesmo ocorra entre as moléculas dos produtos em menor ou maior grau até que se atinja o chamado “equilíbrio químico”.
O valor da constante de equilíbrio em função das concentrações das espécies no equilíbrio, em quantidade de matéria, é um dado importante para se avaliar a extensão (rendimento) da reação quando as concentrações não se alteram mais.
Considere a tabela com as quantidades de reagentes e produtos no início e no equilíbrio, na temperatura de 100°C, para a seguinte reação:
 Tabela com quantidade de reagentes e produto (Foto: Reprodução)
Tabela com quantidade de reagentes e produto (Foto: Reprodução)A constante de equilíbrio tem o seguinte valor:
a) 0,13
b) 0,27
c) 0,50
d) 1,8
e) 3,0