SOLUÇÕES
CONCENTRAÇÕES DAS SOLUÇÕES
Conteúdos e temas: Concentrações de soluções químicas é a relação entre quantidade de soluto e quantidade de solvente ou de solução.
Competências e habilidades: reconstruir o conceito de solubilidade em um nível mais amplo, como extensão da dissolução; compreender como as propriedades peculiares da água possibilitam a existência de vida no planeta; concluir, a partir da análise de dados experimentais, como a presença de solutos afeta as propriedades características da água; aplicar esses conhecimentos na resolução de problemas ambientais, industriais e relacionados à saúde.
Sugestão de estratégias de ensino: leitura e análise de tabelas; interpretação de gráficos; demonstrações
experimentais.
Sugestão de recursos: materiais para a realização de experimentos; descrição de experimentos; questões.
Sugestão de avaliação: trabalhos executados no decorrer das atividades; trabalho individual
DEFINIÇÕES
O que são concentrações de soluções químicas?
Concentrações de soluções químicas é a relação entre quantidade de soluto e quantidade de solvente ou de solução. A ideia é bem intuitiva. Um local onde tem muita gente concentrada indica que tem muita gente em um determinado espaço. Perceba que há uma relação de quantidade entre pessoas e espaço.O mesmo acontece com soluções!No caso de soluções essas quantidades podem ser expressas em mol, massa ou volume. E aí podem ser feitas as diversas combinações entre mol, massa e volume para obter uma relação de concentração.
Uma solução é uma mistura homogênea (tipo de mistura onde não é possível distinguir de forma individual cada um dos seus componentes) de um soluto (substância sendo dissolvida) em um solvente (substância que efetua a dissolução).As soluções são encontradas em quaisquer dos três estados físicos: gasoso, líquido ou sólido.
O ar, solução gasosa mais comum, é uma mistura de nitrogênio, oxigênio e quantidades menores de outros gases. Muitas ligas metálicas são soluções sólidas como o “níquel” das moedas (25% Ni, 75% Cu).
As soluções mais familiares estão no estado líquido, especialmente aquelas nas quais a água é o solvente.Quanto a proporção soluto/solvente, as soluções podem ser diluídas, concentradas, insaturadas, saturadas ou supersaturadas.
Podemos descrever uma solução contendo uma pequena quantidade de soluto como diluída e outra, contendo mais soluto na mesma quantidade de solvente como concentrada.
Solução saturada
Para entender o que é solução saturada, deve-se saber que, a uma determinada temperatura, o solvente consegue dissolver uma quantidade máxima de soluto.

Solução saturada é uma mistura que apresenta a maior quantidade de soluto que certa quantidade solvente consegue dissolver a uma determinada temperatura.
Como na solução saturada o solvente sempre dissolve o máximo de soluto, teremos visualmente, nesse caso, um sistema homogêneo, ou seja, com apenas uma fase.

Representações de soluções saturadas
Assim, se adicionarmos qualquer quantidade a mais do soluto na solução saturada, não haverá dissolução completa e essa quantidade adicionada a mais ficará no fundo do recipiente, se mais densa que o solvente, ou na superfície, se menos densa que o solvente.
A solução saturada, com quantidade de soluto que se aglomera no fundo do recipiente, pode receber um dos títulos propostos abaixo:
- Solução saturada com precipitado;
- Solução saturada com corpo de chão;
- Solução saturada com corpo de fundo.
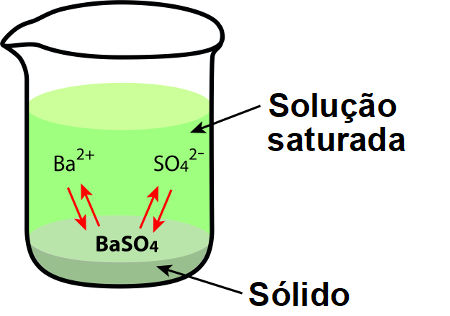
Representação de uma solução saturada com precipitado
Sem conhecer o coeficiente de solubilidade, que é a quantidade máxima de soluto que um solvente consegue dissolver a uma determinada temperatura, não é possível determinar se uma solução é saturada.
A seguir, veja alguns exemplos de formação de soluções.
1º Exemplo: Uma solução foi preparada com a adição de 20 g do soluto X a 100 g solvente Y a 10 oC. Sabendo que o coeficiente de solubilidade é de 15 g do soluto X por 100 g de solvente a 10 oC, podemos afirmar que temos uma solução saturada?
O coeficiente de solubilidade indica que 100 g do solvente Y dissolvem 15 g de soluto X a 10 oC. Como a solução foi preparada utilizando 20 g de X em 100 g de Y, logo o solvente dissolverá o seu limite, que é 15 g, e sobrarão 5 g de soluto não dissolvidos. Portanto, essa é uma solução saturada com corpo de fundo.
2º Exemplo: Uma solução foi preparada adicionando 40 g do soluto X a 200 g solvente Y a 25 oC. Sabendo que o coeficiente de solubilidade é de 20 g do soluto X por 100 g de solvente a 25 oC, podemos afirmar que se trata de uma solução saturada?
O coeficiente de solubilidade indica que 100 g do solvente Y podem dissolver 20 g de soluto X a 25 oC. A solução foi preparada utilizando 40 g de X em 200 g de Y, logo o solvente dissolverá o seu limite, pois 200 g de solvente dissolvem 40 g de soluto, assim como 100 g de solvente dissolvem 20 g de soluto. Portanto, temos uma solução saturada.
3º Exemplo: Uma solução foi preparada adicionando 25 g do soluto X a 100 g solvente Y a 30 oC. Sabendo que o coeficiente de solubilidade é de 35 g do soluto X por 100 g de solvente a 30 oC, podemos afirmar que temos uma solução saturada?
O coeficiente de solubilidade indica que 100 g do solvente Y dissolvem 35 g de soluto X a 30 oC. A solução foi preparada adicionando 25 g de X a 100 g de Y, assim, o solvente dissolverá uma quantidade inferior ao seu limite, que é 35 g, faltando 10 g de soluto para atingir o seu máximo de dissolução. Portanto, temos uma solução que não é saturada.
Atenção: Quando o solvente dissolve uma quantidade abaixo do seu limite, forma-se uma solução insaturada.
Quanto à condutividade elétrica, as soluções podem ser eletrolíticas ou iônicas. As partículas dissolvidas são íons, bons condutores de eletricidade. É o caso das soluções aquosas de ácidos, bases e sais.
E não–eletrolíticas ou moleculares onde as partículas dissolvidas são moléculas não conduzindo eletricidade. É o caso da sacarose em água.
Diluição de soluções
Fazemos uma diluição quando adicionamos mais solvente a uma solução já existente, de modo que a concentração da solução diminua. No cotidiano é muito comum realizarmos diluições. Por exemplo, geralmente os rótulos de sucos concentrados indicam que o preparado desses sucos deve ser feito acrescentando-se água numa proporção determinada. Quando fazemos isso, estamos diluindo o suco, sem modificar a quantidade de soluto. Em uma diluição, a quantidade de solvente e o volume da solução aumentam, enquanto a quantidade de soluto permanece igual. Como resultado, a concentração da solução diminui.Outro exemplo é adicionarmos água a algum produto de limpeza, como desinfetantes, para torná-lo menos concentrado ou adicionarmos água para diluir tintas para pintura.
Lembre-se que a solução é uma mistura homogênea formada por solvente e soluto.
Atenção: Não confunda diluição com dissolução. Quando estamos fazendo um suco e adicionamos o soluto (refresco em pó, por exemplo) ao solvente (água), está ocorrendo uma dissolução. Mas quando acrescentamos mais água a uma solução de água com refresco em pó, temos uma diluição.

Essa prática também é muito comum nos laboratórios, pois geralmente as soluções que são comercializadas vêm numa concentração bem alta e, de acordo com a finalidade, os cientistas preparam soluções mais diluídas a partir da solução inicial.Essas soluções costumam ser preparadas pegando-se uma alíquota, isto é, uma parte da solução inicial com uma pipeta, que é um instrumento utilizado para medir e transferir volumes de líquidos com alta precisão.
Essa alíquota é transferida para um balão volumétrico e, por último, acrescenta-se a água até atingir o volume desejado e indicado pelo balão volumétrico.Mas surge uma pergunta:

Como saber o volume da alíquota que se deve pegar para preparar a solução?
Bem, isso depende de qual concentração queremos que a solução tenha. Quando realizamos uma diluição, a massa do soluto permanece inalterada, como mostra a imagem abaixo:No entanto, a massa do solvente mudou e, consequentemente, a massa e a concentração da solução também mudaram.
Tendo em vista que a fórmula da concentração comum é dada pela divisão entre a massa do soluto pelo volume da solução, temos o seguinte:
Para entender o processo de diluição devemos conhecer a solução em seu momento inicial e após a adição de solvente:
- Concentração inicial: Ci = m1 / Vi
- Concentração final: Cf = m1 / Vf
Onde:
Ci / Cf = concentração inicial / concentração final
m1 = massa de soluto
Vi / Vf = volume inicial / volume final
Considerando que a massa de soluto não é alterada durante a diluição, temos a seguinte equação:
Ci . Vi = Cf . Vf
Por meio dessa relação é possível determinar a concentração da solução final. Veja um exemplo abaixo:“500 mL de água foram adicionados a uma solução aquosa de ácido sulfúrico (H2SO4(aq)) de volume inicial igual a 200 mL e concentração de 20 g/L. Qual a concentração da solução após essa diluição?”
Resolução:
Dados:Se a concentração inicial era de 20 g/L, isso significa que em cada litro da solução há 20 gramas de soluto (ácido sulfúrico) dissolvido. Assim, basta fazer uma regra de três para descobrir qual a massa do soluto que está dissolvida em 200 mL (0,2 mL) da solução:
20 g de ácido sulfúrico ——— 1 L de solução
m1 ——— 0,2 L
1 . m1 = 0,2 . 20
m1 = 4 g
Agora, para descobrir a concentração final basta usar a expressão abaixo:
Cinicial . Vinicial = Cfinal . Vfinal
(20 g/L) . 0,2 L = Cfinal . (0,2 L + 0,5 L)
Cfinal = _4g_
0,7L
Cfinal = 5,7 g/L
A mesma relação pode ser feita com a concentração em mol/L, com o título em massa e com a fração molecular, como mostra a tabela abaixo:
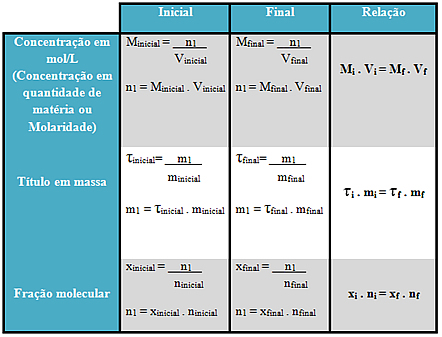
Mistura de soluções
Diferentemente dos primeiros exemplos, a mistura de soluções leva em conta uma ou mais substâncias. Elas não precisam ser necessariamente diferentes. Existem duas formas de abordar esse estudo. Na primeira, analisamos os casos em que os solutos não reagem entre si.
Imagine duas soluções iniciais: solução 1 (Si1) e solução 2 (Si2). O resultado da mistura que faremos delas irá dar origem à solução final (Sf). O volume do resultado, evidentemente, será muito maior, já que estamos adicionando uma quantia em outra quantia. Mas, como afirmamos anteriormente, os solutos não irão reagir no nosso resultado final. Nós podermos enxergar toda a matéria do soluto na Sf. Concluímos que:
- Si1 irá ser conservada
- Si2 irá ser conservada
- Quantidade de soluto no resultado final será a pura adição dos dois solutos
Se é verdade que a concentração é igual a massa do soluto sobre o volume (C = m¹/ V ), podemos dizer que a massa do soluto é dada através da concentração vezes o volume. Vamos ver o caso do nosso exemplo:
(Ci1 x Vi1) +( Ci2 x Vi2) = Cf x Vf
Traduzindo a fórmula acima: a primeira concentração inicial vezes o primeiro volume inicial mais a segunda concentração inicial vezes o segundo volume inicial é igual a concentração final vezes o volume final.
É preciso compreender, portanto, que a diluição funciona a partir da adição do solvente. No exemplo, é colocada a água para termos como resultado uma solução menos concentrada. Mas no caso das misturas de soluções, nem sempre o soluto é só a água. Por vezes há uma mistura, mesmo que não exista nenhuma reação. Temos como exemplo a água com sal, que, se misturada à outra água com sal, não haverá nenhuma reação, porque se trata da mesma substância.
Mas existe outro caso em que as substâncias adicionadas não são iguais, mas que, como no exemplo anterior, não sofrem reação. Imagine um recipiente cheio de água com cloreto de sódio. Ele é adicionado a outro, com água e brometo de sódio. Mesmo contendo substâncias diferentes em cada um, ambas possuem um íon em comum (no caso um cátion, que é o sódio). A partir da combinação, se houvesse alguma reação, daria uma solução final com cloreto de sódio e brometo de sódio. Ou seja, não consideramos uma reação, porque o produto final é igual o reagente.
Portanto, na mistura de soluções, não há reação em situações em que os solutos são iguais ou possuem partes da sua composição semelhantes um ao outro.
Exercícios Resolvidos
1. Ao diluir 100 mL de uma solução de concentração igual a 15g/L ao volume final de 150 mL, a nova concentração será?
Resolução:
Ci . Vi = Cf . Vf
15 . 100 = Cf . 150
Cf = 1500/150
Cf = 10g/L
2. Foram adicionados 200 mL de uma solução aquosa de glicose de concentração 60 g/L a 300 mL de uma solução de glicose de concentração 120 g/L. A concentração da solução final será:
C1 . V1 + C2 . V2 = Cf . Vf
60 . 200 + 120 . 300 = Cf . 500
Cf = 96 g/L
Exercícios
1. (UFV – MG) Em relação a uma solução diluída, podemos afirmar que:
2. (UEL) Misturam-se 200 ml de solução de hidróxido de potássio de concentração 5g/L com 300 ml de solução da mesma base com concentração 4g/L. A concentração em g/L da solução final vale:
a) 0,5
b) 1,1
c) 2,2
d) 3,3
e) 4,4
C1 = m1/ V1
5 = m1/ 0,2
m1 = 1 g
C2 = m2/V2
4 = m2/0,3
m2 = 1,2g
C = m1+m2/V1+V2
C= 1+ 1,2 / 0,2 + 0,3
C= 2,2/ 0,5 = 4,4g/L
Cálculos envolvendo diluição de soluções
QUÍMICA
Os cálculos envolvendo diluição de soluções abordam as concentrações comuns, título e molaridade.
Realizar cálculos envolvendo diluição de soluções é verificar a quantidade de solvente que foi adicionada ou retirada delas, o que resulta nas seguintes alterações possíveis para suas concentrações:
- Retirada de parte solvente: Quando parte do solvente é retirada de uma solução, a quantidade de soluto aproxima-se ou fica maior que a quantidade de solvente, tornando a solução concentrada.
- Adição de mais solvente: Quando a solução recebe uma quantidade extra de solvente, a massa dele passa a ser ainda maior do que a de soluto, tornando a solução diluída.
As fórmulas comumente utilizadas para realizar esses cálculos são:
a) Para molaridade:
Mi.Vi = VF.VF
Mi = molaridade inicial da solução
Vi = volume inicial
MF = molaridade final da solução
VF = volume final da solução
OBS.: Volume final é a soma do volume inicial com o volume adicionado (Vf = Vi + Va) ou a subtração do volume inicial pelo volume de solvente que foi retirado (Vf = Vi – Ve).
b) Para concentração comum:
Ci.Vi = CF.VF
- Ci = molaridade inicial da solução
- CF = molaridade final da solução
c) Para título em massa:
Ti. mi = Tf.mf
- Ti = Título inicial da solução
- mi = Massa da solução inicial
- Tf = Título final da solução
- mf = Massa da solução final
Veja alguns exemplos do uso das fórmulas acima em cálculos envolvendo diluição de soluções:
Exemplo 1: 50 g de uma solução de H2SO4 de 63% em massa são adicionados a 400 g de água. A porcentagem em massa de H2SO4 na solução obtida é:
a) 7%.
b) 9%.
c) 10%.
d) 12%.
e) 16%.
Dados do exercício:
mi = 50g
Pi = 63%
OBS.: Transformando a porcentagem fornecida para título inicial dividindo por 100, temos:
Ti = 0,63
TF =?
PF = ?
Antes de encontrarmos a porcentagem, devemos inicialmente determinar o valor do título final (TF) por meio da seguinte expressão:
mi.Ti = mF.TF
50.0,63 = 450.TF
31,5 = 450.TF
31,5 = TF
450
TF = 0,07
Após encontrarmos o valor do título final, basta multiplicá-lo por 100 para obtermos a porcentagem em massa do H2SO4 requerida:
P = TF.100
P = 0,07.100
P = 7%, Letra a).
Exemplo 2: A uma amostra de 100 mL de NaOH de concentração 20 g/L foi adicionada água suficiente para completar 500 mL. A concentração, em g/L, dessa nova solução é igual a:
a) 2.
b) 3.
c) 4.
d) 5.
e) 8.
Dados do exercício:
Ci = 20g/L
Vi = 100 mL
VF= 500 mL
CF = ?
Para determinar o valor da concentração final (CF), basta utilizar a expressão abaixo:
Ci.Vi = CF.VF
20.100 = CF.500
2000 = CF.500
2000 = CF
500
CF = 4g/L letra c).
Exemplo 3: Diluição é uma operação muito empregada no nosso dia a dia. Um exemplo é quando preparamos um refresco a partir de um suco concentrado. Considere 100 mL de determinado suco em que a concentração do soluto seja de 0,4 mol. L-1. O volume de água, em mL, que deverá ser acrescentado para que a concentração do soluto caia para 0,04 mol. L-1 será de:
a) 1000.
b) 900.
c) 500.
d) 400.
Dados do exercício:
Mi = 0,4 mol/L
Vi = 100 mL
OBS.: não é necessário transformar a unidade mL do volume inicial porque o exercício pede o volume adicionado também em mL.
Va = ?
VF= ?
MF = 0,004 mol/L
O enunciado não fornece o volume final (VF) e pede para calcular o volume adicionado (Va). Para tal, devemos antes lembrar que o volume final é a soma do volume inicial (Vi) mais o volume adicionado:
VF = Vi + Va
Adicionando o valor do volume inicial na expressão acima, teremos:
VF = 100 + Va
Assim, se substituirmos o VF acima na expressão para cálculos em diluição, poderemos encontrar o valor do volume adicionado:
Mi.Vi = MF.VF
0,4.100 = 0,04.( 100 + Va)
OBS.: Devemos multiplicar o 0,04 por cada dado no interior dos parênteses:
40 = 4 + 0,04.Va
40 – 4 = 0,04.Va
36 = 0,04.Va
36 = Va
0,04
Va = 900 mL, letra b).
Exemplo 4: Quando são diluídos 100 cm3 de uma solução 0,5 mol/dm3 para 0,2 mol/dm3, qual será o volume da nova solução obtida?
a) 2500 cm3
b) 250 cm3
c) 200 cm3
d) 2000 cm3
Dados do exercício:
Mi = 0,5 mol/dm3
Vi = 100 cm3
OBS.: não é necessário transformar a unidade cm3 porque todas as alternativas trazem resultados de volume em cm3.
VF= ?
MF = 0,2 mol/dm3
Para encontrar o valor do volume final, basta adicionar os valores fornecidos na expressão abaixo:
Mi.Vi = MF.VF
0,5.100 = 0,2.VF
50 = 0,2.VF
50 = VF
0,2
VF = 250 cm3 – letra b).
referência deste texto em um trabalho escolar ou acadêmico? Veja:
DIAS, Diogo Lopes. “Cálculos envolvendo diluição de soluções”; Brasil Escola. Disponível em <https://brasilescola.uol.com.br/quimica/calculos-envolvendo-diluicao-solucoes.htm>. Acesso em 19 de maio de 2019.
Uma solução estoque de hidróxido de potássio (KOH) foi preparada pela dissolução de 5,6 g do soluto em água, obtendo-se, ao final, 200 mL. Posteriormente, um certo volume dessa solução foi diluído em 400 mL, obtendo-se uma nova solução de concentração igual a 0,30 mol.L–1. Determine o valor desse volume da solução estoque que foi diluído em 400 mL.
a) 255
b) 250
c) 240
d) 245
1º Passo: Calcular a massa molar do hidróxido de potássio (KOH).
Para isso, basta multiplicar a massa atômica de cada elemento pela quantidade de átomos na fórmula e, por fim, somar:
M1 = 1.MK + 1.MO + 1.MH
M1 = 1.39 + 1.16 + 1.1
M1 = 39 + 16 + 1
M1 = 56 g/mol
2º Passo: Calcular a concentração em mol/L da solução estoque.
Para isso, devemos utilizar na seguinte expressão a massa e o volume fornecidos pelo enunciado e a massa molar calculada no primeiro passo:
Mi= m1
M1.V
Mi= 5,6
56.0,2
Mi= 5,6
11,2
Mi= 0,5 mol/L
3º Passo: Determinar o volume da solução estoque que foi diluído.
Para isso, basta utilizar o que o enunciado forneceu – a concentração e o volume final após a diluição – e a concentração em mol/L da solução estoque, obtida no segundo passo:
Mi.Vi = Mf.Vf
0,5. Vi = 0,3.400
0,5. Vi = 120
VI = 120
0,5
VI = 240 mol/L
Assinale a alternativa que corresponde ao volume de água que foi adicionado a 800 mL de uma solução aquosa de sulfito de lítio, com 0,80 mol/L, para obter uma solução de 0,34 mol/L desse sal.
a) 1282 mL
b) 1182 mL
c) 1100 mL
d) 1082 mL
Letra d). Os dados fornecidos pelo exercício foram:
- Volume da solução inicial: 800 mL
- Concentração molar inicial: 0,80 mol/L
- Volume de água adicionado (Va): ?
- Concentração molar final: 0,34 mol/L
- Volume final (Vf): ?
1º Passo: Determinar o volume final.
Para isso, basta somar o volume inicial com o volume de água adicionado (que ainda não foi calculado):
Vf = Vi + Va
Vf = 800 + Va
2º Passo: Determinar o volume de água adicionado.
Para isso, utilizamos na fórmula a seguir os valores fornecidos pelo exercício e a expressão que foi montada no primeiro passo:
Mi.Vi = Mf.Vf
0,8.800 = 0,34.(800 + Va)
640 = 272 + 0,34.Va
0,34.Va = 640 – 272
Va = 368
0,34
Va = 1082 mL
Questão 3
Letra c). Os dados fornecidos pelo exercício foram:
-
Volume inicial: 400 mL
-
Concentração molar: 0,4 mol/L
-
Volume final: 200 mL
-
Concentração final, em mol/L, de íons cálcio: ?
Para determinar a concentração final, em mol/L, de íons cálcio, devemos realizar os seguintes passos:
1º Passo: Calcular a concentração molar de cloreto de cálcio após a diluição utilizando os dados fornecidos na seguinte expressão:
Mi.Vi = Mf.Vf
0,4.400 = Mf.200
160 = Mf.200
Mf = 160
200
Mf = 0,8 mol/L
2º Passo: Determinar a concentração em mol/L de íons cálcio [Ca+2].
Para isso, basta multiplicar a concentração da solução final pela quantidade de átomos presentes na fórmula do cloreto de cálcio (CaCl2), que é igual a 1:
[Ca+2] = Mf.1
[Ca+2] = 0,8.1
[Ca+2] = 0,8 mol/L
QUESTÃO 3
(FMJ-SP) 400 mL de uma solução com 0,4 mol/L de cloreto de cálcio são aquecidos até que fiquem no recipiente 200 mL de solução. A concentração, em mol/L, de íons cálcio na solução resultante é:
a) 0,2.
b) 0,4.
c) 0,8.
d) 1,0.
e) 1,6.
QUESTÃO 4
(FPS-PE) A cefalotina, C16H16N2O6S2, é um antibiótico que possui ação bactericida e é utilizada em infecções variadas, incluindo a meningite. Um auxiliar de enfermagem precisa administrar 50,0 mL de uma solução de cefalotina 6,0.10–2 mol.L–1 em um paciente, e a enfermaria só dispõe de ampolas de 20 mL com concentração igual a 0,25 mol.L–1 de cefalotina. Calcule o volume de cefalotina 0,25 mol.L–1 que deve ser aspirado da ampola para administrar a dosagem prescrita.
a) 10 mL
b) 12 mL
c) 14 mL
d) 16 mL
e) 18 mL
https://exercicios.brasilescola.uol.com.br/exercicios-quimica


