AULA EXPERIMENTAL SOBRE INDICADOR ÁCIDO-BASE
ESTRATÉGIAS DE ENSINO-APRENDIZAGEM
Esta aula experimental sobre indicador ácido-base é realizada em três etapas e tem por objetivo mostrar a ação da fenolftaleína em meio ácido.
A fenolftaleína é um indicador ácido-base sintético que fica rosa em meio básico
A aula experimental sobre indicador ácido-base mostrada neste artigo tem por objetivo ajudar os alunos a observarem a ação do indicador chamado fenolftaleína. Apenas para relembrar: o indicador ácido-base é uma substância que pode ser natural ou sintética e que tem a propriedade de mudar de cor em função do pH do meio. Se estiver em um meio básico, terá uma determinada cor, e se estiver em meio ácido, a sua cor será outra.
A fenolftaleína é um exemplo de indicador ácido-base sintético muito usado em laboratório. Ela fica incolor em meio ácido e adquire uma coloração rosa intensa (como mostra a imagem inicial) em meio básico. O princípio de funcionamento da fenolftaleína pode ser visto no texto Indicadores de pH.
Além de usar essa atividade prática para explanar sobre o uso de indicadores ácido-base, o professor também pode usá-la para comprovar que o gás dissolvido na água gaseificada e nos refrigerantes, o gás liberado nos antiácidos efervescentes e o gás que nós expiramos é o mesmo nos três casos.
Outro ponto que pode ser abordado com esse experimento é o conteúdo de equilíbrio químico, pois a mudança de cor ocorre graças a um deslocamento do equilíbrio químico do indicador, conforme será explicado mais adiante.
Materiais e reagentes:
* Três copos transparentes ou béqueres;
* Solução de fenolftaleína (pode ser preparada pela dissolução de um comprimido laxante em álcool etílico);
* 1 canudo;
* Solução de amônia (podem ser usados também produtos de limpeza à base de amônia);
* Uma garrafa PET;
* Água;
* 1 comprimido efervescente;
* Água mineral com gás;
* Tubo plástico flexível (mangueira fina).
Procedimento Experimental:
Coloque água até a metade nos três copos, algumas gotas de fenolftaleína e algumas gotas de solução de amônia até que a cor fique rosa.
Esse experimento é dividido em três partes:
1ª parte: Determinação do gás dissolvido na água com gás e nos refrigerantes:
1- Adicione um pouco de água mineral com gás em um dos copos com a solução de fenolftaleína preparada;
2- Observe o que acontece.
2ª parte: Determinação do gás liberado pelos comprimidos efervescentes:
1- Faça um furo na tampa da garrafa PET e passe a mangueira;
2- Coloque água dentro da garrafa, adicione o comprimido efervescente e feche rapidamente a garrafa de modo que a mangueira fique dentro dessa solução;
3- Coloque a outra extremidade da mangueira dentro de outra solução de fenolftaleína preparada em um dos copos.
4- Observe o que acontece.
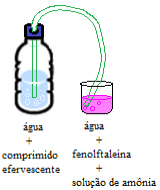
Esquema de experimento com indicador ácido-base fenolftaleína
3ª parte: Determinação do gás liberado quando expiramos:
1- Assopre com um canudo a solução de fenolftaleína do terceiro copo;
2- Observe o que acontece.
Resultado e Discussão:
Geralmente, os indicadores são um ácido fraco ou uma base fraca que entra em equilíbrio com a sua base ou ácido conjugado, respectivamente, que apresenta coloração diferente. Veja um exemplo:
Indicador ácido + H2O ↔ H3O+ + Base conjugada
(cor A) (cor B)
Quando esse indicador genérico entra em contato com um meio ácido, segundo o Princípio de Le Chatelier, o equilíbrio é deslocado no sentido de formação do ácido fraco, ficando com a cor A. Por outro lado, se o indicador entrar em contato com um meio básico, os íons OH– da solução básica reagirão com os íons H3O+ do indicador. Desse modo, o equilíbrio será deslocado no sentido de repor os íons H3O+, ou seja, para a direita, que é também o sentido de formação da base conjugada, e o sistema adquirirá a cor B.
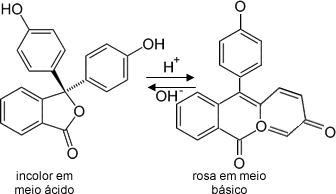
Comportamento do indicador fenolftaleína
Aplicando isso para o experimento, nos três casos o gás borbulhado nas soluções de fenolftaleína é o dióxido de carbono, mais conhecido como gás carbônico (CO2). A solução de amônia é básica e, por isso, quando ela entra em contato com a fenolftaleína, a solução fica rosa.
O gás carbônico liberado pelo pulmão, pelo comprimido efervescente e que está contido na água mineral gaseificada entra em contato com a solução, dissolve-se na água e torna a solução ácida, pois há a formação do ácido carbônico, conforme mostrado a seguir:
CO2(g) + H2O(l)→ H2CO3(aq)
Como o meio fica ácido, há um deslocamento do equilíbrio químico da fenolftaleína e a coloração rosa vai clareando até ficar incolor.
O que é o pH?
O que é pH? É um índice que indica a acidez, neutralidade ou alcalinidade de um meio qualquer.
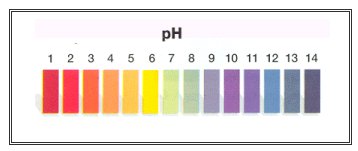
Indicador de Ph
O pH, potencial hidrogeniônico ou potencial hdrogênio iônico, é um índice que indica a acidez, neutralidade ou alcalinidade de um meio qualquer.
A escala do pH pode variar de 0 até 14, sendo que quanto menor o índice do pH de uma substância, mais ácida esta substância será, veja o pH de algumas substâncias:
Ácido de bateria – < 1,0
Coca-cola – 2,5
Água Pura – 7,0
Saliva Humana – 6,5 – 7,4
Cloro – 12,5
O pH menor que 7 indica que tal substância é ácida, para pH maior que 7 indica que a substância é básica e para substância com pH 7 indica que ela é neutra.
O valor do pH está diretamente relacionado com a quantidade de íons hidrogênio de uma solução e pode ser obtido com o uso de indicadores.
Os indicadores possuem a propriedade demudar de cor conforme o caráter da substância, se for ácido ou básico.
Um exemplo é o tersol e a fenolftaleína.
Na presença de ácidos, o papel de tornassol fica com a coloração vermelha e a solução de fenolftaleína saí de vermelha e fica incolor na presença de um ácido.
Você pode fazer estas experiências em sua casa, basta comprar um papel tornassol e mergulhá-lo em um copo de Coca-Cola que você poderá observar a mudança na cor.
É importante que você lembre que não é recomendável manipular substâncias com teor alto de acidez (ou com pH muito próximos a 0, geralmente menores que 2).
O pH
O valor de pH é uma característica que qualquer substância apresenta, determinado pela concentração de íons
de Hidrogênio (H+). Os valores variam de 0 a 14, sendo que valores de 0 a 7 são considerados ácidos, valores
em torno de 7 são neutros e valores acima de 7 são denominados básicos ou alcalinos. Quando o valor do pH
de uma substância é baixo, maior a sua concentração de íons H+ e menor a concentração de íons OH-.
| valor de pH | 0 | 7 | 14 |
| caracteristica | Ácido | Neutro | Básico ou Alcalino |
| concentração de íons H+ | + H+ | – H+ |
Medindo e alterando um pH.
Medir e alterar o valor de pH das substâncias é uma tarefa importante no cotidiano do homem. Veja alguns exemplos:
• Industrias:

- Fermentação;
- Fabricação de alimentos;
- Controle de qualidade de produtos;
- Fabricação de produtos de limpeza e desinfecção;
- Fabricação de ácidos para processos de corrosão e reações químicas;
• Estações de tratamento de águas:

- Água potável;
- Águas para processos industriais;
- Águas de torres de refrigeração;
- Efluentes;
• Laboratórios:

- Análise de substâncias;
- Desenvolvimento de novos produtos;
- Controle de qualidade;
Professor , após a leitura do texto peça aos alunos que façam uma relação em seus cadernos dos produtos
que serão usados no experimento classificando-os em: Ácidos, Neutros ou Básico/Alcalinos.
Soluções:
a) latas de coca-cola (1 normal e 1 light)
b) limão comum
c) cebola
d) garrafas de água mineral (1 com gás e a outra sem gás)
e) frasco de Veja multiuso
f) detergente incolor
g) xampu neutro
h) vinagre
i) café
j) leite
Atividade 2
Após os grupos terem classificado as soluções, forneça uma amostra de cada uma delas junto com duas
fitas indicadoras de pH comercial para cada solução e sua escala padrão de medição de pH. A medida de
pH deve ser tomada individualmente com a fita indicadora de pH mergulhada na solução e lida contra a
escala padrão enquanto estiver molhada. Em seguida deve ser descartada. Após a medição peça para
os alunos preencherem a tabela abaixo:
| Solução | papel indicador |
Depois de terem medido todas as soluções peça para que façam uma comparação entre a sua primeira
classificação das soluções sem o experimento e as obtidas com a fita de pH.
Promova a discussão sobre os resultados obtidos.
Avaliação
A atividade deve ser avaliada através da observação dos alunos durante a discussão dos resultados obtidos no levantamento de hipóteses e no experimento executado.
DETERMINAÇÃO DA ACIDEZ DE UM SUCO DE LIMÃO OU DE LARANJA
ESTRATÉGIAS DE ENSINO-APRENDIZAGEM
Por meio do uso de indicadores ácido-base naturais feitos de frutas (como amoras, jabuticabas e uvas) é possível realizar a determinação da acidez de sucos de laranja e de limão.
O experimento a seguir tem como principal objetivo determinar a acidez de diferentes amostras de sucos de limão e de laranja por meio de um indicador natural ácido-base.
Materiais e reagentes:
- 2 copos de vidro ou béqueres;
- Água;
- Amoras, jabuticabas, jambolão ou uvas;
- Solução de hidróxido de sódio a 0,1 mol . L-1;
- Um bastão de madeira ou um pistilo;
- Copo do tipo usado para espremer limão ou almofariz;
- Coador de café;
- Recipiente de vidro de 1L;
- Proveta de 50 mL;
- Conta-gotas.

Procedimento experimental:
Preparar antecipadamente a solução de hidróxido de sódio a 0,1 mol . L-1. Isso pode ser feito seguindo os seguintes passos a seguir:
- Pesar 4,0g de hidróxido de sódio (NaOH) em um béquer;
- Acrescentar água para dissolver o hidróxido;
- Esperar a mistura esfriar;
- Transferir a mistura para um balão volumétrico de 1L;
- Completar o volume de 1L com água, agitando para homogeneizar.
Com a solução pronta, podemos dar início ao experimento em sala de aula:
- Primeiro prepare a solução que será usada como indicador ácido-base, triturando, com o bastão de madeira ou o pistilo, aproximadamente 10g da fruta escolhida no copo (do tipo usado para espremer limão ou no almofariz);
- Acrescente água até cobrir o vegetal e continue triturando a mistura. Isso pode ser feito também em um liquidificador;
- Filtre a solução com o coador de café, colocando a solução de indicador-ácido-base obtida em um copo ou béquer;
- Colocar 10mL do suco de limão ou de laranja em um copo. Podem ser usados tubos de ensaio também, porém a quantidade da amostra deverá ser menor;
- Adicionar 15 gotas da solução de indicador;
- Anotar a cor obtida;
- Adicionar a solução de hidróxido de sódio com o conta-gotas bem devagar, anotando quantas gotas são necessárias para que a mistura adquira a coloração do ponto de viragem da titulação;
- Essa parte do experimento pode ser realizada também da mesma forma como é feita na titulação em laboratório de química: colocando o titulante na bureta, isto é, a solução de hidróxido de sódio e o titulado (a mistura do suco com o indicador) em um erlenmeyer.
Obs:- 1 gota equivale a 3 microgotas, então 20 gotas equivalem a 60 microgotas. Podemos obter uma relação entre mililitros e microgotas: Portanto, 1ml contém 60 microgotas.
Resultados e discussão:
Para melhores resultados, os alunos podem usar amostras de diferentes sucos de laranja e limão. Depois podem comparar entre si os resultados obtidos e colocar os materiais que foram analisados em ordem crescente de acidez, como o exemplo mostrado a seguir, sendo que nessa ilustração temos a escala para diferentes pHs, obtida com o extrato de amora, jabuticaba, jambolão e uva, respectivamente:



