Massa atômica
A massa atômica é a massa de um átomo ou de um elemento químico em relação a 1/12 da massa de um átomo de carbono-12.

A massa atômica é a massa de um átomo medida em unidade de massa atômica, sendo simbolizada por “u”. 1 u equivale a um doze avos (1/12) da massa de um átomo de carbono-12 (isótopo natural do carbono mais abundante, que possui seis prótons e seis nêutrons, ou seja, um total de número de massa igual a 12). Sabe-se que 1 u é igual a 1,66054 . 10-24g.
A seguir há uma ilustração em que o átomo de carbono-12 é considerado de acordo com o modelo atômico de Dalton(como uma esfera) e está dividido em doze partes iguais. Uma dessas partes corresponde a 1 u.
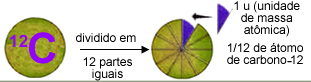
Exemplo de aplicação e interpretação da massa atômica
Se afirmarmos que a massa atômica de um átomo do elemento sódio (Na) é igual a 23 u, queremos dizer que 1 átomo de sódio é 23 vezes maior que a massa de 1/12 da massa do carbono-12.
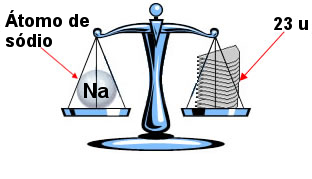
Nesse exemplo, consideramos a massa de um átomo de sódio como sendo igual a 23 u. No entanto, esse número é arredondado, o que costuma ser realizado nos cálculos de massa atômica no Ensino Médio.
Arredondamento do valor da massa atômica
A massa atômica de um átomo de hidrogênio é igual a 1,0079 u, mas costumamos usar somente o valor 1 u. Quando fazemos esse arredondamento, o valor da massa atômica fica exatamente igual ao número de massa (A) do elemento, ou seja, igual à soma dos prótons e dos nêutrons que existem no núcleo do átomo.
Em outro exemplo, se o sódio possui doze prótons e onze nêutrons (23), o hidrogênio possui somente um próton e o carbono possui, como já mencionado, seis prótons e seis nêutrons (12).
Massa atômica na Tabela Periódica
Na Tabela Periódica, a massa atômica de cada elemento costuma aparecer logo abaixo do símbolo, como mostrado na figura inicial deste texto. Porém, essas massas atômicas dos elementos químicos não são iguais às massas atômicas de cada átomo porque o elemento é formado por vários isótopos, ou seja, por átomos que possuem o mesmo número atômico (quantidade de prótons), mas que se diferenciam pela quantidade de nêutrons, o que resulta em um número de massa diferente e, consequentemente, em uma massa atômica também diferente.
Determinação da massa atômica em laboratório
A massa de um átomo é encontrada por meio de um aparelho chamado de espectrômetro de massa, que indica a massa de um isótopo com uma exatidão de seis casas decimais.

Determinação da massa atômica (cálculo)
Para determinar a massa atômica de um elemento, os isótopos que o constituem e a média ponderada (abundância) em que eles aparecem devem ser levados em consideração.
O elemento neônio (Ne), por exemplo, é formado por três isótopos: 20Ne, 21Ne e 22Ne. A abundância respectiva desses isótopos na natureza é de 90,92%, 0,26 % e 8,82%. Portanto, a massa atômica do elemento neônio é dada pela média ponderada desses três isótopos proporcionalmente à sua abundância. Veja:
MA do elemento neônio = (90,92 . 20) + (0,26 . 21) + (8,82 . 22)
100
MA do elemento neônio = 1818,4 + 5,46 + 194,04
100
MA do elemento neônio = 2017,9
100
MA do elemento neônio = 20,179 u
É essa a massa atômica que aparece para esse elemento na Tabela Periódica.
Relação entre massa atômica e massa molecular
A massa molecular corresponde à soma das massas atômicas dos elementos que compõem uma determinada substância. A molécula de água, por exemplo, é formada por dois hidrogênios e um oxigênio (H2O). A massa atômica do H é 1 e a do O é 16 u. Assim, a massa molecular da molécula de água é a soma dessas massas atômicas. Veja:
MM (H2O) = (1 u . 2) + (16 u . 1)
MM (H2O) = 18 u
Relação entre massa atômica e massa molar
A massa molar é a massa de 1 mol de substância, o que significa que é igual à massa molecular, mas é dada em g/mol, ou seja, a massa molar da água é igual a 18 g/mol.
Outro ponto interessante é que, como 1 mol de qualquer substância possui 6,02 . 1023 átomos (número de Avogadro), podemos simplesmente dividir a massa molar da substância pela constante de Avogadro para descobrir a massa em gramas de um átomo de qualquer elemento químico.
A massa atômica do hélio (He), por exemplo, é igual a 4,0 u e sua massa molar é 4,0 g/mol. Assim, temos:
1 mol de He —– 4,0 g ——– 6,02 . 1023 átomos
m ———– 1 átomo
m = 4,0 g
6,02 . 1023
m = 6,6 . 10-24 g
O texto Massa Atômica explica que essa grandeza é determinada experimentalmente e ela corresponde à massa do átomo comparada com um doze avos (1/12) da massa de um átomo de carbono 12, e a unidade adotada é o “u” (unidade de massa atômica).
Convencionou-se que 1/12 da massa de 1 átomo de carbono doze é igual a 1 u (1,66 . 10-24 g). Assim, quando dizemos que a massa atômica do oxigênio é 16 u, isso quer dizer que sua massa é 16 vezes maior que 1/12 da massa do 12C.
Portanto, a massa molecular também indica quantas vezes a massa da espécie química é maior que 1/12 da massa do isótopo do carbono-12.
Visto que a massa atômica dos elementos é determinada experimentalmente, ela aparece na Tabela Periódica para cada elemento químico, como mostrado na figura a seguir:

Massa atômica do elemento neônio
Assim, basta consultar a Tabela Periódica quando quisermos calcular a massa molecular de alguma substância.
Por exemplo, no caso da molécula de CO, sua massa molecular é igual a:
MM (CO) = (massa atômica do C) + (massa atômica do O)
MM (CO) = (12 + 16) u
MM (CO) = 28 u
Geralmente, para cálculos estequiométricos, utiliza-se a unidade em gramas. Assim, temos que a massa molecular do CO pode ser dada por 28 g/mol.
Mas se a molécula possui mais de um átomo de cada elemento, é necessário multiplicar a massa atômica de tal elemento pela quantidade de átomos que aparecem na fórmula. Veja alguns exemplos:
MM (H2O) = (2 . 1 u) + (16 u)
M (H2O) = 18 u
MM(H2SO4) = (2 . 1 u) (32 u) + (4 . 16 u)
M (H2SO4) = 98 u
MM (C2H6)= (2 . 12) + (6 . 1)
MM (C2H6)= 30 u
MM (C12H22O11)= (12 . 12) + (22 . 1) + (11 . 16)
MM (C12H22O11)= 342 u
Veja como isso é feito para uma fórmula que possui parênteses, lembrando que o índice vale para todos os elementos que estão dentro dos parênteses. Os elementos devem ser multiplicados pelos seus respectivos índices:
MM (Al2(SO4)3) = Temos 2 Al, 3 S (porque o índice fora dos parênteses vale para ele também) e 12 O (porque multiplicamos os índices de fora dos parênteses pelo índice de dentro (4 . 3))
MM (Al2(SO4)3) = (2 . 27) + (3 . 32) + (12 .16)
MM (Al2(SO4)3) = 54 +96 + 192
MM (Al2(SO4)3 ) = 342 u
No caso de moléculas hidratadas, calcula-se separadamente a massa molecular da molécula e da água para depois somá-las, levando em consideração a quantidade de moléculas de água. Veja como isso é feito:
MM (CuSO4 . 5 H2O) = Cu S O4 . 5 H2O
MM (CuSO4 . 5 H2O) = (1 . 63,5) + (1 . 32) + (4.16) + 5 (1 . 2 + 1 . 16)
MM (CuSO4 . 5 H2O) = (63,5 + 32 + 64) + (5 . 18)
MM (CuSO4 . 5 H2O) = 159,5 + 90
MM (CuSO4 . 5 H2O) = 249,5 u
QUANTIDADE DE MATÉRIA E SUA UNIDADE (MOL)
Mol
É usado para relacionar a quantidades de matérias, de substâncias. Seu uso é comum para simplificar representações de proporções químicas e no cálculo de concentração de substâncias.
Podemos fazer uma analogia com a “dúzia” que também é utilizada para descrever quantidades.
Exemplo:
Se eu falar que tenho uma dúzia de balas, eu terei 12 balas. Com o mol é a mesma idéia só que o valor não será 12(doze), mas uma quantidade de 6,022×1023 do que estiver sendo relacionado.
| Simplificando |
| 1 dúzia = 12 quantidades |
| 1mol = 6,022×1023quantidades |
Então Se em vez de eu dizer que tenho uma dúzia de balas eu falar que tenho 1(um) mol de bala, quer dizer que eu tenho 6,022×1023 balas,Para se calcular a quantidade de mol de uma molécula usa-se a seguinte formula:
Exemplos:
1) Tenho 60g de água (H2O), qual a quantidade de mols?
Primeiramente tem que se calcular a massa molecular da água:
H = 1u
O = 16u
Então a massa molecular vai ser: 2x(1u) + (16u) = 18u
Colocando esse valor na formula, teremos:
Massa molar
Está relacionada com a constante de Avogadro, e o seu valor numérico é o mesmo que a massa molecular, mas a unidade passa a ser gramas por mol (g/mol).
Exemplo:
1) A massa molecular da glicose (C6H12O6) é de 179,04u, qual é a sua massa molar?
Como a massa molar e a molecular tem o mesmo valor, o que vai mudar é a unidade, ou seja, a massa molar será de 179,04g/mol
Significa que para se ter 1 mol de glicose é preciso 179,04g.
Constante de Avogadro
Pela definição, pode-se concluir que 1 mol de qualquer elemento terá sempre o mesmo número de partículas. Esse número é denominado constante de Avogadro (NA) que, com aproximação de 4 dígitos, é igual a 6,022 1023 partículas por mol.
Exercícios
1) Em 72g de água qual a quantidade de mol?
2) Se tem 400g de NaOH qual é a quantidade de mol?
3) Sabe-se que a massa atômica de um elemento Z é igual a 240 u e sua se tem 38,4 g deste elemento, então qual será a quantidade de mol?
a) ( ) 0,166
b) ( ) 0,10
c) ( ) 16
d) ( ) 0,16
e) ( ) 166
4) uma dúzia corresponde a 12 unidades e 1 Mol corresponde á:
a) ( ) 1000000 unidades
b) ( ) 6,023 x1023 unidades
c) ( ) 6,023×1063 unidades
d) ( ) 8,023×1023 unidades
videoaulas
(FEI-SP) Se um átomo apresentar a massa atômica igual a 60 u, a relação entre a massa desse átomo e a massa do átomo de carbono 12 valerá?
a) 1.
b) 2.
c) 3.
d) 4.
e) 5.
QUESTÃO 2
Observe as afirmações a seguir e indique quais estão corretas:
- A unidade de massa atômica pode ser representada por u;
- A unidade de massa atômica é 1/12 da massa de um átomo de carbono;
- A unidade de massa atômica é 1/12 da massa do átomo de carbono de número de massa igual a 12;
- A massa atômica de um átomo é um número muito próximo de seu número de massa.
a) Todas.
b) Nenhuma.
c) Somente I, II e III.
d) Somente I, II e IV.
e) Somente I, III e IV.
QUESTÃO 3
Sabendo que a massa atômica de um átomo X é igual à massa de nove átomos de He, determine o número de átomos de carbono (12C), que apresenta uma massa igual à massa de um átomo X. (Massa atômica do He = 4).
a) 1.
b) 2.
c) 3.
d) 4.
e) 5.
QUESTÃO 4
(UFG) As medidas de massa são, na realidade, a comparação com um padrão definido de maneira adequada. O padrão adotado pela IUPAC para as medidas de massa atômica é um doze avos da massa do carbono – isótopo 12, que é denominado de unidade unificada de massa atômica.
Sobre massas de átomos, é correto afirmar que:
a) massa atômica é um número que indica quantas vezes a massa de um átomo é maior que um doze avos do carbono – isótopo 12;
b) os átomos de um mesmo elemento químico podem ter massas diferentes;
c) as massas atômicas são utilizadas atualmente para classificar os elementos da Tabela Periódica.
RESPOSTAS
Questão 1
Alternativa “e”.
x = 60/12 → x = 5
Questão 2
Alternativa “e”.
Na afirmação II, faltou dizer que é de um átomo de carbono 12.
Questão 3
Alternativa “c”.
MA (X) = 9 He
MA (X) = 9 . 4
MA (X) = 36 u
número de átomos de 12C = 36/12
número de átomos de 12C = 3.
Questão 4
a) Verdadeira.
b) Verdadeira.
c) Falsa. Atualmente são usados os números atômicos, e não as massas atômicas, para classificar os elementos da Tabela Periódica.


