Importância da diferenciação dos isômeros

Durante o estudo da Isomeria em Química Orgânica, talvez já tenha se perguntado qual a função deste conteúdo um tanto quanto confuso. O que vamos apresentar aqui é um triste relato do descaso da isomeria na aplicação de medicamentos.
É fato que os isômeros são tão parecidos que muitas vezes são confundidos, o que pode ser trágico em se tratando da saúde. Foi exatamente o que ocorreu na Europa na década de 1960, com o lançamento de um medicamento com efeito tranquilizante e sonífero nomeado de Talidomida. As gestantes da época procuraram por este efeito calmante sem ter ideia do que poderia ocorrer ao feto em gestação. Foi então que se registrou o nascimento de bebês com membros atrofiados (mãos, pés, pernas). Esse efeito teratogênico foi resultado do uso da Talidomida.
A talidomida apresenta dois isômeros:
(S) talidomida → teratogênica
(R) talidomida → efeito tranquilizante
Como vemos, a substância Talidomida, dependendo do isômero usado, produz efeitos completamente diferentes em nosso organismo, daí a importância do estudo da isomeria respectiva. A diferença pode ser percebida através das estruturas:
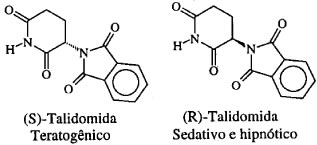
Isômeros óticos da Talidomida: uma simples mudança no posicionamento do N (nitrogênio central – um para frente e outro para trás) difere as duas estruturas.
A partir daí a mistura racêmica (presença de isômeros) dos medicamentos sintéticos foi banida pela Indústria farmacêutica. Desde então se aprimorou a produção de medicamentos quirais, que têm em sua estrutura os átomos (na maioria carbonos) com orientação tridimensional bem definida. Uma modificação dessa orientação ocasiona a diminuição ou mudanças nos efeitos biológicos, como ocorreu no caso da Talidomida.
Com o tempo, descobriu-se que somente o isômero dextrogiro ou (R) era responsável pelas propriedades analgésicas, sedativas e antessentires, enquanto a talidomida levogira (S)é teratogênica, isto é, provoca mutações no feto.
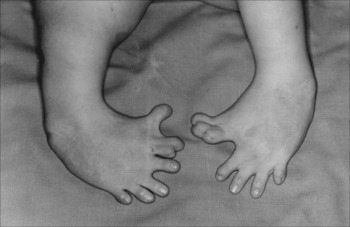
Por essa razão, durante as décadas mencionadas nasceram cerca de 12 mil crianças com má formação. Entre os efeitos colaterais que a talidomida pode causar nos fetos estão: desenvolvimento incompleto ou defeituoso dos membros, malformação no coração (como a ausência de aurículas), intestino, útero e vesícula biliar; efeitos nos músculos dos olhos e da face, surdez, defeitos na tíbia e no fêmur, além de, como a imagem a seguir mostra, polegar com três juntas:
Isomeria: entenda o conceito e saiba diferenciar todos os tipos
Ocorre isomeria quando temos compostos que possuem mesma fórmula molecular, porém estruturas diferentes.
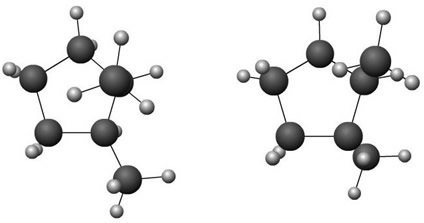
Em química, existem compostos que possuem mesma fórmula molecular, porém estruturas diferentes. Estes compostos recebem o nome de isômeros. A isomeria é dividida em duas partes: plana e espacial. Na figura, modelo das moléculas dos isômeros cis-1,2-dimetilciclopentano e trans-1,2-dimetilciclopentano.
Isomeria Plana
A diferença ocorre através de sua fórmula estrutural plana. Este tipo de isomeria pode ser classificada em: isomeria de posição, de cadeia, de função, metameria (isomeria de compensação) e tautomeria.
Isomeria Plana de Posição
Tipo de isomeria em que a diferença é observada pela mudança da posição da insaturação, do grupo funcional ou da ramificação. Note, na figura acima, a mudança de posição da dupla ligação para as estruturas de fórmula molecular C5H10.
Isomeria Plana de Cadeia
Estrutura molecular do butano C4H10
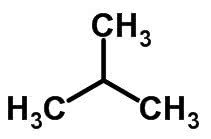
Estrutura molecular do metilpropano C4H10
Apesar de o butano e o metilpropano terem a mesma fórmula molecular, a cadeia do butano é aberta, enquanto a do metilpropano é ramificada. É daí que resulta uma estrutura molecular diferente.
São isômeros de cadeia. O ciclobutano é um composto de cadeia fechada de 4 carbonos com fórmula molecular C4H8, enquanto o but-2-eno possui cadeia aberta; sua fórmula molecular também é C4H8.
Isomeria Plana de Função
Esta isomeria se distingue pela função orgânica. Seus pares isômeros mais comuns são:
- Álcool e Éter
- Aldeído e Cetona
- Ácido carboxílico e Éster
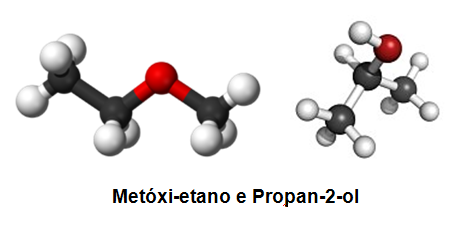
Na figura acima, temos o par álcool (propan-2-ol) e éter (metóxi-etano) representando esta isomeria.
Isomeria Plana de Compensação (Metameria)
Nesta isomeria, ocorre a diferença da posição do heteroátomo (átomo presente entre carbonos que não é hidrogênio). Comumente ocorre em funções que já possuem heteroátomo em sua estrutura, tais como: amida, amina, éter e éster. Na figura acima, vemos a isomeria entre dois éteres com mudança da posição do oxigênio.
Tautomeria
Não confundir com isomeria de função. Apesar de ocorrer alteração de função, este tipo de isomeria trata de compostos em equilíbrio dinâmico. Geralmente, este equilíbrio ocorre entre o enol e a cetona (isomeria ceto-enólica) ou o enol e o aldeído (aldo-enólica).
Isomeria Espacial
Diferente da isomeria plana, observada anteriormente, este tipo só é visto através de estrutura espacial. Então, pode-se defini-lo a partir de compostos com mesma fórmula molecular e plana, porém, com estruturas espaciais distintas. Seus tipos são: geométrica e ótica.
Isomeria Geométrica
A isomeria geométrica ou Isomeria cis-trans caracteriza-se pela estrutura geométrica apresentada por uma dupla de isômeros, que são os compostos sujeitos à isomeria.
Sua estrutura somente pode ser percebida quando a mesma é analisada em várias dimensões espaciais, ou seja, tridimensionais.
Observe as formas moleculares de uma dupla de isômeros:
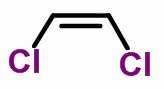
Forma molecular de cis-dicloroeteno C2H2Cl2
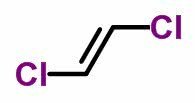
Forma molecular de trans-dicloroeteno C2H2Cl2
Quando há ligantes posicionados em paralelo (figura 1), a isomeria é chamada de isomeria geométrica cis. Quando há ligantes posicionados em transversal (figura 2), a isomeria é chamada de isomeria geométrica trans.
Isomeria Ótica
Isomeria óptica: é o tipo de Isomeria espacial que estuda o comportamento das substâncias submetidas a um feixe de luz polarizada. Algumas substâncias têm a propriedade de desviar o plano de vibração da luz, elas são, por isso, denominadas de isômeros ópticos.
Isso quer dizer que há substâncias orgânicas que têm a mesma fórmula molecular, mas que diferenciam-se pelo seu comportamento óptico em decorrência da exposição à luz.
Essas substâncias são chamadas de isômeros opticamente ativos.
Para entender a Isomeria óptica atente-se para o estudo da luz. A luz emitida por uma lâmpada incandescente é constituída de ondas eletromagnéticas, que se propagam com vibrações em infinitos planos, formando um movimento espiralado. Se essas vibrações passarem por um filtro, teremos então a luz polarizada: vibração em apenas um plano.
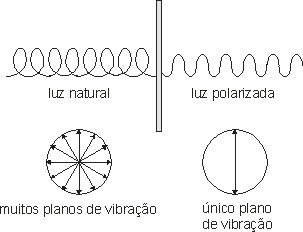
* Os aparelhos capazes de fazer essa conversão são denominados de polarizadores.
- A luz pode ser desviada para a direita. Nesse caso, essa substância é chamada de dextrogira, de dexter (direito em latim).
- A luz pode ser desviada para a esquerda. Nesse caso, essa substância é chamada de levogira, de laevus (esquerdo em latim).
Quando uma substância se comporta das duas formas citadas acima, ou seja, para a direita e para a esquerda, ela recebe o nome de enantiômero.
Os enantiômeros apresentam uma estrutura que se assemelha a uma imagem refletida num espelho, as quais não são sobreponíveis e, sim, especulares.
Por outro lado, se a luz não for desviada, quer dizer que sua atividade óptica é inativa.
Isso acontece quando há misturas de dextrogira e levogira em partes iguais, as quais recebem o nome de misturas racêmicas.
Como saber se um composto tem isomeria óptica?
Isso pode ser verificado mediante o uso de um polarizador. Há isomeria óptica quando o composto contém pelo menos um carbono assimétrico (C*), também chamado de carbono quiral.
O carbono assimétrico possui 4 ligantes diferentes, tal como mostra a imagem abaixo, em que não há substâncias iguais em torno do carbono:
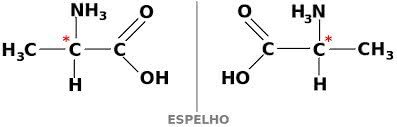
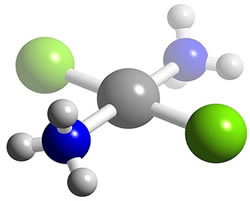
Imaginemos duas moléculas frente ao espelho (ilustrado por um traço):
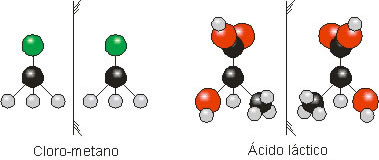
Repare que as moléculas de Cloro-metano são sobreponíveis (se sobrepõe), ou seja, a imagem refletida no espelho é exatamente igual (objeto = imagem). Já a molécula de Ácido láctico tem seu reflexo no espelho de forma invertida, as imagens não são sobreponíveis (objeto ≠ imagem). Trata-se dos isômeros ácido l-láctico e ácido d-láctico.
Essa análise é muito importante, uma vez que os aspectos fisiológicos destes isômeros se diferenciam. O ácido l-láctico é produto da fermentação de açúcares e o d-lático está presente nos músculos.
Só é possível detectar a diferença destes isômeros quando os mesmos são submetidos a um feixe de luz polarizada: eles desviam o plano de vibração da luz.
Exercícios
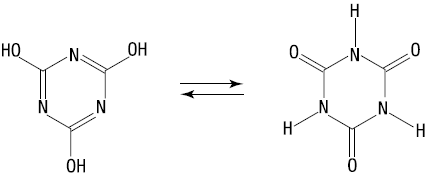
1) (UERJ –2009) O ácido cianúrico é um agente estabilizante do cloro usado como desinfetante no tratamento de águas. Esse ácido pode ser representado pelas duas fórmulas estruturais a seguir:
Em relação à isomeria, essas duas estruturas representam compostos classificados como:
a) oligômeros
b) tautômeros
c) estereoisômeros
d) diastereoisômeros
2) (UERJ – 2011 Exame discursivo Adaptada) O cravo-da-índia e a noz-moscada são condimentos muito utilizados na culinária, e seus principais constituintes são, respectivamente,o eugenol e o isoeugenol. Observe suas fórmulas estruturais:
Aponte o tipo de isomeria plana que ocorre entre essas duas moléculas e nomeie aquela que apresenta isomeria espacial geométrica.
3) (PUC) O ciclo butano e but-2-eno são isômeros:
a) geométricos
b) ópticos
c) posição
d) cadeia
e) compensação
Gabarito
1. B
A partir das fórmulas estruturais apresentadas para o ácido cianúrico, constata-se que os dois compostos são isômeros, pois apresentam a mesma fórmula molecular (C3N3O3H3). Como os compostos pertencem a funções diferentes e coexistem em equilíbrio químico dinâmico (como definido no resumo acima), eles são classificados como tautômeros.
2.
A isomeria plana que ocorre entre as duas moléculas é a do tipo posição. A diferença é observada pela alteração da posição das insaturações (ligação dupla).
A molécula que apresenta isomeria geométrica é o isoeugenol, que possui uma ligação dupla com dois substituintes diferentes em cada átomo de carbono.
Isomeria Espacial ou estereoisomeria é o tipo de isomeria cuja estrutura molecular das substâncias orgânicas apresenta diferentes estruturas espaciais.
Essas substâncias são chamadas de estereoisômeros.
Há dois tipos de isomeria espacial, a isomeria geométrica e a isomeria óptica.dextrogira. Mas, se a substância faz a luz desviar para a esquerda é chamada de levogira.
Se a luz é desviada tanto para a direita como para a esquerda, recebe o nome de enantiômero.
Os enantiômeros são substâncias cuja estrutura, se fosse colocada em frente a um espelho mostraria uma imagem que não poderia se sobrepor. Isso porque sua estrutura é especular, tal como as nossas mãos direita e esquerda.
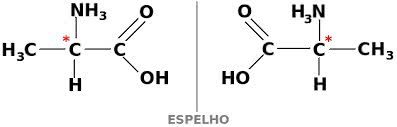
A mistura de substâncias dextrogiras e levogiras em parte iguais resulta na inatividade ótica. Quando há inatividade óptica as misturas são chamadas de misturas racêmicas.
Exercícios
1. (Vunesp-SP) Entre os compostos
I. C2H6O.
II. C3H6O.
III. C2H2Cℓ2.
apresentam isomeria geométrica:
a) I, apenas.
b) II, apenas.
c) III, apenas.
d) I e II, apenas.
e) II e III, apenas.
2. (FCC-SP) Um composto meso é opticamente inativo porque:
a) é uma mistura racêmica.
b) ainda não existem métodos de resolução satisfatórios.
c) ele é internamente compensado.
d) ele não pode ser superposto à sua imagem especular.
e) (a) e (c) estão corretas.