Conteúdos e temas: propriedades das substâncias – temperaturas de ebulição e fusão, densidade, solubilidade; importância das propriedades para caracterizar substâncias.
Competências e habilidades: empregar a linguagem química para representar transformações químicas;construir e interpretar tabelas e gráficos com dados de propriedades das substâncias.
Estratégias de ensino: levantamento das ideias dos alunos; leitura e discussão do texto e das questões para a interpretação do texto; atividade experimental; uso de objetos de aprendizagem (simulação).
Sugestão de recursos: material para experimentos e textos.
Sugestão de avaliação: atividades e questões propostas.
COMO RECONHECER QUE HOUVE UMA TRANSFORMAÇÃO QUÍMICA QUANDO NÃO HÁ EVIDÊNCIAS?
PROPRIEDADES DA MATÉRIA
Na Química, as propriedades físicas que se destacam: a temperatura de fusão, a temperatura de ebulição, densidade e a solubilidade.
São essas propriedades que caracterizam as substâncias, ou seja, que permitem diferenciá-las e identificá-las. Da mesma maneira que você distingue uma pessoa a distância por suas características físicas, como altura, cor dos cabelos etc, pode-se identificar uma substância conhecendo suas propriedades químicas e físicas. Nenhuma substância tem o mesmo conjunto de propriedades de outra.
Para executar determinada atividade em casa ou no trabalho, você precisa escolher a ferramenta certa. Para varrer a casa, uma vassoura ajuda muito mais do que, por exemplo, um pincel ou uma escova de dentes. Isso porque a vassoura tem propriedades, como tamanho das cerdas e comprimento do cabo, mais adequadas à aplicação que se tem em mente.
Com as substâncias químicas, acontece o mesmo. Ao preparar uma tinta para pintar paredes, por exemplo, um químico precisa escolher substâncias com propriedades indicadas a essa aplicação, como cor, odor, viscosidade e tempo de secagem. Portanto, as escolhas que você faz dependem das propriedades (químicas e físicas) que as substâncias possuem.
Interações e transformações químicas
Nem toda transformação química é acompanhada de evidências e nem toda evidência indica a ocorrência de uma transformação química.
O ser humano transforma os materiais da natureza para suprir suas necessidades. As interações entre materiais e entre materiais e energia podem gerar transformações químicas. Os materiais de partida (reagentes) dão origem aos novos materiais (produtos) nas transformações químicas.
Uma forma eficiente de se obter informações sobre a formação de novo material é investigando as suas propriedades, que naturalmente devem ser diferentes das propriedades das substâncias iniciais.
Considere como exemplo a queima do magnésio. Comparando-se as propriedades das substâncias que compõem o sistema no estado inicial com as propriedades das substâncias no estado final, pode-se concluir que de fato a queimado magnésio é uma transformação química, pois o óxido de magnésio apresenta propriedades diferentes do magnésio e do oxigênio.
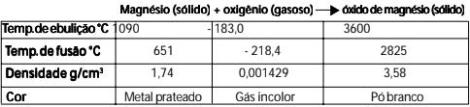
Propriedades das substâncias.
As substâncias podem ser identificadas por suas propriedades características. A cor e o cheiro, por exemplo, podem identificar uma dada substância, porém, tais propriedades não são suficientes para identificá-la ou distingui-la de uma outra. As propriedades, como a temperatura de fusão, a temperatura de ebulição, a densidade e a solubilidade, são propriedades que servem como meios de identificação das substâncias, pois dependem apenas da natureza delas e independem de sua quantidade ou sua procedência.
Desde o princípio, o ser humano tem buscado modificar o ambiente que o cerca, seja por necessidade de proteção e segurança, para obtenção de alimentos ou por fatores estéticos. Independentemente dos motivos, desde cedo aprendeu a transformar a matéria disponível, de modo que ela passasse a suprir seus anseios e necessidades, das mais básicas às mais supérfluas.
Quase sempre essa modificação da matéria envolve a formação de substâncias diferentes daquelas que já existiam. Outras vezes busca-se, ao contrário, impedir a ocorrência de transformações na matéria.
As transformações da matéria, na maioria das vezes, envolvem a interação entre diferentes materiais ou entre materiais e alguma forma de energia. Assim, vale a pena considerar a importância do domínio da produção e manutenção do fogo pelo ser humano desde os tempos mais remotos, nas mais diversas áreas da vida: alimentação, segurança, conforto etc.


Historicamente, o homem primitivo começa a perceber as transformações químicas com o domínio do fogo. Naturalmente observou que a madeira ao ser queimada se transformava em cinzas, que as rochas do solo chegavam a se fundir, tomando uma aparência mais resistente. Com o domínio de produzir o fogo o homem primitivo passou a tirar vantagens, afugentando as feras, não tendo medo da escuridão e também, nas regiões mais frias as noites passaram a ser mais quentes (devido ao calor liberado pela combustão).
Nota-se, que esse conhecimento proporciona mais segurança e gera um crescimento da espécie humana devido a melhor condição de vida. A utilização do fogo trouxe vários benefícios sendo, um deles, o cozimento dos alimentos diminuindo a contaminação por bactérias que eram responsáveis por muitas doenças da época primitiva. Essas mudanças proporcionaram melhores condições de vida, além do crescimento populacional da época.Com o domínio de produzir o fogo o homem primitivo passou a tirar vantagens, afugentando as feras, não tendo medo da escuridão e também, nas regiões mais frias as noites passaram a ser mais quentes (devido ao calor liberado pela combustão).
Benefícios da utilização do fogo

Mais segurança. O cozimento dos alimentos diminuiu a contaminação por bactérias que eram responsáveis por muitas doenças da época primitiva.Melhorou a condição de vida. Maior crescimento populacional da época.

Os recipientes de barro (argila) tiveram transformação ao serem levados ao fogo, adquirindo uma resistência em sua superfície, beneficiando utensílios para o preparo dos alimentos.

O domínio dos recursos naturais, como as ligas metálicas (bronze, latão, aço, etc.) geram o conhecimento sobre a metalurgia e siderurgia, e assim outras áreas do conhecimento vão surgindo.

O desenvolvimento da civilização foi surgindo à medida que suas habilidades nas transformações da matéria foram sendo aperfeiçoadas, como: o vidro, as joias, as moedas, as cerâmicas e inevitavelmente as armas mais resistentes e eficazes. A liga de aço acelerou um profundo impacto da química sobre a sociedade. Assim, a força muscular foi sendo substituída por máquinas. Com meios de transporte melhores e maior produtividade das fábricas, o comércio e o mundo se transformam, simultaneamente.

Em casa, no trabalho, no lazer ou em qualquer lugar está ocorrendo transformações da matéria, como a situação de preparar um simples café, chá ou mesmo a dissolução de um suco em pó na água.

O fato de nós suarmos, respirarmos, digerirmos, pensarmos, raciocinarmos, ou seja, sobrevivermos nos leva a muita transformação química.
Fonte http://blogdequimicaeja.blogspot.com/2017/
Nem toda interação entre a energia e a matéria promove a formação de novas substâncias.
Pode ser que o estado físico do material sofra alterações sem que isso implique a formação de outro material. É o que ocorre, por exemplo, quando um artesão derrete parafina para a confecção de velas decorativas. A barra de parafina é aquecida em um recipiente até passar do estado sólido para o líquido a fim de ser moldada na produção da vela. No decurso da confecção da vela, a parafina líquida volta a ser sólida.
A parafina nesse processo sofreu alguma mudança em sua composição ou apenas em seu estado físico e sua
aparência?
Esse exemplo é diferente do que ocorre quando a vela é queimada. Nesse processo, a parafina e o oxigênio do ar são transformados em gás carbônico, vapor d’água e fuligem, e esse processo é acompanhado pela liberação de energia térmica e luminosa. Assim, no caso do derretimento da parafina, a interação não gera uma transformação na composição química da parafina.
Isso é bem diferente do que ocorre no caso da queima, na qual a interação gera uma transformação na composição química dos materiais de partida. As interações que geram transformações na composição química dos materiais de partida são chamadas transformações químicas.
Os materiais de partida, necessários para essa transformação, são chamados reagentes, e aqueles que são formados no fim do processo são chamados produtos da transformação química. Em outras palavras, pode-se dizer que nas transformações químicas ocorre a formação de novas substâncias, diferentes dos reagentes em sua composição e suas propriedades.
Em outras palavras, uma transformação química pode também ser entendida como um processo em que se forma um novo material.
Mudanças de estados físicos da matéria, depende da temperatura e da pressão.
Temperaturas de fusão e de ebulição
Você já estudou, no Ensino Fundamental, que as substâncias podem se apresentar em três estados físicos: o sólido, como o sal de cozinha; o líquido, como o álcool; ou o gasoso, como o gás oxigênio. Em nosso planeta a água é encontrada nesses três estados físicos; além disso, essa substância passa de um estado físico para outro naturalmente, isto é, sem a intervenção direta dos seres humanos.
As mudanças de estado físico de qualquer substância recebem os nomes indicados no diagrama a seguir.
Ocorre o aumento da temperatura e absorção de calor. Processo chamado de Endotérmico.
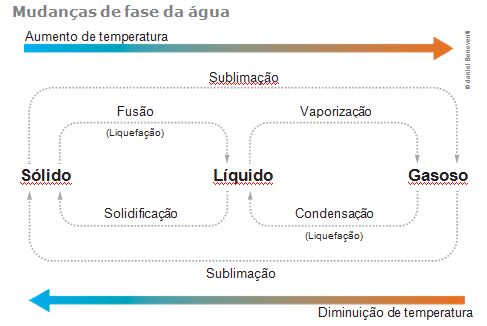
Ocorre diminuição da temperatura e liberação de calor. Processo denominado Exotérmico.
As mudanças de estados físicos, depende da temperatura e da pressão.
As transformações de estado físico da matéria apresentam denominações características, como se pode ver abaixo:
a) FUSÃO: representa a passagem do estado sólido para o estado líquido. A temperatura na qual ocorre recebe o nome de Ponto de Fusão. Por exemplo, o derretimento de um cubo de gelo.

b) VAPORIZAÇÃO: representa a passagem do estado líquido para o estado gasoso. A temperatura na qual ocorre recebe o nome de Ponto de Ebulição. Uma vaporização pode ocorrer de três modos distintos:
– EVAPORAÇÃO: passagem do estado líquido para o estado gasoso que envolve apenas a superfície do líquido. Por exemplo, a secagem de roupas em um varal.
– EBULIÇÃO:passagem do estado líquido para o estado gasoso por meio de aquecimento direto, envolvendo todo o líquido. Por exemplo, o aquecimento da água em uma panela ao fogão.

– CALEFAÇÃO: passagem do estado líquido para o gasoso de modo muito rápido, quase instantâneo. Por exemplo, gotas de água sendo derramadas em uma chapa metálica aquecida.

c) LIQUEFAÇÃO ou CONDENSAÇÃO: representa a passagem do estado gasoso para o estado líquido. Por exemplo, a umidade externa de um frasco metálico ao ser exposto a uma temperatura relativamente elevada.
d) SOLIDIFICAÇÃO: representa a passagem do estado líquido para o estado sólido. Por exemplo, o congelamento da água em uma forma de gelo levada ao refrigerador.

e) SUBLIMAÇÃO: representa a passagem do estado sólido para o estado gasoso ou o processo inverso, sem passagem pelo estado líquido. Por exemplo, a sublimação do gás carbônico sólido, conhecido por gelo seco, em exposição à temperatura ambiente.

Fonte:http://blogdequimicaeja.blogspot.com/2017/
CONHEÇA OS OUTROS 5 ESTADOS DA MATÉRIA
Desde o ensino fundamental fomos apresentados aos estados da matéria: sólido, líquido e gasoso. Essa era a resposta que todo mundo acertava. Aprendemos isso mais especificamente com a água, que é facilmente encontrada e visível nesses três estados. É fácil de explicar e de mostrar aos alunos.
No entanto, esses são apenas os três estados básicos da matéria e é agora que vem a surpresa: há no mínimo outros 5 estados possíveis. Essas que conhecemos são parte do nosso dia a dia e são as com que temos “contato” frequentemente, porém há outras formas.
Quando a matéria é exposta à situações extremas ou quando é manipulada em laboratório, muitas são as mudanças que podem ser causadas em suas moléculas.
Confira agora outros 5 estados possíveis da matéria.
1 – Plasma

O plasma é o estado mais abundante em nosso universo, apesar de você não estar familiarizado com ele. A forma do plasma é alcançado quando a água se decompõe, sua forma molecular H2O deixa de existir. O plasma é um gás ionizado quente, presente nas estrelas, nos buracos negros e na atmosfera terrestre.
2 – Sólido amorfo

O vidro é um exemplo dessa matéria. Nesse formato, as moléculas não estão tão organizadas quanto no estado líquido.
3 – Cristal líquido

Você pode não ver, mas provavelmente está interagindo com essa matéria agora mesmo. O cristal líquido está presente nos monitores de computadores e também nas telas de celular. Sua matéria está entre a solidez do cristal e o fluxo líquido. São partículas bem alinhadas que fluem com facilidade.
4 – Condensado de Bose-Einstein
Este é um estado da matéria quando exposta à situações extremas. O condensado de Bose-Eistein ocorre quando os átomos são resfriados perto do zero absoluto, quando isso acontece os átomos individuais formam um único objeto. Alguns acreditam que essas formações são na verdade estrelas invisíveis, que confundimos com buracos negros.
5 – Plasma de quarks e glúons

Esse estado é definido como um fluído quase perfeito. Nesse estado da matéria, ela é milhares de vezes mais quente que o próprio sol.
É importante que na atividade sejam destacadas as seguintes ideias:
- o ser humano transforma os materiais da natureza para suprir suas necessidades; as interações entre materiais e entre materiais e energia podem gerar transformações químicas;
- os materiais de partida (reagentes) dão origem aos novos materiais (produtos) nas transformações químicas a calcinação do calcário e a hidratação da cal são exemplos de transformações químicas.
- Atente-se para que os alunos possam construir o conceito de transformação química, conceito-chave no ensino de Química. Muitas pesquisas realizadas nas últimas três décadas têm mostrado que os alunos costumam apresentar dificuldades na construção desse conceito, embora seja quase consensual entre os
professores que o ensino desse conteúdo/conceito não é problemático. - Pesquisas indicam que alunos que passaram pelo ensino formal e foram aprovados nas avaliações realizadas podem considerar correto que: mudanças de estado físico ou de aparência das substâncias como sendo transformações químicas; a simples mistura de substâncias como sendo transformação química; fenômenos que ocorrem em organismos vivos, por exemplo, digestão e fotossíntese, como não sendo transformações químicas, pois, segundo eles, “são processos que ocorrem naturalmente”;
- Sempre será necessária mais de uma substância para que ocorra uma transformação química; um dos reagentes é mais importante que os outros;
- fenômenos que ocorrem espontaneamente ou sem a intervenção humana, como o enferrujamento, não são transformações químicas.
Essas ideias são concepções equivocadas ao conceito de transformação química e podem constituir entraves à aprendizagem de outros conteúdos desenvolvidos na Química.
Daí a importância de se estar atento às intervenções dos alunos e ter um olhar mais cuidadoso sobre seus “erros”, que podem revelar concepções sólidas e compartilhadas sobre o conceito de transformação química. Considerando essas concepções, você vai poder auxiliá-los melhor na reconstrução de suas ideias
– o que facilita a aprendizagem em Química na direção desejada.




