Competências e habilidades: classificação e estabelecimento de critérios; controle de variáveis; elaboração de modelo explicativo; ideias de Thomson, Rutherford e Bohr para o átomo; tabela periódica – estrutura e propriedades dos elementos.
Estratégias de ensino: levantamento dos conhecimentos prévios; leitura de textos; experimentação para coleta de dados; organização dos dados em tabelas; proposição de questões para análise dos resultados; elaboração de conclusões; discussão geral.
Avaliação: respostas às questões e exercícios, elaboração de textos e outros
Evolução dos modelos atômicos

Visto que não é possível visualizar um átomo isoladamente, os cientistas, com o passar do tempo, criaram modelos atômicos, ou seja, imagens que servem para explicar a constituição, propriedades e comportamento dos átomos. Esses modelos explicam o que diz a teoria, mas isso não quer dizer que fisicamente o átomo seja igual ao seu modelo.Os primeiros que imaginaram a existência dos átomos foram os filósofos gregos Leucipo e Demócrito em, aproximadamente, 450 a.C. Segundo eles, tudo seria formado por minúsculas partículas indivisíveis. Daí a origem do nome “átomo”, que vem do grego a (não) e tomo (partes).No entanto, essas ideias não puderam ser comprovadas na época, constituindo-se apenas como hipóteses. Assim, outras teorias tomaram o seu lugar, e o pensamento de que tudo seria composto por átomos ficou esquecido durante uma boa parte da história da humanidade.
Mas, no século XIX, alguns cientistas passaram a realizar testes experimentais cada vez mais precisos graças aos avanços tecnológicos. Com isso, não só se descobriu que tudo era realmente formado por minúsculas partículas, mas também foi possível entender cada vez mais sobre a estrutura atômica.Os cientistas usaram as informações descobertas por outros estudiosos para desenvolver o modelo atômico. Dessa forma, as descobertas de um cientista eram substituídas pelas de outros. Os conceitos que estavam corretos permaneciam, mas os que comprovadamente não eram reais passavam a ser abandonados. Assim, novos modelos atômicos foram criados. Essa série de descobertas da estrutura atômica até se chegar aos modelos aceitos hoje ficou conhecida como a evolução do modelo atômico.São quatro as principais teorias atômicas estudadas nessa evolução. Vejamos cada uma resumidamente*:* Modelo atômico de Dalton: Em 1803, Dalton retomou as ideias de Leucipo e Demócrito e propôs o seguinte:“ A matéria é formada por átomos, que são partículas minúsculas, maciças, esféricas e indivisíveis.”Esse modelo fazia uma analogia à estrutura de uma bola de bilhar. Todos os átomos seriam assim, diferenciando-se somente pela massa, tamanho e propriedades para formar elementos químicos diferentes.
O modelo atômico de Dalton baseava na estrutura de uma bola de bilhar* Modelo atômico de Thomson: Por meio de um experimento com uma ampola de Crookes (um tubo de vidro fechado com um eletrodo positivo e um negativo onde se colocavam gases em pressões baixíssimas e submetidos a altas voltagens), Thomson descobriu que existiam partículas negativas que compunham a matéria. Isso significava que o modelo de Dalton estava errado porque o átomo seria divisível, tendo em vista que ele teria partículas ainda menores negativas chamadas de elétrons.Visto que o átomo é neutro, cargas positivas também deveriam existir. Assim, J. J. Thomson propôs o seguinte em 1898:“ O átomo é constituído de uma partícula esférica de carga positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total é nula.”O modelo atômico de Thomson parecia com um pudim ou bolo de passas:
O modelo atômico de Thomson parecia com um pudim ou bolo de passas* Modelo atômico de Rutherford: Em 1911, o físico neozelandês Ernest Rutherford realizou um experimento em que ele bombardeou uma finíssima lâmina de ouro com partículas alfa (α) emitidas por uma amostra de polônio (material radioativo) que ficava dentro de um bloco de chumbo com um pequeno orifício pelo qual as partículas passavam.Por meio dos resultados desse experimento, Rutherford percebeu que, na verdade, o átomo não seria maciço como propôs os modelos de Dalton e Thomson. Veja o que ele propôs:“ O átomo é descontínuo e é formado por duas regiões: o núcleo e a eletrosfera. O núcleo é denso e tem carga positiva, ou seja, é constituído de prótons. A eletrosfera é uma grande região vazia onde os elétrons ficam girando ao redor do núcleo.”
O modelo atômico de Rutherford fazia uma analogia ao sistema solarEm 1932, o cientista Chadwick descobriu a terceira partícula subatômica, o nêutron. Dessa forma, o modelo de Rutherford passou a ter os nêutrons no núcleo junto aos prótons, ficando assim:.jpg)
Modelo atômico de Rutherford incluindo os nêutrons no núcleo* Modelo atômico de Rutherford-Bohr: Esse modelo recebeu esse nome porque, em 1913, o cientista Niels Bohr (1885-1962) propôs um modelo que se baseou no de Rutherford, apenas o aprimorando. Entre seus principais postulados, temos o seguinte:“Os elétrons movem-se em órbitas circulares, e cada órbita apresenta uma energia bem definida e constante (nível de energia) para cada elétron de um átomo.”Essas camadas eletrônicas ou níveis de energia passaram a ser representadas pelas letras K, L, M, N, O, P e Q, respectivamente, no sentido da camada mais próxima ao núcleo para a mais externa.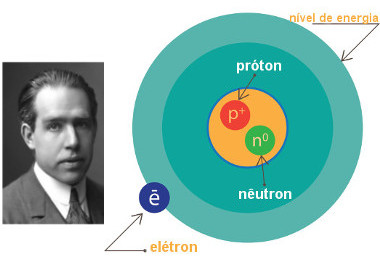
Representação do modelo atômico de Rutherford-BohrVeja na figura a seguir que, segundo esse modelo, as órbitas vão progressivamente sendo preenchidas pelos elétrons. Os átomos mostrados a seguir são dos primeiros oito elementos da Tabela Periódica: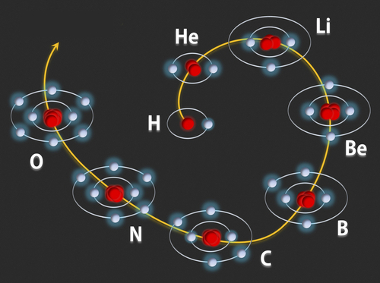
Forma como os níveis energéticos são progressivamente preenchidos por elétrons nos primeiros oito átomos da Tabela Periódica dos elementos
Estrutura do átomo
A estrutura do átomo é dividida basicamente em duas regiões: o núcleo, que é formado pelos prótons e nêutrons, e a eletrosfera, formada por elétrons e um grande vazio.

Ilustração de átomo – corresponde apenas a um modelo, e não à realidade
Falaremos aqui do modelo atômico mais estudado no Ensino Médio e que serve para explicar a maioria dos fenômenos físicos e químicos pelos quais a matéria passa. Segundo esse modelo, a estrutura do átomo apresenta basicamente duas regiões distintas, que são:* Núcleo: É uma região maciça, compacta e densa que fica no centro do átomo. O núcleo atômico é divisível, pois é constituído de duas partículas diferentes:– Prótons: são partículas carregadas positivamente com carga relativa igual a +1. Sua massa relativa também é de 1. O número de prótons existente no núcleo é chamado de número atômico (Z) e é o responsável pela diferenciação de um elemento químico de outro, ou seja, cada elemento químico é formado por um conjunto de átomos que possui o mesmo número atômico ou a mesma quantidade de prótons.- Nêutrons: como o próprio nome indica, essas são partículas neutras, isto é, não possuem carga elétrica. Assim, os nêutrons diminuem a força de repulsão entre os prótons no núcleo (tendo em vista que cargas de mesmo sinal repelem-se).Essas partículas subatômicas possuem a massa relativa praticamente igual à dos prótons, isto é, 1. Mas, na realidade, a massa do nêutron é um pouco maior que a do próton. Isso é interessante porque, se fosse o contrário, isto é, se os prótons fossem ligeiramente mais pesados do que os nêutrons, todos os prótons seriam transformados em nêutrons. O resultado seria que, sem os prótons, os átomos não existiriam.Para mais detalhes sobre os nêutrons, leia o texto A descoberta da terceira partícula subatômica: o nêutron.
Algumas curiosidades:
- O tamanho do núcleo depende da quantidade de nêutrons e prótons que ele possui. Entretanto, pode ser dito que, em média, o núcleo atômico tem o diâmetro em torno de 10-14 m e 10-15 m.
- O próton e o nêutron são partículas 100 mil vezes menores do que o próprio átomo inteiro!
- A massa do átomo é dada praticamente somente pelo número de prótons e nêutrons existentes no núcleo. Isso ocorre porque cada próton e cada nêutron são 1836 vezes maiores que um elétron. Por essa razão, a massa dos elétrons torna-se insignificante.
- Eletrosfera: É uma região periférica ao redor do núcleo átomo onde os elétrons ficam girando em volta deste núcleo.– Elétrons: Estes foram as primeiras partículas subatômicas descobertas (no anos de 1897, por J. J. Thomson). São partículas carregadas negativamente, cuja carga relativa é de -1. Sua carga em Coulombs é igual 1,6.10-19 C.Apesar de os elétrons serem negativos, o átomo no estado fundamental é neutro, pois ele possui a mesma quantidade de elétrons e de prótons. Isso significa que as cargas negativas dos elétrons anulam as cargas positivas dos prótons, assim, o átomo fica neutro.Quando os átomos realizam ligações químicas para formar as substâncias simples e compostas, isso ocorre com os elétrons. Há então uma transferência ou um compartilhamento de elétrons entre dois ou mais átomos.As ilustrações da estrutura do átomo são apenas modelos, mas não representam a realidade. Por exemplo, a maior parte do átomo é um grande vazio. Para você ter uma ideia, pense no átomo de hidrogênio formado por um próton e um elétron. Se o núcleo desse átomo fosse do tamanho de uma bola de tênis, o seu elétron orbitante estaria a uma distância de três quilômetros! A eletrosfera é maior que o núcleo do átomo cerca de 10 000 a 100 000 vezes.
- Em 1916, A. Sommerfeld propôs a existência de órbitas elípticas para o elétron, desenvolvendo uma quantização mais completa do seu movimento.
Esquema de estrutura do átomo com as principais partículas subatômicas 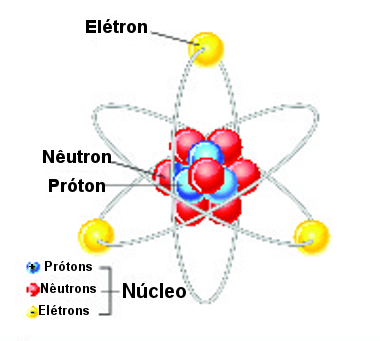 Em 1924, Louis de Broglie, partindo dos postulados de Planck e Einstein sobre a dualidade da luz como onda-partícula, disse que o elétron não poderia ser considerado uma partícula, pois possui propriedades de onda. introduziu o conceito de onda associada ao movimento corpuscular, sugerindo que o elétron pode ter tratamento parecido com o da luz.
Em 1924, Louis de Broglie, partindo dos postulados de Planck e Einstein sobre a dualidade da luz como onda-partícula, disse que o elétron não poderia ser considerado uma partícula, pois possui propriedades de onda. introduziu o conceito de onda associada ao movimento corpuscular, sugerindo que o elétron pode ter tratamento parecido com o da luz.
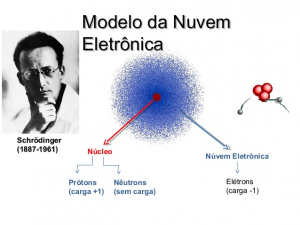
- No mesmo ano, Werner Heisenberg estabeleceu o seu “Princípio da Incerteza“, segundo o qual “não é possível determinar, simultaneamente, a posição e a quantidade de movimento (velocidade) do elétron“. Em 1926, Erwin Schrödinger tentou calcular a posição exata dos elétrons, porém obteve ‘somente’ uma equação, a equação de Schrodinger, responsável por calcular a probabilidade de um elétron estar em uma dada região da eletrosfera. Esta região, ele chamou de orbital. Este modelo foi chamado de modelo de nuvem eletrônica.
- AFINAL, ONDE ESTÁ E O QUE É O ELÉTRON?
A realidade microscópica parecia ser muito estranha: como uma partícula poderia se comportar como onda em alguns experimentos? O elétron não seria uma partícula? Mas como não seria, já que possui massa?
- O elétron se comporta como onda em algumas situações; e como partícula, em outras!
Enquanto onda, o elétron pode ser detectado em mais de um lugar, ao mesmo tempo.Uma pedra, jogada no centro de um lago, produz ondas que se propagam, podendo chegar a margens opostas.Pessoas diferentes podem assistir ao mesmo programa de rádio ou TV, porque recebem as mesmas ondas em seus aparelhos, em lugares diferentes.
Schrodinger definiu que cada elétron de um átomo possui um conjunto de quatro números quânticos, que determinam a energia e o formato da nuvem eletrônica deste átomo. Os números quânticos são:1- Número quântico principal ou n, definido cada número pelas camadas (K, L, M, N, O, P, Q);
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| K | L | M | N | O | P | Q |
2 – Número quântico secundário ou as sub camadas (l – s, p, d,f);
![]() 3 – Número quântico magnético (-l, 0, +l) .Subnível s: 0Subsível p: -1 0 1Subsível d: -2 -1 0 1 2Subsível f: -3 -2 -1 0 1 24- Número quântico spin (-½ e +½ ) , que indica o giro do elétron.
3 – Número quântico magnético (-l, 0, +l) .Subnível s: 0Subsível p: -1 0 1Subsível d: -2 -1 0 1 2Subsível f: -3 -2 -1 0 1 24- Número quântico spin (-½ e +½ ) , que indica o giro do elétron.
- NÍVEIS E SUBNÍVEIS NA ELETROSFERA
Mas não foi só isso. Novos estudos espectroscópicos (espectroscopia fina), usando lâmpadas fluorescentes com um elemento no estado gasoso, mostravam que não havia só as linhas de luzes coloridas nos espectros dos átomos, mas que muitas delas são formadas por linhas ainda menores.Em outras palavras, a eletrosfera do átomo não continha apenas as órbitas K, L, M, N, O, P e Q; mas também algumas delas tinham subdivisões energéticas, hoje conhecidas como subníveis “s”, “p”, “d” e “f” (“s”, sharp = nítida; “p”, principal; “d”, difusa; “f”, fundamental).Por exemplo, o nível de energia “M” possui os subníveis “s”, “p” e “d”. Como o nível “M” tem número quântico “3”, podemos chamar os seus subníveis de “3s”, “3p” e “3d”. - Linus Pauling estabeleceu a ordem energética dos subníveis, válida para qualquer elemento químico.
O “diagrama de Pauling” é tão importante, que define o formato da atual Tabela Periódica.Diagrama de Pauling Para ter a ordem correta de energia, o diagrama deve ser “lido”, descendo pelas linhas diagonais. Matematicamente, há infinitos níveis (oito, no diagrama acima); mas os átomos conhecidos apresentam até sete.Linus Pauling ( )Único laureado duas vezes com o Nobel, em áreas diferentes: Em 1954, de química, pela pesquisa sobre ligações químicas; e, em 1962, da Paz, devido à campanha contra os testes nucleares. Defendia o uso maciço de vitamina C para retardar o envelhecimento.Em 1926, E. Schrödinger e P. Dirac deduziram, separadamente, uma equação que descreve o movimento ondulatório do elétron, possibilitando o estudo da probabilidade de localizá-lo. Esse foi o “último suspiro” do conceito de “órbita”, desde que surgiu em 1911, com Rutherford. - “ÓRBITA” OU “ORBITAL”?Entender “órbita”, enquanto “trajetória” do elétron, não fazia mais sentido. Se o elétron não é uma “partícula”, não pode girar em torno do núcleo em órbitas circulares ou elípticas, como as dos planetas ao redor do Sol. Afinal, uma onda não descreve uma trajetória e, sim, “vibra” ao longo de um eixo.
- A densidade eletrônica em uma onda de elétrons
90% da densidade eletrônica está dentro dos dois lóbulos desenhados na onda de elétrons esses balões representam a região do espaço que contém 90% da densidade eletrônica para essa onda de elétrons em particular. Definição da forma de um orbital do tipo “p”.Regiões de maior “densidade eletrônica”, em torno do núcleo, foram calculadas e chamadas de “orbitais”. Dependendo de em qual subnível (s, p, d ou f) estão, os orbitais possuem formas geométricas diferentes. Por isso, foram chamadas também de orbitais “s”, “p”, “d” ou “f”.As regiões mais prováveis de se localizar o elétron em torno do núcleo foram chamadas de “orbitais”. - Subníveis “s” só possuem um orbital esférico.
Formas dos orbitais Subníveis “s” só possuem um orbital esférico.Subníveis “p” possuem três orbitais com forma de “duplo ovóide”.Subníveis “d” possuem cinco orbitais.Subníveis “f” têm sete orbitais. - Como cada nível (de 1 a 7) pode ter vários subníveis, é impossível desenhar o modelo orbital completo em um único desenho, devido à sobreposição dos orbitais de todos os níveis e subníveis. Obs.: Para o Ensino Médio, apenas as formas dos orbitais “s” e “p” são importantes, em especial para os estudos das ligações entre os átomos (ligações químicas) e de geometria molecular.
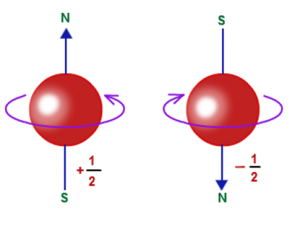
- Cada orbital admite um máximo de dois elétrons, mas pode estar totalmente sozinho ou parcialmente preenchido. Apesar de se repelirem devido às cargas iguais, admite-se que os dois elétrons de um mesmo orbital giram em sentidos opostos, horário e anti-horário (“spin”, do elétron). Com spins contrários, os dois elétrons criam campos magnéticos opostos, permitindo sua “convivência” no mesmo orbital.
- Costuma-se, então, representar os elétrons como setinhas para baixo ou para cima (sentido de rotação do spin), quando dentro de um mesmo orbital.
- Distribuição eletrônica por orbitais de um átomo neutro de cloro (17Cl). Cada setinha representa um elétron. Os subníveis “s” admitem até dois elétrons (um orbital); enquanto subníveis “p” admitem até seis elétrons (três orbitais).Podemos escrever a mesma distribuição por subníveis: 1s2 2s2 2p6 3s2 3p5; e por “níveis” ou “camadas”: K=2, L=8 e M=7.
- K1s2 L2s22p6 Q7s27p6 N4s24p64d104f14 O5s25p65d105f14 P6s26p66d10
- Diagrama de Pauling com a capacidade eletrônica total dos orbitais
Diagrama de Pauling com a capacidade eletrônica total dos orbitais. Os números em sobrescrito representam o total de elétrons do subnível; mas um átomo pode ter o último subnível incompleto. O ferro (26Fe), por exemplo, tem sua distribuição terminada em 3d6; e não 3d10. O hidrogênio (1H), elemento mais simples, tem a distribuição 1s1; e não 1s2.O diagrama só pode ser “lido” na horizontal, caso se queira saber a quantidade de elétrons por nívelnível de energia (camada). Mas esse número estará correto, caso sua distribuição eletrônica tenha sido feita descendo as diagonais. - COMO FAZER DISTRIBUIÇÕES ELETRÔNICAS
Como vimos, o diagrama de Pauling estabelece a ordem de energia dos subníveis. Para fazer, de forma segura, a distribuição eletrônica de qualquer átomo devemos seguir as diagonais do diagrama, sempre descendo por elas. - Mas alguns cuidados devem ser tomados:
– Não se esqueça de contar quantos elétrons o átomo realmente tem. Se for um cátion (átomo positivo), ele terá menos elétrons que o número atômico. Se for um ânion (átomo negativo), ele terá mais elétrons.– Se um átomo tem cargas positivas (cátion), significa que ele perdeu elétrons e isso normalmente acontece com os elétrons do “último nível” ou “nível de valência” ou “última camada”, considerando sua distribuição neutra.Nem sempre os elétrons do último nível são os últimos da distribuição eletrônica. - Ferro metálico (neutro):
Exemplos de distribuição eletrônicaDistribuição por subníveis:1s2 2s2 2p6 3s2 3p6 4s2 3d6Distribuição por níveis (camadas):K=2 L=8 M=14 N=226FeFerro metálico (neutro):26 prótons26 elétronsDistribuição por orbitaisDisponível (acesso ): - Observe que:– A distribuição por subníveis chega ao nível quatro (camada N, 4s2), e volta ao nível 3 (camada M, 3d6).– O subnível 3d suporta até 10 elétrons (3d10), mas, como o ferro (Fe) tem 26, a contagem encerra em 3d6; ou seja, quatro orbitais são semipreenchidos. Isso não quer dizer que o ferro perdeu elétrons; ao contrário, ele está neutro. Apenas não tem elétrons para completar a camada M.– Os elétrons “de valência” são os do último nível (4s2); os elétrons “de diferenciação” (3d6) são os mais energéticos.
- (Cuidado: distribuição errada!)
Distribuição por subníveis:1s2 2s2 2p6 3s2 3p6 4s0 3d6Distribuição por níveis (camadas):K=2 L=8 M=14 N=zero26Fe2+Íon ferroso ou ferro II26 prótons24 elétronsObserve que:Os elétrons perdidos saíram da camada de valência, que fica mais longe do núcleo; e não do subnível mais energético.Erro comum: retirar elétrons do subnível mais energético (3d), ao invés da camada de valência (4):1s2 2s2 2p6 3s2 3p6 4s2 3d4(Cuidado: distribuição errada!) - ferro metálico, 26Fe, neutro:
Modelo de Bohr para oferro metálico, 26Fe, neutro:Os elétrons de valência (camada 4 ou “N”) ficam mais longe do núcleo do que os de diferenciação (3d6).Normalmente, os átomos perdem os elétrons de valência; ou seja, perdem toda a camada mais externa! - Íon férrico ou ferro III
Distribuição por subníveis:1s2 2s2 2p6 3s2 3p6 4s0 3d5Distribuição por níveis (camadas):K=2 L=8 M=13 N=zeroÍon férrico ou ferro III26 prótons23 elétronsObserve que:– Nesse caso, os elétrons perdidos saíram da camada de valência, mas também um elétron saiu da penúltima camada; o que é bastante incomum para a maioria dos outros elementos. O ferro tem dois níveis de oxidação (2+ e 3+), sendo ambos importantes. - O ferro perde um elétron da penúltima camada, pois ganha estabilidade, ao ficar com todos os orbitais 3d semipreenchidos; ou seja, 3d5:3d6↓↑ ↓3d5↓Obs.: Para qualquer distribuição, os elétrons do mesmo subnível ficam desemparelhados, não ocupando o mesmo orbital. Ou seja, não há orbitais totalmente cheios e orbitais totalmente vazios no mesmo subnível.
- Distribuição por subníveis:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5Distribuição por níveis (camadas):K=2 L=8 M=18 N=735BrBromo neutro:35 prótons35 elétronsObserve que:Os elétrons de valência são sete, somando 4s2 e 4p5 (2+5=7) da última camada. Os elétrons de diferenciação são apenas os do último subnível, 4p5, mais energético, não incluindo toda a camada. - 35BrDistribuição por subníveis:1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5Distribuição por níveis (camadas):K=2 L=8 M=18 N=7Bromo neutro:35 prótons35 elétronsObserve que:Os elétrons de valência são sete, somando 4s2 e 4p5 (2+5=7) da última camada. Os elétrons de diferenciação são apenas os do último subnível, 4p5, mais energético, não incluindo toda a camada.
- Distribuição por orbitais e
modelo de Bohr para o elemento bromo (neutro)e - 35Br1-Distribuição por subníveis:1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6Distribuição por níveis (camadas):K=2 L=8 M=18 N=8Íon brometo:35 prótons36 elétronsObserve que:O bromo ganhou um elétron, adquirindo a configuração de um gás nobre (36Kr, criptônio). As configurações dos gases nobres são as mais estáveis, com oito elétrons de valência (s2+p6=8); por isso, esses átomos não tendem a ganhar ou a perder elétrons.
- Modelos de Bohr para os gases nobres hélio (2He), neônio (10Ne), argônio (18Ar) e criptônio (36Kr). O hélio é o único gás nobre que não possui oito elétrons de valência, pois a camada “K” só comporta dois elétrons (1s2). Distribuição por orbitais para o neônio (10Ne). e
- A DESCOBERTA DO NÊUTRON (1932)
Quando Rutherford propôs o primeiro modelo atômico nuclear, em 1911, houve duas grandes controvérsias no meio científico. Uma delas, quanto ao motivo de os elétrons não caírem no núcleo – problema solucionado por Bohr, com a Física Quântica. A outra, em relação à “convivência” de mais de um próton no interiordo núcleo: como eles poderiam coexistir, sem desintegrar o núcleo e o átomo, já que são positivos e se repelem? - Naquela época, Rutherford lançou a hipótese da possibilidade da ligação de um próton (carga elétrica positiva) com um elétron (carga elétrica negativa), o que daria origem a uma partícula sem carga elétrica, que ele denominou “nêutron”. Os nêutrons seriam capazes de afastar um pouco os prótons uns dos outros, diminuindo sua repulsão.Mas a confirmação experimental da existência dos nêutrons parecia difícil, pois a carga nula dificultaria muito a sua detecção.
- Em 1932, James Chadwick ( ) fez incidir um feixe de partículas alfa sobre uma amostra de berílio (4Be), obtendo um tipo de radiação invisível, sem carga elétrica, que os físicos, inicialmente, suspeitaram se tratar de raios gama.Mas, como essa hipótese contradizia os princípios de “conservação de energia” e de “quantidade de movimento”, Chadwick formulou outra hipótese: a radiação invisível seria constituída por nêutrons.
- Chadwick mediu a massa dessas partículas neutras, confirmando a hipótese de Rutherford, de que deveriam ter a massa praticamente igual a dos prótons.James Chadwick recebeu o Prêmio Nobel de Física em 1935.
- Carga elétrica (Coulombs)
Três partículas subatômicasA partir de 1932, os cientistas consideraram que a estrutura do átomo estava bem esclarecida, com três “partículas fundamentais”: próton (1p+), nêutron (1no) e elétron (oe-).PartículaNêutronPrótonElétronMassa (Kg)1, 1, 9,Massa (u)1,008661,007285,Massa relativa1Carga elétrica (Coulombs)+1,-1,Carga relativa+1 -1 - O elétron, capaz de anular a carga de um próton, mas de massa 1836 vezes menor, vibrando em orbitais, subníveis e níveis da eletrosfera.– Nêutrons e prótons no núcleo, sendo o nêutron, de carga nula, e com a massa um pouco maior que a de um próton, justamente a soma das massas de um próton e de um elétron.
- Comparação entre a massa de um elétron (moeda) e a de um próton (bola de boliche), quase 2 mil vezes maior. Por isso, a massa de um elétron é considerada desprezível para um átomo; ou seja, quando um átomo perde elétrons, sua massa não se altera significativamente.
- Outra comparação: uma pessoa que perde um fio de cabelo não tem sua massa total alterada significativamente; embora o fio de cabelo possua, sim, uma massa.
- A partir da década de 1960, a humanidade já havia desenvolvido bombas nucleares de enorme poder destrutivo, e usinas para o aproveitamento da energia nuclear.Acelerador do Fermilab, USA.
- Com os primeiros aceleradores de partículas, foi possível colidir partículas subatômicas, que se desintegram no choque; e novas partículas, ainda menores que os prótons, elétrons e nêutrons, puderam ser detectadas.
- MODELO PADRÃO: TODAS AS PARTÍCULAS
Atualmente, os Quarsk e os Leptons são consideradas os dois tipos de partículas formadores da matéria, sendo seis tipos de quarks e seis tipos de léptons, que interagem, segundo quatro tipos de “carregadores de forças”, incluindo o fóton (luz), bósonse o glúon. - Obs.: O bóson de Higgs, conhecido como “partícula de Deus”, teve a existência confirmada em 2011.
- MODELO PADRÃO: TODAS AS PARTÍCULAS
Os quarks podem se ligar aos pares e às trincas. Os pares de quarks são chamados mésons; e as trincas, bárions. O próton é uma trinca de quarks, formado por dois quarks “up” e um quark “down”. O nêutron é outra trinca de quarks, dois “down” e um “up”. - À esquerda: estrutura interna de um nêutron: a força nuclear forte mantém os quarks unidos.
À direita, a força nuclear fraca mantém unidos um próton e um nêutron, no interior do núcleo de um átomo. - CONCLUSÃO
- Os fenômenos químicos podem ser explicados, todos, simplesmente até o nível dos prótons, nêutrons e elétrons, não sendo necessário o aprofundamento para o nível dos quarks e léptons, cujo estudo pertence ao campo da Física Nuclear.
- Para prosseguir seus estudos sobre o átomo, é importantíssimo saber sobre as propriedades das três partículas fundamentais, principalmente em relação às suas cargas elétricas e à sua massa.O estudo das distribuições eletrônicas dará uma boa base para o entendimento da Tabela Periódica e famílias dos elementos, e, logo em seguida, para o estudo das ligações entre os átomos.
Videoaulas relacionadas:https://youtu.be/Y6ZlyhT5azU