11) Indique o volume: 2 Kg de chumbo ( densidade = 11,3 g/cm3 ) e 2 Kg de alumínio ( densidade = 2,7 g/cm3 ). Efetue e demonstre os cálculos. (Lembre um 1 Kg e igual a mil gramas)
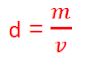
12) Se um liquido possui volume de 166 cm3 e a massa correspondente a 498 g . A densidade do líquido é: demonstre os cálculos
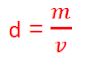
13) Um corpo tem densidade igual a 7,6 g/cm3 e o volume ocupa uma extensão de 200 cm3. Sua massa é:demonstre os cálculos
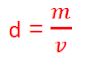
14) O latão, o bronze e o aço são misturas, denominadas ligas metálicas. Pode-se dizer que o latão, o bronze e o aço são tipos diferentes de:
A) misturas heterogêneas.
B) soluções líquidas.
C) soluções sólidas.
D) minerais rochosos.
15) Em geral, as pessoas consideram água mineral engarrafada como água pura, do ponto de vista químico, entretanto, se observarmos o rótulo de uma garrafa de água mineral, podemos afirmar que ela constitui uma:
A) mistura heterogênea.
B) mistura homogênea.
C) substância pura.
D) substância composta.
16) Um aluno deseja calcular a densidade de uma bola de gude. Primeiramente, mediu numa balança a massa do objeto 10 g. Depois, determinou o volume utilizando uma proveta com água que indicava 50 mL: mergulhou a bola de gude e a nova leitura foi 54 mL.
Os valores obtidos permitem saber a densidade do material que é feita a bola de gode é:
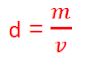
17) (Fuvest-SP) Quais propriedades a seguir são as mais indicadas para verificar se é pura uma certa amostra sólida de uma substância conhecida?
- Cor e densidade.
- Cor e dureza.
- Ponto de fusão e densidade.
- Cor e ponto de fusão.
- Densidade e dureza
Símbolos e Fórmulas
Aula 11
ESTRUTURA DA MATÉRIA
A energia se condensa formando a matéria.
E=mc²: Einstein e a equivalência entre matéria e energia

O termo matéria refere-se a todos os materiais ou coisas que compõem o universo.

A matéria é constituída por partículas muito pequenas denominadas átomos.

Os átomos, apresentam vários tipos diferentes, chamados também de elementos químicos.

Particulas fundamentas, prótons, nêutrons e elétrons
A união entre átomos é chamada de ligação química.
As ligações de hidrogênio são formadas entre os átomos de hidrogênio e de oxigênio de


Os átomos se combinam (ligação química), para formar as moléculas ou aglomerados iônicos.
Um conjunto de espécies químicas iguais – moléculas – forma as
Aula 11
ESTRUTURA DA MATÉRIA
A energia se condensa formando a matéria.
E=mc²: Einstein e a equivalência entre matéria e energia

O termo matéria refere-se a todos os materiais ou coisas que compõem o universo.

A matéria é constituída por partículas muito pequenas denominadas átomos.

Os átomos, apresentam vários tipos diferentes, chamados também de elementos químicos.

Particulas fundamentas, prótons, nêutrons e elétrons
A união entre átomos é chamada de ligação química.
As ligações de hidrogênio são formadas entre os átomos de hidrogênio e de oxigênio de


Os átomos se combinam (ligação química), para formar as moléculas ou aglomerados iônicos.

Um conjunto de espécies químicas iguais – moléculas – forma as substâncias químicas.
As substâncias químicas são responsáveis pela constituição de toda matéria.
1 grão de areia (1mm) / 10.000.000 = tamanho de um átomo
Átomos Elementos Químicos
| Nome | Símbolo | Natureza |
| Ferro | Fe | Fe3O4 |
| Cálcio | Ca | CaCO3 |
| Prata | Ag (Argentum) | Ag |
| Oxigênio | O | O2 |
As substâncias químicas são responsáveis pela constituição de toda matéria.
1 grão de areia (1mm) / 10.000.000 = tamanho de um átomo
Átomos Elementos Químicos
| Nome | Símbolo | Natureza |
| Ferro | Fe | Fe3O4 |
| Cálcio | Ca | CaCO3 |
| Prata | Ag (Argentum) | Ag |
| Oxigênio | O | O2 |
Símbolos
São conhecidos atualmente mais de 100 elementos químicos. Cada um deles tem um nome e um símbolo diferente.

Os símbolos são a representação dos elementos químicos. São formados por uma, duas ou três letras. A primeira é sempre maiúscula e a segunda, é sempre minúscula. O símbolo de um elemento vem de uma ou duas letras tiradas de seu nome em latim.
Por causa disso, nem todos os símbolos têm relação lógica com o nome do elemento em português.
Os que têm três letras não têm nomes oficiais, atribuídos pela Iupac (União Internacional de Química Pura e Aplicada).

Fórmulas
Todas as substâncias são formadas por átomos. As substâncias simples são formadas por átomos de um único elemento e as substâncias compostas são formadas por átomos de dois ou mais elementos diferentes.

As moléculas são as menores unidades que apresentam a composição característica de uma substância. As moléculas são formadas pela união de dois ou mais átomos.

Para representar graficamente as moléculas de uma substância, seja ela simples ou composta, os químicos utilizam fórmulas. A fórmula da água é H2O. Outras fórmulas usadas pelos químicos são CO2 (gás carbônico), N2 (gás nitrogênio), O2 (gás oxigênio), O3 (gás ozônio), C2H6O (etanol), C6H12O6 (glicose), NH3 (amônia) e H2SO4 (ácido sulfúrico).

Na fórmula de uma substância são colocados os símbolos dos elementos que tornam parte de sua composição e os índices de atomicidade (ou, simplesmente, atomicidade), que indicam a proporção em que os átomos do elemento estão presentes na substância. Se o índice de atomicidade não for escrito, é porque seu valor é 1.

ESTUDO DAS SUBSTÂNCIAS E MISTURAS
SUBSTÂNCIA: forma particular de matéria, apresentando composição fixa, definida.
Na grande maioria dos casos, os materiais que constituem um corpo ou um objeto são compostos por várias substâncias químicas diferentes.
Ex Em um fio de cobre encontramos muitos átomos de cobre.
No leite encontramos água, lactose, galactose, caseína e albumina, etc.
A água do mar é constituída água, cloreto de sódio, além de outros tipos de sais
Substâncias puras e misturas
As substâncias puras são classificadas em simples e compostas, e as misturas são classificadas em homogêneas e heterogêneas.
Substância simples: é constituída de uma molécula formada por átomos do mesmo elemento químico (mesmo tipo de átomo).
Substância composta: é constituída por uma molécula formada por mais de um elemento químico.
De uma forma geral, as substâncias puras dificilmente são encontradas isoladas na natureza, sendo encontradas na forma de misturas, isto é, associadas às outras substâncias. Isso quer dizer que nós e quase tudo que está a nossa volta são exemplos de misturas das mais variadas substâncias puras.
Substâncias puras
Substâncias puras são materiais que possuem composição química e propriedades físicas e químicas constantes, já que não se modificam em pressão e temperatura constantes.
De uma forma geral, as substâncias puras podem ser classificadas de duas formas:
a) Substâncias simples
São compostos químicos formados por átomos de um mesmo elemento químico. Por exemplo:
→ H2 (Gás Hidrogênio)
As moléculas do Gás Hidrogênio são formadas por dois átomos do elemento químico Hidrogênio, por isso, trata-se de uma substância simples.
→ O3 (Gás Ozônio)
As moléculas do Gás Ozônio são formadas por três átomos do elemento químico Oxigênio, por isso, trata-se de uma substância simples.
Existe ainda a possibilidade de átomos de um mesmo elemento químico formarem substâncias simples completamente diferentes, os alótropos. Um exemplo de alotropia é o caso do elemento químico Oxigênio, o qual forma as substâncias gás oxigênio (O2) e gás ozônio (O3).
São compostos químicos formados por átomos de elementos químicos diferentes. Exemplos:
→ CO2 (Gás Carbônico ou Dióxido de Carbono)
As moléculas do Gás Carbônico são formadas por um átomo do elemento carbono e dois átomos do elemento oxigênio. Como os elementos químicos são diferentes, trata-se de uma substância composta.
→ KMnO4 (permanganato de potássio)
O íon-fórmula do permanganato de potássio é formado por um átomo do elemento potássio, um átomo do elemento manganês e quatro átomos do elemento oxigênio.
Misturas
Mistura é a união de duas ou mais substâncias diferentes (independentemente se são simples ou compostas). Ela apresenta características físicas (ponto de fusão, ponto de ebulição, densidade, tenacidade etc.) diferentes e variáveis (não fixas) em comparação com as substâncias que a compõem.
A mistura de água e cloreto de sódio, por exemplo, apresenta um ponto de fusão totalmente diferente em relação aos pontos de fusão da água ( 0oC) e do cloreto de sódio (803oC) isoladamente.
a) Misturas homogêneas
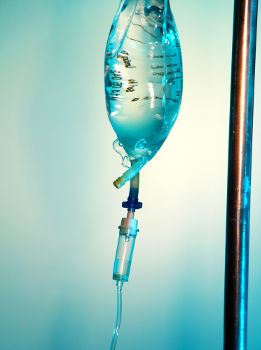
O soro fisiológico é uma mistura homogênea formada por água, glicose e cloreto de sódio
As misturas homogêneas apresentam apenas uma fase (um único aspecto visual). São formadas quando um material tem a capacidade de dissolver outro. Exemplos:
- água e cloreto de sódio;
- água e glicose;
- gasolina e etanol;
- ar atmosférico (gás oxigênio, gás nitrogênio, gás carbônico, vapor de água etc);
- ácido acético e água;
- petróleo (gasolina, querosene, óleo lubrificante etc.);
- soro fisiológico.
b) Misturas heterogêneas

O leite é uma mistura heterogênea porque possui uma fase líquida (água) e uma fase sólida (gordura)
As misturas heterogêneas apresentam mais de uma fase (dois ou mais aspectos visuais). São formadas quando um material não dissolve outro. Exemplos:
- Granito;
- Leite;
- Sangue;
- Água e areia;
- Água e óleo;
- Água e gasolina.



(Vunesp-SP) O rótulo de uma garrafa de água mineral está reproduzido a seguir:
Composição química potável:
Sulfato de cálcio 0,0038 mg/L
Bicarbonato de cálcio 0,0167 mg/L
Com base nessas informações, podemos classificar a água mineral como:
a) substância pura.
b) substância simples.
c) mistura heterogênea.
d) mistura homogênea.
e) suspendo coloidal.
Aula 12
A Linguagem dos químicos
A representação simbólica dos elementos químicos foi mudando ao longo dos tempos.
Tornou-se importante para os químicos representar cada elemento, de um modo simples e entendido por todos, com caráter universal.
Foi Berzelius, cientista sueco, quem introduziu a notação simbólica, moderna, dos elementos.
Jacob Berzelius 1779-1848
São formados por uma, duas ou três letras do nome do elemento (escrito em latim, grego ou inglês):
– 1ª letra maiúscula; – Restantes letras minúsculas (quando necessárias). Exemplificando:
Carbono
Símbolo químico: C Letra maiúscula
Cálcio
Símbolo químico: Ca 1ª letra maiúscula – Restantes letras minúsculas
Letra minúscula
Nomes de alguns elementos e respectivos símbolos químicos:
Nome do elemento Cobre – do latim Cuprum – Símbolo químico Cu
Nome do elemento Sódio – do latim Natrium – Símbolo químico Na
Nome do elemento Prata – do latim Argentum – Símbolo químico Ag
O símbolo químico de um elemento representa:
– o nome desse elemento;
– um átomo desse elemento.
Exemplo:
Símbolo químico H – Nome do elemento Hidrogênio – representa um átomo do elemento hidrogênio.
Quando se pretende representar mais do que um átomo de um dado elemento (não ligado quimicamente) deves: Indicar, antes do símbolo químico e ao mesmo nível, o número de átomos desse elemento.
Por exemplo:
2 H – representa dois átomos do elemento hidrogénio;
3 O – representa três átomos do elemento oxigénio;
4 C – representa quatro átomos do elemento carbono;
As substâncias moleculares representam-se por meio de fórmulas químicas.
Há regras para escrever a fórmula química de qualquer substância molecular:
Ä Escrever os símbolos químicos dos elementos que entram na constituição da molécula;
Ä Colocar um índice numérico à direita, ligeiramente abaixo do símbolo do
elemento. Este índice indica o número de átomos de cada elemento constituinte da molécula.
Ä Quando na molécula há apenas um átomo de um elemento químico, omitese o índice 1 (um) após o símbolo.
Por exemplo:
A água é uma substância molecular formada pelos elementos oxigênio e hidrogênio.
A fórmula química da água é: H2O1
Símbolo químico do hidrogênio, Símbolo químico do oxigênio.
A fórmula química de qualquer substância molecular tem um significado qualitativo e um significado quantitativo:
Ä qualitativamente, indica os elementos que constituem essa substância;
Ä quantitativamente, informa acerca do número de átomos de cada elemento que constituem a molécula.
Fórmulas químicas
H2 – Nome da substância – Di-hidrogénio -Significado quantitativo e qualitativo – Molécula formada por 2 átomos de hidrogênio.
N2 – Nome da substância – Diazoto -Significado quantitativo e qualitativo, Molécula formada por 2 átomos de azoto.
Exercício
Água H2O, Dióxido de Carbono CO2, Amoníaco NH3, Propano C3H8
Nome da substância Modelo da molécula Significado quantitativo e qualitativo
Molécula formada por 2 átomos de hidrogénio e 1 átomo de oxigénio
Molécula formada por 1 átomo de carbono e 2 átomos de oxigénio
Molécula formada por 1 átomo de azoto e 3 átomos de oxigénio Molécula
Aula 13
Equações Químicas
As equações químicas são representações gráficas das reações químicas que ocorrem entre os diversos elementos presentes na Tabela Periódica.
Elas são formadas por átomos, moléculas, e se apresentarem íons são chamadas de equações iônicas:
- H2(g) + O2(g) → H2O (l) – equação comum
- H++ OH–→ H2O – equação iônica
Observe que os elementos que estão à esquerda da seta são denominados reagentes, os quais participam das reações químicas, enquanto aqueles que estão à direita são chamados de produtos, ou seja, as substâncias que são formadas a partir dessa reação.
Fique atento, pois alguns símbolos são utilizados nas equações para indicar determinadas ações que ocorrem:
- Quando ocorre a reação química dos elementos: +
- Sentido que ocorre a reação química e indica o que será produzido: →
- Quando há presença de catalisadores ou aquecimento: ∆
- Quando há formação de um sólido que se precipita:↓
- Quando a reação é reversível: ↔
- Quando há presença de luz: λ
- Elemento no estado gasoso: (g)
- Elemento no estado sólido: (s)
- Elemento no estado de vapor: (v)
- Elemento no estado líquido: (l)
- Presença de solução aquosa: (aq)
Aula 14
TIPOS DE EQUAÇÕES QUÍMICAS
As classificações das equações químicas são determinadas pelo tipo de reação química que ocorre, classificadas de quatro maneiras:
- Reações de Síntese ou Adição
(A+B → AB): reação entre duas substâncias gerando uma nova e mais complexa, por exemplo: C + O2 → CO2.
- Reações de Análise ou de Decomposição
(AB → A+B): ao contrário da reação de adição, essa reação ocorre de modo que uma substância composta se divide em duas ou mais substâncias simples, por exemplo: 2 HgO → 2 Hg + O2.
- Reações de Deslocamento ou de Substituição ou de Simples Troca
(AB+C → AC+B ou AB+C → CB+A): corresponde a reação entre uma substância simples e outra composta, resultando na variação da substância composta em simples, por exemplo: Fe + 2HCL → H2 + FeCl2.
- Reações de Dupla-Troca ou de Dupla Substituição
- (AB+CD → AD+CB): reação entre duas substâncias compostas que trocam entre si os elementos químicos, resultando em duas novas substâncias compostas, por exemplo: NaCl + AgNO3→ AgCl + NaNO3.
Exemplos de Equações Químicas
Veja abaixo alguns exemplos de equações químicas:
C (s) + O2 (g) → CO2(g)
2H2 (g) + O2 (g) → 2 H2O (l)
Zn + CuSO4 → ZnSO4 + Cu
Para aprofundar seus conhecimentos, leia também os artigos:
Aula 15
BALANCEAMENTO DAS EQUAÇÕES QUÍMICAS
O balanceamento das equações químicas demostra sua estabilidade e equilíbrio, uma vez que deve conter o mesmo número de átomos de cada elemento em ambos os lados da equação.
Os coeficientes estequiométricos são os números que aparecem na frente dos elementos, indicando quantos átomos existem na reação.
Quando o coeficiente for 1 geralmente ele fica subentendido e não aparece descrito. De tal modo, podemos dizer que as fórmulas (H2, O2, C2, H2O, HCl, CaO, etc.) oferecem um sentido qualitativo, enquanto os coeficientes dão o sentido quantitativo das equações químicas.
Para que uma equação química fique balanceada, devemos atentar para a “Lei da Conservação de Massa” de Lavoisier a qual postula:
“Na natureza nada se cria, nada se perde, tudo se transforma” donde “A soma das massas das substâncias reagentes é igual à soma das massas dos produtos da reação”.
Para entender melhor esse conceito, vejamos o exemplo abaixo:
Al+O2 → Al2O3
Para balancear a equação química acima, primeiramente devemos escolher o elemento que surge somente uma vez na primeira e na segunda parte da equação, sendo que nesse caso é igual para o Alumínio (Al) e o Oxigênio (O).
Observado isso, devemos escolher o elemento com índices maiores, nesse caso, o oxigênio (O), com 2 (no primeiro membro) e 3 (no segundo membro). Por conseguinte, devemos transpor os índices do primeiro e do segundo membro, usando-os como coeficientes.
Logo, para que a equação acima fique balanceada devemos acrescentar os coeficientes 4 (2.2=4) e 2 na frente do elemento alumínio (Al) no primeiro e no segundo membro respectivamente, e ainda, o 3 no oxigênio (O) do primeiro membro.
Assim, o número de total de átomos de cada elemento da reação química fica balanceado no 1° e 2° membro da equação:
4Al + 3O2 → 2Al2O3
Exercício Resolvido
Para fixar seus conhecimentos sobre o balanceamento de equações, segue abaixo cinco equações que devem ser balanceadas:
- a) H2O → H2+O2
b) H2S+SO2→ H2O+S
c) H2+I2→ HI
d) NH3+O2→ NO+H2O
e) FeS2+O2→ Fe3O4+SO2
Aula 16
Tabela periódica
A partir do século XIX, cientistas começaram a perceber que os elementos químicos poderiam ser agrupados em colunas, formadas pela reunião de elementos com propriedades semelhantes.
O número de elementos químicos conhecidos pelo homem aumentou com o passar dos séculos, principalmente no XIX. Observe a tabela:
| ATÉ O FINAL DO SÉCULO: | Nº DE ELEMENTOS QUÍMICOS |
| XVI | 14 |
| XVII | 33 |
| XIX | 83 |
| XX | 112 |
Alguns elementos já eram conhecidos antes de 1650, como Ag, C, As, Au, Hg, Pb, Sn, Sb, Cu, S. Depois de tantos químicos tentarem classificar os elementos químicos, Dimitri Ivanovitch Mendeleyev foi o que mais se destacou.
Seu trabalho em classificar os elementos é usado até hoje. Ele criou uma tabela periódica dos elementos, que serviu de base para organizar a que temos hoje.
Mendeleyev observou que há uma periodicidade das propriedades quando os elementos químicos eram colocados em ordem crescente de suas massas atômicas.
Lei da periodicidade – muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência de seus números atômicos.
Como utilizar a tabela periódica?
Cada quadro da tabela fornece os dados referentes ao elemento químico: símbolo, massa atômica, número atômico, nome do elemento, elétrons nas camadas e se o elemento é radioativo.
As filas horizontais são denominadas períodos. Neles, os elementos químicos estão dispostos na ordem crescente de seus números atômicos. O número da ordem do período indica o número de níveis energéticos ou camadas eletrônicas do elemento. A tabela periódica apresenta sete períodos:
1º período – 2 elementos
2º período – 8 elementos
3º período – 8 elementos
4º período – 18 elementos
5º período – 18 elementos
6º período – 32 elementos
7º período – até agora 30 elementos
As colunas verticais constituem as famílias ou grupos, nas quais os elementos estão reunidos segundo suas propriedades químicas. As famílias ou grupos vão de 1 a 18. Algumas famílias possuem nome, como por exemplo:
1 – alcalinos
2 – alcalinos terrosos
13 – família do boro
14 – família do carbono
15 – família do nitrogênio
16 – família dos calcogênios
17 – família dos halogênios
18 – gases nobres
Da família 1 e 2 e 13 até 18 chamamos de elementos representativos. Da família do 3 até 12 chamamos de elementos de transição.
Os elementos que ficam na série dos lantanídeos e actinídeos são os elementos de transição. Como eles estão no grupo 3, como se estivessem numa “caixinha” para dentro da tabela, são chamados de elementos de transição interna. E os demais são chamados de elementos de transição externa.
Os elementos químicos estão reunidos em três grandes grupos: metais, não-metais e gases nobres. O hidrogênio (H) não se encaixa em nenhuma dessas classificações porque possui características próprias. Algumas tabelas mostram esta divisão.
Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.
Quase todos os metais têm brilho, pois são capazes de refletir muito bem a luz. Ouro, prata e alumínio são exemplos de metais com muito brilho. Os metais são bons condutores elétricos.
Como em geral apresentam ductibilidade, ou seja, podem ser reduzidos a fios, são usados como tal na condução de eletricidade. Os metais conduzem bem o calor.
Nem sempre um metal puro apresenta as propriedades desejáveis para determinadas aplicações. Por isso são produzidas as ligas metálicas, onde dois ou mais metais são misturados. São exemplos o bronze e o latão. O bronze é uma mistura de cobre, estanho e o latão é resultado da mistura de cobre e zinco.
A maioria das ligas é formada por dois ou mais metais, mas algumas contêm não-metais, como o carbono. A liga mais usada desse tipo é o aço. Os não-metais são maus condutores de eletricidade, quase não apresentam brilho, não são maleáveis e nem dúcteis. Tendem a formar ânions (íons negativos).
Os gases nobres ou inertes, ou ainda raros, constituem cerca de 1% do ar. É muito difícil se conseguir compostos com estes gases. Raramente eles reagem porque são muito estáveis. Suas camadas exteriores estão completamente preenchidas de elétrons. Estão todos no grupo 18 da tabela periódica.
Na tabela periódica atual, existem elementos naturais e artificiais. Os naturais são os elementos encontrados na natureza e os artificiais são produzidos em laboratórios.
Dois estão localizados antes do urânio (U-92), os chamados elementos cisurânicos, que são o tecnécio (Tc – 43) e o promécio (Pm – 61). Outros elementos artificiais vêm depois do urânio, chamamos de transurânicos que são todos os outros após o U – 92. Dentre eles: Pu, Am, Bk, Fm, No, Sg, Ds
Aula 17
ESTRUTURA DO ÁTOMO
Evolução dos modelos atômicos
MATÉRIA
– Atomos são os componentes básicos das moléculas e da matéria comum.
– São compostos por partículas subatómicas.
- As mais conhecidas são os prótons, os nêutronse os elétrons.
- Formado por : núcleo atômicoe a eletrosfera.
– O núcleo é constituído de prótons (cargas positivas) e nêutrons (cargas neutras). Os nêutrons estabilizam o núcleo, uma vez que cargas de mesmo sinal tendem a se repelir.
– Em torno do núcleo, na eletrosfera, estão os elétrons (cargas negativas). Os elétrons são atraídos pela carga positiva dos prótons e então ficam ao seu redor, na eletrosfera.
Da família 1 e 2 e 13 até 18 chamamos de elementos representativos. Da família do 3 até 12 chamamos de elementos de transição.
17 – família dos halogênios
18 – gases nobres
Os elementos que ficam na série dos lantanídeos e actinídeos são os elementos de transição. Como eles estão no grupo 3, como se estivessem numa “caixinha” para dentro da tabela, são chamados de elementos de transição interna. E os demais são chamados de elementos de transição externa.
Os elementos químicos estão reunidos em três grandes grupos: metais, não-metais e gases nobres. O hidrogênio (H) não se encaixa em nenhuma dessas classificações porque possui características próprias. Algumas tabelas mostram esta divisão.
Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.
Quase todos os metais têm brilho, pois são capazes de refletir muito bem a luz. Ouro, prata e alumínio são exemplos de metais com muito brilho. Os metais são bons condutores elétricos.
Como em geral apresentam ductibilidade, ou seja, podem ser reduzidos a fios, são usados como tal na condução de eletricidade. Os metais conduzem bem o calor.
Nem sempre um metal puro apresenta as propriedades desejáveis para determinadas aplicações. Por isso são produzidas as ligas metálicas, onde dois ou mais metais são misturados. São exemplos o bronze e o latão. O bronze é uma mistura de cobre, estanho e o latão é resultado da mistura de cobre e zinco.
A maioria das ligas é formada por dois ou mais metais, mas algumas contêm não-metais, como o carbono. A liga mais usada desse tipo é o aço. Os não-metais são maus condutores de eletricidade, quase não apresentam brilho, não são maleáveis e nem dúcteis. Tendem a formar ânions (íons negativos).
Os gases nobres ou inertes, ou ainda raros, constituem cerca de 1% do ar. É muito difícil se conseguir compostos com estes gases. Raramente eles reagem porque são muito estáveis. Suas camadas exteriores estão completamente preenchidas de elétrons. Estão todos no grupo 18 da tabela periódica.
Na tabela periódica atual, existem elementos naturais e artificiais. Os naturais são os elementos encontrados na natureza e os artificiais são produzidos em laboratórios.
Dois estão localizados antes do urânio (U-92), os chamados elementos cisurânicos, que são o tecnécio (Tc – 43) e o promécio (Pm – 61). Outros elementos artificiais vêm depois do urânio, chamamos de transurânicos que são todos os outros após o U – 92. Dentre eles: Pu, Am, Bk, Fm, No, Sg, Ds.
Aula 18
ESTRUTURA DO ÁTOMO
Evolução dos modelos atômicos
MATÉRIA
– Atomos são os componentes básicos das moléculas e da matéria comum.
– São compostos por partículas subatómicas.
- As mais conhecidas são os prótons, os nêutronse os elétrons.
- Formado por : núcleo atômico e a eletrosfera.
– O núcleo é constituído de prótons (cargas positivas) e nêutrons (cargas neutras). Os nêutrons estabilizam o núcleo, uma vez que cargas de mesmo sinal tendem a se repelir.
– Em torno do núcleo, na eletrosfera, estão os elétrons (cargas negativas). Os elétrons são atraídos pela carga positiva dos prótons e então ficam ao seu redor, na eletrosfera.


