Reatividade dos metais

Imagine o seguinte experimento: uma lâmina de zinco mergulhada em uma solução de sulfato de cobre II (CuSO4(aq)) é colocada em um béquer, e uma lâmina de cobre mergulhada em uma solução de sulfato de zinco (ZnSO4(aq)) é colocada em outro béquer.
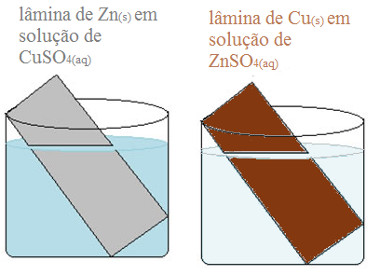
Experimento com metais em solução: zinco em solução de sulfato de cobre e cobre em solução de sulfato de zinco.
Com o passar do tempo, a solução de sulfato de cobre, que era azul, vai ficando incolor, além de haver formação de um depósito sobre a lâmina de zinco, conforme a ilustração a seguir. Todavia, no segundo béquer, nada acontece.
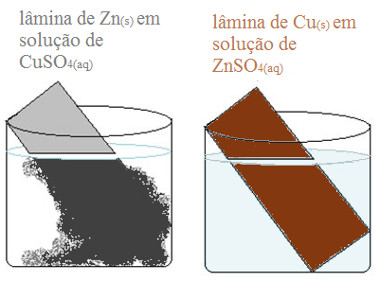
Resultado de experimento com zinco e cobre.
Isso nos mostra que ocorreu uma reação de simples troca no primeiro béquer, em que o zinco metálico da lâmina deslocou os íons cobre da solução e formou o sulfato de zinco e o cobre metálico, conforme mostra as equações a seguir:
Zn(s) + CuSO4(aq) → Cu(s) + ZnSO4(aq)
ou
Zn(s) + Cu2+(aq) + SO42-(aq) → Cu(s) + Zn2+(aq) + SO42-(aq)
ou ainda
Zn(s) + Cu2+(aq) → Cu(s) + Zn2+(aq)
A cor azul da solução de sulfato de cobre era resultado da presença dos íons cobre (Cu2+). No entanto, como eles foram deslocados e houve formação da solução de sulfato de zinco, a solução ficou incolor. O depósito sobre a lâmina é o cobre metálico que foi formado.
Entretanto, conforme mencionado, no segundo exemplo, nada aconteceu:
Cu(s) + ZnSO4(aq) → reação não ocorre espontaneamente
Esse exemplo comprova que existem metais que são mais reativos que outros. Aqui vimos que o zinco é mais reativo que o cobre, por isso, ele deslocou o cobre ligado ao sulfato. Por outro lado, por ser menos reativo, o cobre não conseguiu deslocar o zinco da solução.
A reatividade dos metais está ligada à eletropositividade, isto é, a tendência que o metal possui de perder elétrons. Quanto mais reativo o metal for, maior será a sua eletropositividade.
Observe que as reações de simples troca também são reações de oxidorredução, ou seja, reações em que há transferência de elétrons. Assim, se o metal for mais reativo, ele transferirá elétrons para o cátion do outro metal e a reação ocorrerá. Mas se o elemento metálico for menos reativo, ele não conseguirá transferir elétrons, tendo em vista que a tendência de doar elétrons do outro metal é maior, e a reação não ocorrerá. uma forma de descobrir se uma reação de oxirredução ocorrerá é por observar a reatividade dos metais. Por meio de experimentos, chegou-se à seguinte fila de reatividade dos metais, também chamada de fila das tensões eletrolíticas:
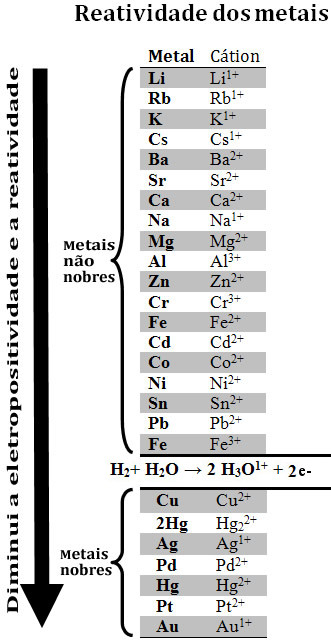
Fila de reatividade dos metais e eletropositividade
Se o metal vier acima do cátion do outro metal da reação, então a reação ocorrerá. Mas se o metal estiver abaixo do cátion, a reação não ocorrerá. O zinco (Zn – na parte dos metais não nobres), por exemplo, está acima do cobre (Cu – na parte dos metais nobres). Isso confirma que realmente o zinco é mais reativo que o cobre.
Observe também que o elemento menos reativo é o ouro (Au), isto é, ele não possui tendência de perder elétrons e oxidar-se, como ocorre com o ferro. Isso explica porque esse elemento é tão durável, não sendo atacado nem mesmo por ácidos isolados. Esse é um dos motivos que tornam o ouro tão valioso e que fazem com que ele resista intacto às intempéries do tempo, conforme pode ser visto em sarcófagos e esculturas egípcias revestidas de ouro que datam desde a mais remota antiguidade.
Outro fator importante que deve ser observado nessa ordem de reatividade dos metais é que o hidrogênio foi incluído. Isso ocorreu porque se costuma comparar a capacidade que alguns metais possuem de deslocar o hidrogênio de alguns ácidos.
Pela fila de reatividade dos metais, o zinco, por exemplo, é colocado como mais reativo que o hidrogênio. Isso significa que, se mergulharmos uma lâmina de zinco no ácido clorídrico (HCl), ele deslocará o H do ácido e formará o gás hidrogênio:
Zn(s) + 2 HCl(aq) → ZnCl2 + H2(g)
Veja a formação de bolhas de gás na imagem a seguir que confirma a formação do gás hidrogênio:

Reação entre zinco e ácido clorídrico
Por outro lado, se mergulharmos o cobre ou o ouro no ácido clorídrico, a reação não acontecerá.


