Afinal o que é matéria?
Matéria é tudo o que ocupa lugar no espaço e apresenta massa. Além dessas características, ela pode ser encontrada na natureza em três estados físicos.
A definição de matéria: trata-se de tudo aquilo que ocupa lugar (o mesmo que volume) no espaço e apresenta peso (produto da massa pela gravidade). Alguns exemplos de matéria: árvore, bactéria, vírus, ser humano, ar, água, mesa, veículo, etc.
Poderíamos citar milhares de exemplos, já que a matéria é bem abrangente. Mas, será que existe algo que não seja matéria? Com certeza, sim, porém, nesse caso, é denominado de energia, como os seguintes exemplos:
- Luz: denominada de energia luminosa;
- Pressão: denominada de energia pressórica;
- Som: denominado de energia sonora;
- Fogo: associação das energias térmica e luminosa;
- Eletricidade: denominada de energia elétrica;
- Calor: denominado de energia térmica;
- Raio-X: uma forma de energia eletromagnética;
A energia pode ser definida como uma força capaz de produzir ação e movimento, trabalho. Assim, é muito simples diferenciar a matéria de energia, já que uma ocupa espaço e possui massa, e a outra, não.
Uma curiosidade importante sobre a matéria é que ela pode ser denominada de duas formas diferentes: corpo e objeto.
Corpo: trata-se de uma parte da matéria. Exemplos: fio de lã, caco de vidro, vento, tronco de uma árvore;
Objeto: trata-se de uma parte da matéria que apresenta uma utilização específica. Exemplos: camisa, ar comprimido, caneta, cadeira.
Estrutura Atômica
Um modelo é uma representação da realidade (não a própria realidade), assim, os modelos atômicos são representações dos principais componentes do átomo e de sua estrutura e explicam determinados comportamentos físicos e químicos da matéria.
Isso é feito porque ainda não é possível ao ser humano enxergar um átomo isolado nem mesmo com ultramicroscópios.Para se ter uma ideia do quanto o átomo é pequeno, saiba que a menor partícula visível em um microscópio comum contém mais de dez bilhões de átomos!
O átomo é tão pequeno que, se colocássemos um milhão deles lado a lado, não atingiríamos a espessura de um fio de cabelo.
O átomo pode hoje ser definido como a menor porção da matéria que conserva as suas propriedades químicas e físicas, ou seja, traz consigo a identidade do material do qual faz parte. Não é correto apenas o definirmos como a menor partícula da matéria, uma vez que é ainda composto por subpartículas.
O átomo é formado por duas regiões fundamentais: o núcleo (região central do átomo) e a eletrosfera (região periférica do átomo), sendo que entre ambas impera o vazio, ou seja, nada há de tangível.
O núcleo do átomo é constituído por prótons (dotados de carga positiva) e nêutrons (sem carga elétrica). A região da eletrosfera é formada pelo movimento dos elétrons (dotados de carga elétrica negativa).
O número de prótons, quando igual ao número de elétrons, torna o átomo uma partícula neutra, isenta de carga elétrica. Quando o átomo apresenta número de elétrons maior do que o de prótons, teremos um ânion; quando o número de prótons é superior ao de elétrons, teremos um cátion. Tanto cátion como ânion podem ser chamados de íons.
O número de prótons (p) existente em um átomo recebe o nome de número atômico (simbolizado por Z). Assim, Z = p. O somatório entre prótons e nêutrons de um átomo recebe o nome de número de massa (simbolizado por A). Assim, A = p + n.
Os elétrons de um átomo podem ser distribuídos em níveis, subníveis e orbitais, de acordo com a energia que apresenta. Um importante instrumento de verificação do nível de energia eletrônico é o diagrama de Linus Pauling. Assim, temos, por exemplo, 1s², 2s², 2p², 3s²…; onde o número maior indica o nível, a letra indica o subnível, e o somatório dos expoentes indica número total de elétrons do átomo.
Entre os modelos atômicos, o mais usado atualmente no Ensino Médio para o entendimento da estrutura do átomo e suas propriedades é o de Rutherford-Bohr. Segundo esse modelo, a estrutura do átomo é constituída de duas partes principais: o núcleo e a eletrosfera. A eletricidade chega às nossas casas através de fios e da movimentação de partículas negativas que fazem parte dos elétrons, que circulam pelos fios.
No núcleo de um átomo estão os prótons e os nêutrons e, girando em torno desse núcleo, estão os elétrons.

* Núcleo: Constituindo-se como a parte central do átomo, ele é compacto, maciço e muito denso, além de ser formado pelas partículas de maior massa, que são os prótons e os nêutrons.
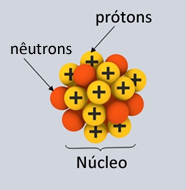 Ilustração de prótons e nêutrons que compõem o núcleo atômico
Ilustração de prótons e nêutrons que compõem o núcleo atômico
– Prótons: são partículas de carga elétrica positiva (carga relativa = +1; carga em coulomb (C) = +1,602 . 10-19) e a sua massa relativa é igual a 1.O fato de que os prótons formam o núcleo e dão a ele uma carga total positiva foi descoberto por Eugen Goldstein, em 1886, através de uma modificação na ampola de Crookes e alguns experimentos. Ele viu que, sob voltagens elevadíssimas, apareciam emissões (raios anódicos – restos de átomos do gás que estavam dentro da ampola e que tiveram seus elétrons arrancados pela descarga elétrica). Ao colocar um campo elétrico ou magnético externo à ampola, esses raios eram desviados no sentido do polo negativo. Isso significava que existiam partículas subatômicas positivas, que foram chamadas de prótons. Mais tarde, Ernest Rutherford (1871-1937) realizou o experimento descrito no texto O átomo de Rutherford, que o levou à descoberta da localização do próton: no núcleo.
– Nêutrons: são partículas de massa igual à dos prótons (1), mas como o próprio nome indica, eles são neutros, ou seja, não possuem carga elétrica. Os nêutrons foram descobertos, em 1932, por James Chadwick (1891-1974), que percebeu que o núcleo do berílio radioativo emitia partículas neutras com a massa praticamente igual à massa dos prótons (na verdade,O diâmetro do núcleo depende da quantidade de prótons e nêutrons que o átomo possui, mas, em média, fica em torno de 10-14 m e 10-15 m).
O núcleo atômico concentra praticamente toda a massa do átomo, sendo uma parte muito pequena mesmo: tanto o próton como o nêutron são cerca de 100 mil vezes menores do que o próprio átomo inteiro!
A título de comparação, imagine que aumentássemos o núcleo do átomo do elemento hidrogênio (que possui somente um próton) até o tamanho de uma bola de tênis, o elétron mais próximo ficaria a uns três quilômetros de distância! Mesmo se um átomo fosse aumentado até ficar da altura de um prédio de 14 andares, seu núcleo seria do tamanho de um mero grão de sal no sétimo andar. É realmente algo espantoso, não acha?!*
Eletrosfera: É uma região onde os elétrons ficam girando ao redor do núcleo. Apesar de ser uma região de volume muito maior que o do núcleo, ela é praticamente vazia, pois cada elétron é 1836 vezes menor que 1 próton (ou que 1 nêutron). É por isso que a massa do átomo concentra-se praticamente toda no núcleo.
Os elétrons são partículas de carga elétrica negativa (-1).Os elétrons foram descobertos, em 1897, por Joseph John Thomson (1856-1940), o criador do modelo atômico de Thomson. O experimento de Thomson pode ser visto em detalhes no texto O experimento de Thomson com descargas elétricas, mas, de forma resumida, ele usou a ampola de Crookes já mencionada e percebeu que os raios catódicos eram sempre atraídos pelo polo positivo, o que provava que o átomo possuía partículas negativas, que foram chamadas de elétrons.
Os elétrons giram ao redor do núcleo bilhões de vezes por milionésimo de segundo, dando forma ao átomo e fazendo-o comportar-se como se fosse sólido.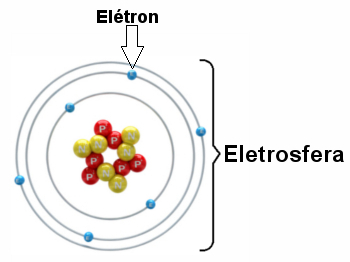
Ilustração de eletrosfera com três camadas eletrônicas e elétrons girando ao redor do núcleoResumidamente, podemos fazer uma tabela para diferenciar as três partículas subatômicas principais que fazem parte da estrutura do átomo: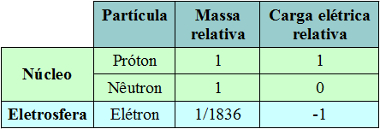
Massa e carga elétrica das três partículas subatômicas principais – prótons, nêutrons e elétronsOs átomos de todos os elementos químicos são compostos por essas três partículas subatômicas. O que difere um elemento químico de outro é a quantidade em que essas partículas aparecem, principalmente a quantidade de prótons no núcleo, que é chamada de número atômico. Continue estudando sobre isso por meio do texto Elemento Químico.
Prótons
O próton é uma partícula fundamental na estrutura atômica. Juntamente com os nêutrons, forma todos os núcleos atômicos, exceto para o hidrogênio, onde o núcleo é formado de um único próton.A massa de um átomo é a soma das massas dos prótons e nêutrons. Como a massa do elétron é muito pequena (tem cerca de 1/1836,15267377 da massa do próton), ela não é considerada.A massa do átomo é representada pela letra (A). O que identifica um elemento é o número de prótons (P) do átomo, conhecido como número atômico (Z) do elemento.É representado pela letra (Z). O número da massa (A) do átomo é formado pela soma do número atômico (Z) com o número de nêutrons (N), ou seja, A = Z + N.
Nêutrons
O nêutron são partículas neutras que fazem parte da estrutura atômica dos átomos, juntamente com os prótons. Ele tem massa, mas não tem carga.A massa é muito parecida com a do próton. O nêutron se localiza na porção central do átomo (núcleo).Para se calcular a quantidade de nêutron que um átomo possui basta fazer a subtração entre o número de massa (A) e o número eletrônico (Z).
Elétrons
O elétron é uma partícula subatômica que circunda o núcleo atômico, sendo responsável pela criação de campos magnéticos elétricos.Um próton na presença de outro próton se repele, o mesmo ocorre com os elétrons, mas entre um próton e um elétron existe uma força de atração. Dessa maneira atribui-se ao próton e ao elétron uma propriedade física denominada carga elétrica.Os elétrons dos átomos giram em órbitas específicas e de níveis energéticos bem definidos. Sempre que um elétron muda de órbita, um pacote de energia seria emitido ou absorvido.Essa teoria envolve conhecimentos da mecânica quântica e estes pacotes de energia são chamados quantum.Cada núcleo de um determinado elemento químico tem o mesmo número de prótons.Esse número define o elemento químico e número atômico do elemento e determina sua posição na tabela periódica.Em alguns casos acontece de um mesmo elemento ter átomos com números diferentes. Esses são chamados de isótopos.
Isótopos, isóbaros e isótonos
Os isótopos, isóbaros e isótonos são classificações dos átomos dos elementos químicos presenta na tabela periódica, de acordo com a quantidade de prótons, elétrons e nêutrons presentes em cada um deles.Assim, os isótopos são elementos que apresentam mesmo número de prótons, os isóbaros possuem mesmo número de massa, enquanto que os isótonos possuem mesmo número de nêutrons.Importante destacar que os prótons (p) possuem carga positiva, os elétrons (e), carga negativa e os nêutrons (n), não apresentam carga (neutralidade) e de acordo com a estrutura dos átomos, os prótons e os nêutrons estão concentrados no núcleo, enquanto que os elétrons estão localizados na eletrosfera, ou seja, em volta do núcleo.
Elemento Químico
Cada elemento químico da tabela periódica é representado pela letra que indica o elemento, por exemplo o H (hidrogênio), donde na parte superior aponta-se o número de massa (A), enquanto que o número atômico localiza-se na parte inferior da letra, por exemplo: zHA
Número Atômico (Z)
O número atômico (Z) representa a quantidade de prótons ou elétrons presentes em cada átomo. Assim, o número de prótons é igual ao número de elétrons (p = e), já que o átomo corresponde a uma partícula eletricamente neutra, ou seja, com o mesmo número de cargas opostas: prótons de carga positiva e elétrons de carga negativa.
Número de Massa (A)
O número de massa (A) de cada átomo, corresponde a soma dos prótons e dos nêutrons (A= p + n) presentes em cada elemento. Importante notar que o elétron, na medida que possui uma massa insignificante, isto é, 1836 vezes menor em relação aos prótons e nêutrons, não estão inclusos na soma das massas dos elementos químicos. Por esse motivo, o número de massa não corresponde a massa efetiva ou real do átomo.
Isótopos
Os isótopos (isotopia) são átomos de um mesmo elemento químico os quais apresentam o mesmo número atômico (Z) e diferentes números de massa (A).
Isóbaros
Os isóbaros (isobaria) são átomos de distintos elementos químicos os quais apresentam o mesmo número de massa (A) e diferentes números atômicos (Z).
Isótonos
Os Isótonos (isotonia) são átomos de elementos químicos distintos os quais apresentam diferentes números atômicos (Z), diferentes números de massa (A) e o mesmo número de nêutrons.
Exercícios
1. Segundo a representação dos elementos químicos abaixo, o cálcio (Ca), o potássio (K) e o argônio (Ar) podemos classificá-los como isótopos, isótonos ou isóbaros?
20Ca40, 19K40, 18Ar40 Se na representação do elemento químico, o número de massa corresponde a soma dos prótons e dos nêutrons (A= p + n) na representação acima, nota-se que os números que aparecem na parte superior da letra são iguais: 40.Dessa forma, conclui-se que o cálcio, o potássio e o argônio são elementos isóbaros visto que possuem o mesmo número de massa (A) e diferentes números atômico (Z), estes, representado pelos números localizados na parte inferior do elemento (20, 19, 18).
2. De acordo com a classificação dos elementos químicos (isótopos, isóbaros e isótonos), agrupe os átomos apresentados:
90A232, 91B234, 90C233, 92D233, 93E234.
Note que todos os elementos acima apresentam o número de massa e o número atômico, contudo não apresentam o número de nêutrons. Dessa maneira, para agrupá-los segundo a classificação química (isótopos, isóbaros e isótonos), deve-se calcular o número de nêutrons presentes em cada elemento, pela fórmula (A= p + n):Elemento A: 90A232A= p + n232=90+n232-90=n142=n
Elemento B: 91B234A= p + n234=91+n234-91=n143=n
Elemento C: 90C233A= p + n233=90+n143=nElemento
D: 92D233A= p + n233=92+n141=nElemento
E: 93E234A= p + n234=93+n141=nLogo,
Os elementos A e C são isótopos pois possuem o mesmo número atômico e diferentes números de massa; os elementos (B e E) e (C e D) são isóbaros uma vez que possuem mesmo número de massa e diferentes números atômicos; e, por fim, os elementos (B e C) e (D e E) são isótonos pois apresentam o mesmo número de nêutrons e diferentes números de massa e número atômico.
03- (UNICENTRO-2007). Um cientista propôs o seguinte modelo atômico:“O átomo deve ter duas regiões: um núcleo denso, muito pequeno, com prótons e uma eletrosfera, uma região de volume muito grande, ocupada pelos elétrons. ”Essa proposta está de acordo com o modelo de
- a) Chadwick.
- b) Dalton.
- c) Faraday.
- d) Rutherford.
- e) Thomson.
04- (UEPG-2007) A palavra átomo é originária do grego e significa indivisível, ou seja, segundo os filósofos gregos, o átomo seria a menor partícula da matéria que não poderia ser mais dividida. Atualmente esse conceito não é mais aceito.
A respeito dos átomos, assinale o que for correto.
( ) não podem ser desintegrados.
( ) o número de elétrons presentes no átomo é sempre maior que o número de prótons.
( ) a perda de um elétron do átomo leva à formação de um íon de carga negativa.
( ) apresentam duas regiões distintas, o núcleo e a eletrosfera.
( ) no átomo, todas as cargas positivas e quase toda a massa está concentrada no núcleo, enquanto que os elétrons carregados negativamente, circundam o núcleo e ocupam a maior parte do espaço do átomo.
05- (PUC-MG-2006). Assinale a afirmativa abaixo que NÃO é uma idéia que provém do modelo atômico de Dalton.
a) átomos de um elemento podem ser transformados em átomos de outros elementos por reações químicas.
b) todos os átomos de um dado elemento têm propriedades idênticas, as quais diferem das propriedades dos átomos de outros elementos.
c) um elemento é composto de partículas indivisíveis e di-minutas chamadas átomos.
d) compostos são formados quando átomos de diferentes elementos se combinam em razões bem determinadas.
06- (UNICAP-2003). Na época em que J. J. Thomsom conduziu seu experimento de raios catódicos, a natureza do elétron era uma dúvida. Alguns o consideravam uma forma de radiação; outros acreditavam que era uma partícula. Algumas observações feitas sobre os raios catódicos foram usadas para avançar em uma ou outra visão:
0.0 – eles passam através de folhas metálicas. Esta observação sustenta o modelo de partícula;
1.1 – viajam a velocidades mais baixas que a luz. Esta observação sustenta o modelo de partícula;
2.2 – se um objeto for colocado em seu caminho, eles apresentam uma sombra. Esta observação sustenta o modelo de radiação;
3.3 – seu caminho é defletido quando passam através de placas eletricamente carregadas. Esta observação sustenta o modelo de radiação;4.4 – campo magnético é uma região de influência que afeta o movimento de partículas carregadas.
EXERCÍCIOS SOBRE A ESTRUTURA DO ÁTOMO
- (FUVEST) O átomo constituído de 17 prótons, 18 nêutrons e 17 elétrons, possui número atômico e número de massa igual a:
a) 17 e 17
b) 17 e 18
c) 18 e 17
d) 17 e 35
e) 35 e 172. (FUVEST) A seguinte representação, X = símbolo do elemento químico, refere-se a átomos com:a) Igual número de nêutrons;
b) Igual número de prótons;
c) Diferentes números de elétrons;
d) Diferentes números de atômicos;
e) Diferentes números de oxidação;3. (MACK) Indique a alternativa que completa corretamente as lacunas do seguinte período: “Um elemento químico é representado pelo seu ___________, é identificado pelo número de __________ e pode apresentar diferente número de __________ .”a) nome – prótons – nêutrons.
b) nome – elétrons – nêutrons.
c) símbolo – elétrons – nêutrons.
d) símbolo – prótons – nêutrons.
e) símbolo – – elétrons – nêutrons.4. (STA. CASA) A questão deve ser respondida de acordo com o seguinte código:A teoria de Dalton admitia que:I. Átomos são partículas discretas de matéria que não podem ser divididas por qualquer processo químico conhecido;II. Átomos do mesmo elemento químico são semelhantes entre si e têm mesma massa;III. Átomos de elementos diferentes têm propriedades diferentes.a) Somente I é correta.
b) Somente II é correta.
c) Somente III é correta.
d) I, II, III são corretas.
e) I e III são corretas.5. Um átomo de número atômico Z e número de massa A:a) tem A nêutrons.
b) tem A elétrons.
c) tem Z prótons.
d) tem A – Z nêutrons.
e) tem Z elétrons.
Dados: O (Z=8); F (Z=9); Na (Z=11); Ca (Z=20); S (Z=16);a) o íon fluoreto F-.b) o átomo de sódio Na.c) o íon cálcio Ca2+d) o íon sulfeto S2-


