A BIOSFERA COMO FONTE DE ALIMENTOS PARA O SER HUMANO
Conteúdos e temas: componentes nutricionais dos alimentos; propriedades e funções orgânicas encontradas em carboidratos, lipídios e proteínas; nutrição e saúde. Competências e habilidades: reconhecer as funções orgânicas presentes nos diferentes grupos de alimentos; reconhecer polímeros, assim como os monômeros que os compõem. Sugestão de estratégias de ensino: retomada da análise de rótulos de alimentos realizada em Biologia, focalizando os valores energéticos de cada componente e sua relação com as respectivas estruturas; discussões relacionadas às funções de cada grupo de alimentos na manutenção da vida. Sugestão de recursos: questões; observação de estruturas; livro didático. Sugestão de avaliação: participação em aula; realização das atividades; respostas aos exercícios.
Estudo do Carbono

A Química Orgânica ajuda-nos a entender as estruturas e as propriedades das moléculas formadas por cadeias carbônicas
A Química Orgânica recebeu inicialmente esse nome para descrever substâncias extraídas de organismos vivos. Acreditava-se que elas só podiam ser produzidas em organismos vegetais e animais, mas nunca em laboratório. Entretanto, provou-se que o homem conseguia sim sintetizar compostos orgânicos em laboratório, e então a definição de Química Orgânica mudou para:
“Ramo da Química que estuda a maioria dos compostos formados pelo elemento carbono”.
Visto que o carbono é tetravalente, podendo realizar quatro ligações de diferentes maneiras, com átomos de outros elementos ou com átomos do próprio carbono, existem milhões de seus compostos. Uma quantidade muito superior do que a de compostos inorgânicos conhecidos atualmente.
Tais compostos são agrupados em diferentes funções que apresentam propriedades químicas semelhantes, tais como os hidrocarbonetos, os álcoois, as cetonas, os aldeídos, os ácidos carboxílicos, os ésteres, os éteres, as aminas, as amidas, entre outros, como ocorre o fenômeno da isomeria em muitas dessas substâncias e o que são os polímeros naturais e artificiais que formam os plásticos tão comuns em nosso cotidiano.
Composição: o Cé o principal elemento, incluem também o H, N, O, S, P e ainda os halogênios.
Características: em geral os compostos orgânicos são covalentes apolares. A presença de um elemento diferente do C e H promove certa polaridade na molécula.
H H
Ex.: H – C – H H – C – OH
H H
Apolar Polar
CARACTERÍSTICAS GERAIS
Ponto de fusão e ebulição: inferiores aos compostos inorgânicos, a maioria apresenta instabilidade térmica.
Isomeria: compostos com a mesma fórmula molecular.
Solubilidade: os apolares pouco solúveis em água, os polares solúveis, a exemplo do álcool e açúcar.
Combustibilidade: em geral são combustíveis.
Encadeamento: em função da tetravalência do C tendem a formar estruturas denominadas cadeias carbônicas.
Velocidade de reação: pouco reativos, dependem de ativadores (luz, calor, pressão, catalisadores, etc.).
Postulados de Couper – Kekulé
Tais postulados foram propostos no século XIX e são resultantes do trabalho de diversos cientistas, em especial, do químico Archibald Scott Couper e, claro, do próprio Kekulé. Assim, é comum também denomina-los Postulados de Couper-Kekulé.
Postulados do Carbono
Por que é importante estudar a fundo o Carbono? Este elemento é a unidade fundamental dos compostos orgânicos, tudo se explica por suas propriedades únicas.
O comportamento químico do carbono começou a ser explicado através dos estudos de dois cientistas do século XIX, Archibald Scott Couper (1831-1892) e Friedrich August Kekulé (1829-1896). Estes estudiosos deram nome aos postulados de “Couper-Kekulé”, vamos conhecer agora as propriedades do carbono detalhadas por este conceito:
1° postulado: O átomo de carbono é tetravalente
A tetravalência do carbono é sua propriedade de formar quatro ligações covalentes, ou seja, ele disponibiliza quatro elétrons ligantes. Isso porque em sua camada de valência o átomo de carbono possui 4 elétrons livres.
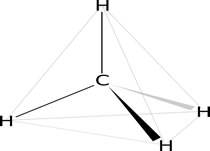
Metano: molécula formada pela ligação de 4 átomos de Hidrogênio (H) a 1 átomo de carbono (C).
2° postulado: As quatro unidades de valência do carbono são iguais entre si.
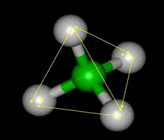
O Fluorometano é um exemplo desta propriedade, só existe um composto com este nome, ele é formado pela substituição de um hidrogênio da molécula de Metano por um átomo de Flúor (F). O Flúor poderá substituir qualquer H da molécula que receberá a mesma nomenclatura, repare na ilustração abaixo:
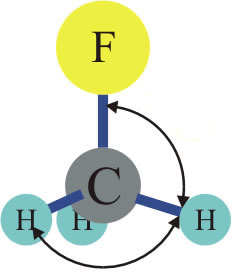
Qualquer posição ocupada pelo átomo de Flúor dará origem ao Fluorometano.
3° postulado: Propriedade de encadeamento – capacidade que átomos de um mesmo elemento têm de formar cadeias moleculares.
.jpg)
Átomos de carbono ligam-se diretamente entre si, formando estruturas denominadas cadeias carbônicas. A variedade de compostos orgânicos existentes na natureza se deve a esta propriedade do Carbono de formar cadeias. O composto acima (decano) é formado por 10 átomos de C interligados.
O carbono não é o único elemento químico que pode formar encadeamentos: alguns outros elementos como o enxofre e o nitrogênio, por exemplo, também apresentam essa característica. No entanto, somente o carbono pode constituir cadeias tão diversificadas, extensas e quimicamente estáveis.
A tetravalência do carbono, sua capacidade de se ligar com vários tipos de elementos químicos e de formar cadeias carbônicas são as propriedades responsáveis pelo enorme número de compostos orgânicos já conhecidos. Por isso, a Química Orgânica é definida como a área da Química que trata dos compostos de carbono com características específicas.
Classificação do Carbono
A classificação do carbonos é baseada na quantidade dos demais átomos de carbono ligado a ele e também os tipos de ligações químicas que ele realiza. Veja abaixo:
O carbono pode ser classificado seguindo vários critérios: um deles se baseia na quantidade dos demais átomos de carbono a ele ligados.
Carbono primário: ligado diretamente, no máximo, a 1 outro carbono;
Carbono secundário: ligado diretamente a 2 outros carbonos
Carbono terciário: ligado diretamente a 3 outros carbonos;
Carbono quaternário: ligado diretamente a 4 outros carbonos.
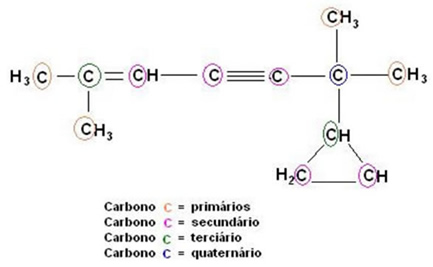
A outra classificação se refere aos tipos de ligação que unem os carbonos.
O carbono pode ser classificado em função das ligações que apresenta:
a) Carbono Saturado: apresenta somente ligações simples, chamadas de sigma (σ).
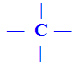
b) Carbonos insaturados: presença de duplas ligações, denominadas de pi (π). Ou ainda, carbono que apresenta ligação tripla. São aqueles que fazem ou uma ligação dupla, ou duas duplas ou uma tripla.
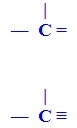
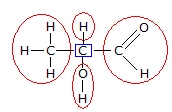
c) Carbono assimétrico
É chamado de carbono assimétrico o carbono que fizer ligações com quatro ligantes diferentes. Ligantes são considerados toda a parte da cadeia que se extende de uma ligação. Na figura abaixo, o carbono destacado é assimétrico, e circulados estão os seus quatro ligantes:
A figura abaixo ilustra as classificações citadas acima:
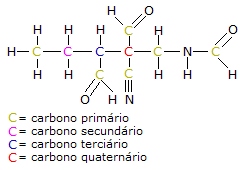
Cadeia carbônica
Os átomos de carbono têm como característica principal a propriedade de se unirem formando estruturas denominadas cadeias carbônicas. É essa capacidade de se encadear que possibilita a existência de milhões de compostos orgânicos diferentes. Além de átomos de carbono, as cadeias podem apresentar átomos de outros elementos, desde que eles se localizem entre os átomos de carbono. Os elementos mais frequentes no encadeamento são H, O, N, S, P, que são denominados heteroátomos.
Átomos como o hidrogênio e halogênios também podem fazer parte de compostos orgânicos, mas como esses átomos são monovalentes, eles nunca farão parte da cadeia carbônica, apenas da molécula.
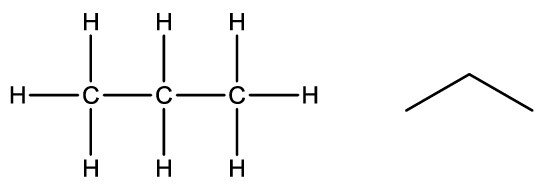
Para representar as cadeias carbônicas de maneira mais simples, é comum utilizar a notação em bastão, que indica cada ligação entre carbonos por traços (—) e cada carbono se transforma em um ponto de inflexão ou nas extremidades dos traços.
Cadeia carbônica é o conjunto de todos os átomos de carbono e de todos os heteroátomos que constituem a molécula de qualquer composto orgânico.
Outra maneira de simplificar a representação, podemos indicar, por meio de índices, a quantidade de átomos de hidrogênio e carbono presente na estrutura:
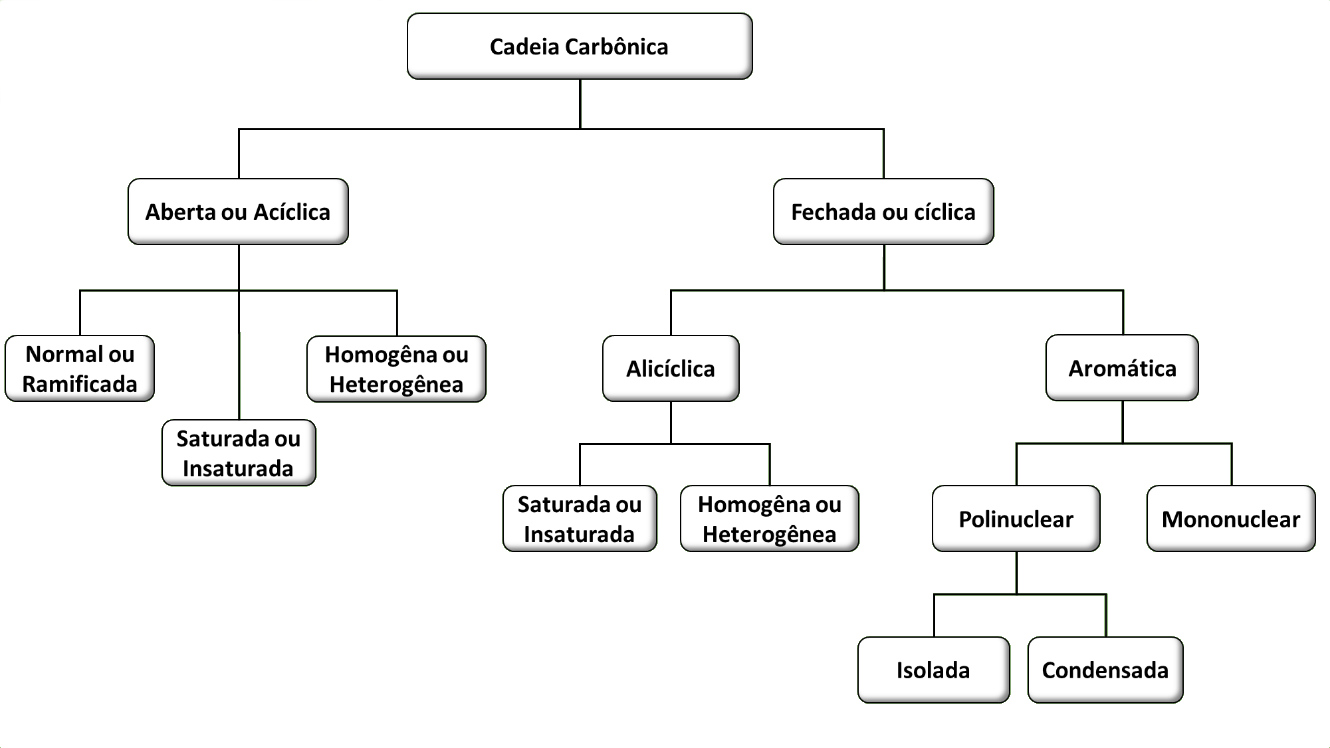
Classificação das cadeias carbônicas
As cadeias carbônicas podem se classificam através de vários fatores:
1- Cadeia aberta ou acíclica
Nessa cadeia, os átomos de carbono não formam ciclo.
Cadeia fechada ou cíclica
Nessa cadeia, os átomos de carbono formam ciclo ou anéis.
II) Classificação das cadeias acíclicas ou abertas
A) Quanto à disposição dos átomos
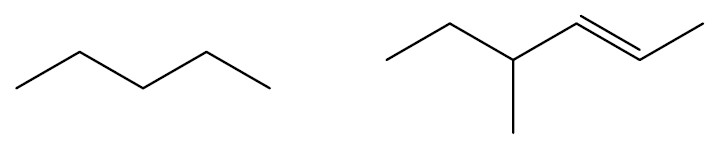
Cadeia acíclica normal ou reta:
A única que apresenta átomos de carbono primário e secundário, com duas extremidades.
Cadeia acíclica ramificada:
Apresenta pelo menos um átomo de carbono terciário ou quaternário, com mais de duas extremidades.
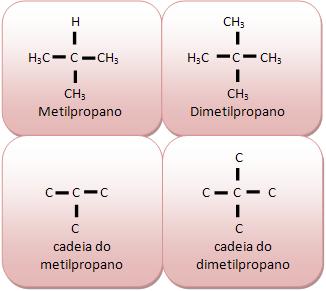
A cadeia do composto ao lado apresenta átomos de carbono primário e secundário com três extremidades considerada ramificada.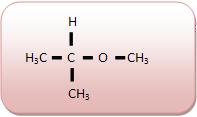 |
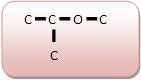
B) Quanto à natureza dos átomos
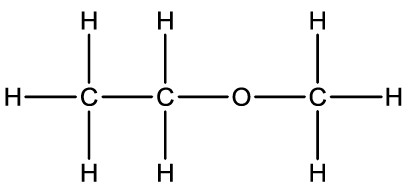
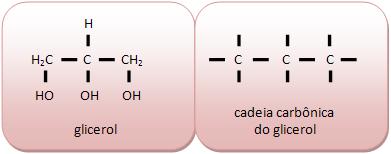
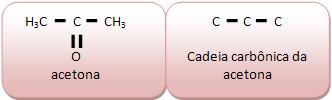
Cadeia homogênea:
Não apresenta átomos diferentes de caborno intercalados na cadeia, como as cadeias carbônicas de metilpropano e dimetilpropano, acetona e glicerol.
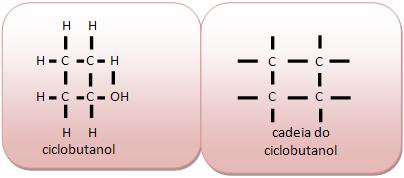
Cadeias heterogênea:
Apresenta átomos diferentes de carbono intercalados na cadeia. Os átomos diferentes recebem o nome de heteroátomos.
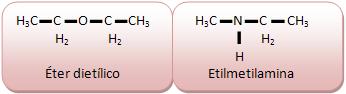
O oxigênio e o nitrogênio são considerados heteroátomos das referidas cadeias carbônicas. Somente os átomos com valência maior que 1 podem ser heteroátomos.
C) Quanto ao tipo de ligação entre os átomos de carbono
Cadeia saturada:
Os átomos de carbono ligam-se entre si, por ligações, como todas as cadeias carbônicas dos compostos mencionados até o momento.
Cadeia insaturada ou não-saturada
Apresenta uma dupla ou tripla ligação entre átomos de carbono.
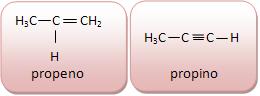
A cadeia carbônica do ácido acético é homogênea, pois entre os átomos de carbono não existe nenhum heteroátomo e na saturada entre os dois átomos de carbono existe apenas uma ligação simples. Vejamos:
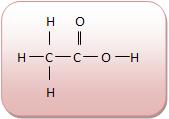
III) Classificação das cadeias cíclicas ou fechadas
A) Quanto à natureza dos átomos
Cadeia homocíclica ou cíclica homogênea: em seu anel existem apenas átomos de carbono.
Cadeia heterocíclica ou heterogênia: em seu anel existem átomos diferentes de carbono. Vejamos:
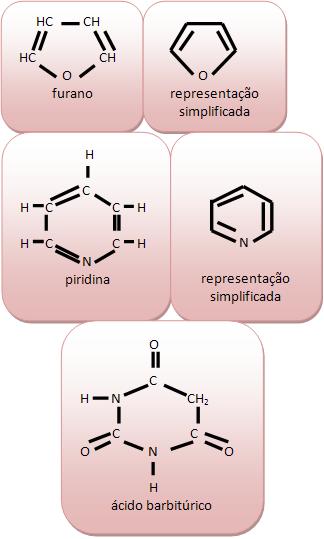
B) Classificação das cadeias homocíclicas
As cadeias homocíclicas são classificadas como cadeias alicíclicas.
As Cadeias alicíclicas não contêm núcleo benzênico. Vejamos:
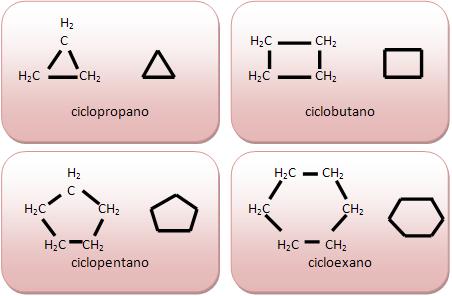
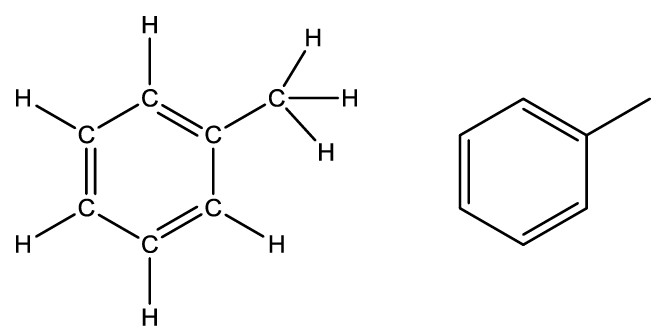
Cadeias aromáticas contêm núcleo benzênico, classificados em cadeia aromática.
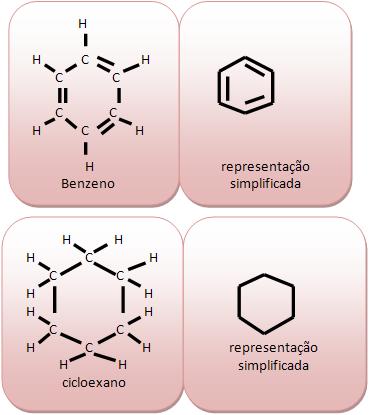
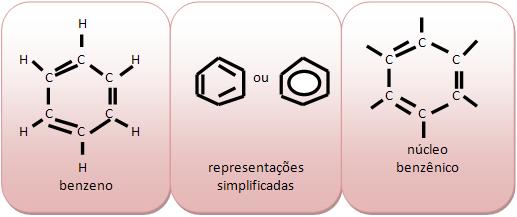
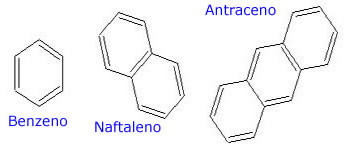
O benzeno (C6H6) é um líquido incolor, que tem odor agradável, mas com vapores átoxicos, imiscíveis com água. Normalmente é usado como solvente, na fabricação de corantes, plásticos, medicamentos, explosivos. Encontrado no alcatrão de hulha, uma das frações provinientes da destilação seca da hulha, carvão mineral contendo aproximadamente 80% de carbono.
A molécula do benzeno (C6H6) é composta por seis átomos de carbono, que são ligados alternadamente, por simples e duplas ligações.
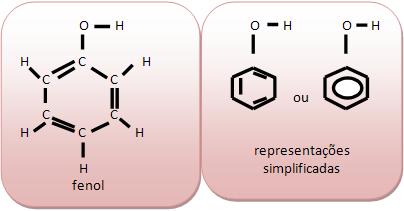
O fenol comum (C6H5OH) é considerado um sólido, pouco solúvel em água, empregado como desinfetante, na fabricação de corantes, plásticos.
A cadeia aromática pode ser composta por mais de um núcleo benzênico.
Cadeia aromática de núcleos isolados seus anéis não possuem átomos de carbono em comum.
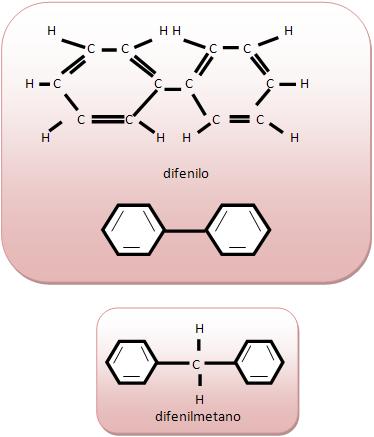
Cadeia aromática de núcleos condensados seus anéis possuem átomos de carbono comum.
Naftalleno ou naftalina (C10H8) é considerada um sólido branco que sofre sublimação para ser usado como inseticida sendo encontrado no alcatrão de hulha.
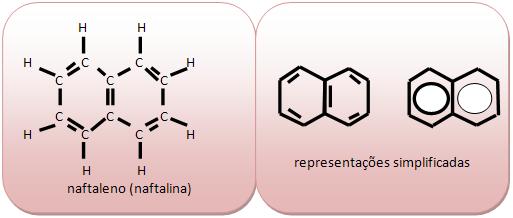
Cadeia alifática
• Existe uma certa divergência entre os autores quanto a classificação das cadeias.
• Alguns autores usam o termo cadeia alifática como sinônimo de cadeia aberta ou acíclica.
• Outros autores classificam como alifáticas as cadeias não-aromáticas.
A afirmação mais correta seria as cadeias e as alicíclicas seriam alifáticas.
Classificação das cadeias carbônicas
As cadeias carbônicas podem ser classificadas de diversas maneiras:
Quanto à disposição dos átomos de carbono
Cadeia aberta, alifática ou acíclica: é composta pelo menos de duas extremidades e não apresenta ciclos na cadeia.
Cadeia fechada ou cíclica: não apresenta extremidades e os átomos fecham em pelo menos um ciclo.
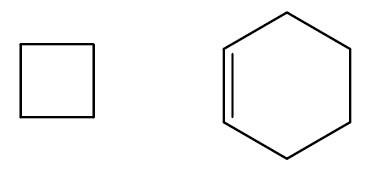
As cadeias fechadas ou cíclicas ainda se dividem em dois grupos: aromáticas e não aromáticas.
Cadeias aromáticas: possuem pelo menos um anel aromático, que é um anel que contém ligações duplas alternadas. Podem ser ramificadas ou não.
Observação:
A cadeia carbônica cíclica que contém seis átomos de carbono com três duplas ligações alternadas é denominada Aromática; esse anel chama-se Benzênico. Se a cadeia é fechada sem anel benzênico é denominada alicíclica.
Exemplo: Cadeias aromáticas:


Exemplo: Cadeias alicíclicas
As cadeias aromáticas, podem ainda, ser divididas entre mononucleares (um núcleo) ou polinucleares (mais de um núcleo). As polinucleares podem ser isoladas (núcleos não compartilham átomos) ou condensadas (núcleos compartilham átomos).
Cadeias não aromáticas ou alicíclicas: possuem uma cadeia fechada, porém que não tem as ligações duplas alternadas.
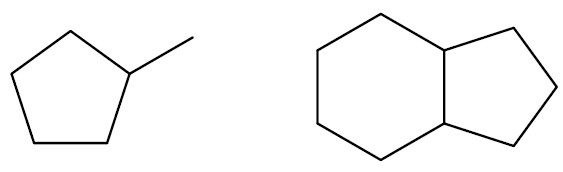
Cadeia normal ou linear: apresenta somente duas extremidades, sem ramificações.

Cadeia ramificada: apresenta no mínimo três extremidades, pois possuem ramificações.
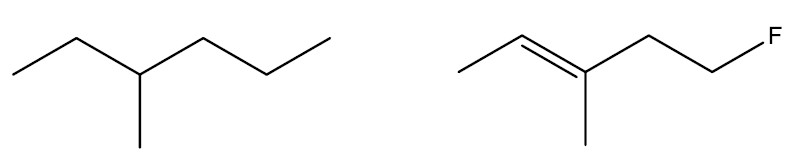
Quanto ao tipo de ligação entre os átomos de carbono
Cadeia saturada: só possui ligações simples em sua estrutura.
Cadeia insaturada: possui pelo menos uma ligação dupla ou tripla em sua estrutura.
Quanto a natureza dos átomos que compõem a cadeia
Cadeia homogênea: possui apenas átomos de carbono na extensão da cadeia.
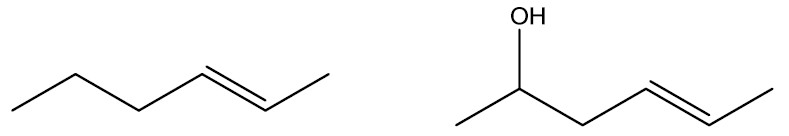
Note que a presença de um átomo diferente de carbono na ponta da cadeia não configura ela como heterogênea.
Cadeia heterogênea: possui a presença de heteroátomos.
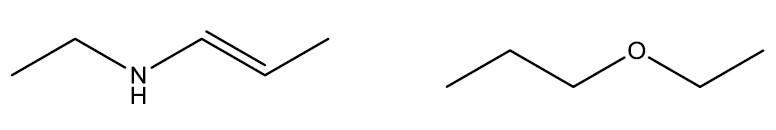
Em algumas situações, as cadeias podem ser abertas e fechadas simultaneamente, devido a presença de uma ramificação. Nestes casos, chamamos estas cadeias de mistas.
Em geral, para se classificar uma cadeia, segue-se o seguinte raciocínio:
Classificação das cadeias carbônicas fechadas
A classificação das cadeias carbônicas fechadas utiliza como referência a presença de núcleo benzênico, ligações pi ou heteroátomos.
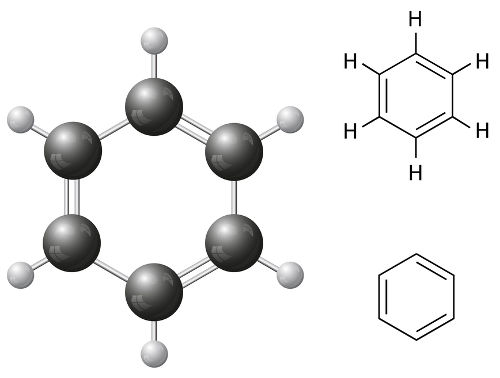
O benzeno é um dos principais exemplos de substância com cadeia carbônica fechada
A classificação das cadeias carbônicas fechadas é um importante tópico estudado na química orgânica, pois, a partir desse conhecimento, é possível construir a fórmula estrutural de um composto orgânico, como ciclenos, alcoóis cíclicos, aromáticos, cetonascíclicas, éteres cíclicos, etc.
Para realizar a classificação das cadeias carbônicas fechadas, iniciamos pela divisão em dois grandes grupos:
- Cadeia carbônica fechada aromática;
- Cadeia carbônica fechada não aromática.
Classificação das cadeias carbônicas fechadas aromáticas
As cadeias fechadas aromáticas apresentam como principal característica a presença de um ciclo, que contém:
- Seis átomos de carbono;
- Seis átomos de hidrogênio;
- Um átomo de hidrogênio em cada carbono;
- 3 ligações duplas;
- 3 ligações simples;
- Ligações simples e duplas alternadas entre si.
Esse ciclo, com essas características, tem o nome oficial de benzeno. Um ponto fundamental é que ocorre no benzeno um fenômeno denominado de ressonância, no qual as ligações duplas trocam de posição de forma ininterrupta, alterando constantemente sua posição. Por essa razão, é comum simbolizar as três duplas apenas por um círculo, que representa a ressonância.
Fórmula estrutural do benzênico com o anel
a) Aromáticas mononucleares
São as cadeias aromáticas que apresentam apenas um benzeno, que está ligado a outro elemento (por exemplo, o cloro), grupo substituinte (como o radical metil, CH3) ou um grupo funcional (como a carboxila).
Exemplos de aromáticos mononucleares
b) Aromáticas polinucleares
- Com núcleos isolados
Nesse tipo de cadeia carbônica aromática, há a presença de dois ou mais núcleos benzênicos, porém separados por um átomo de um elemento (por exemplo, um oxigênio) ou grupo funcional (por exemplo, a carbonila de uma cetona).
Fórmula estrutural de um aromático isolado por um elemento químico
Fórmula estrutural de um aromático isolado por um grupo funcional de cetona
- Com núcleos condensados
Nesse tipo de cadeia carbônica fechada aromática, temos a presença de dois ou mais núcleos benzênicos, unidos entre si, ou seja, existem carbonos e ligações em comum nas estruturas.
Fórmula estrutural do naftaleno
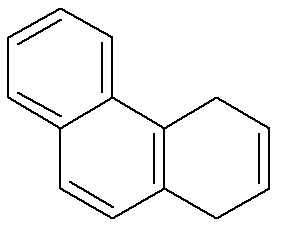
As cadeias aromáticas podem ser classificadas de acordo com o número de anéis aromáticos:
– mononuclear: quando possui apenas um núcleo (anel aromático)
– polinuclear: quando possui vários anéis aromáticos.
Os aromáticos polinucleares podem ser classificados em:
– polinucleares isolados: quando os anéis não possuem átomo de carbono em comum.
– polinuclear condensado: quando os anéis possuem átomos de carbono em comum.
- Cadeia carbônica fechada não aromática.
– saturada: cadeia que possui apenas ligações simples entre os átomos.
– insaturada: cadeia que possui uma dupla ligação entre carbonos.
Podem ser classificadas de acordo com a presença ou não de um heteroátomo:
– homogênea ou homocíclicas: possuem somente átomos de carbonos ligados entre si.
– heterogênea ou heterocíclica: possuem um heteroátomo entre átomos de carbono.
Cadeias mistas
As cadeias carbônicas mistas são abertas e também fechadas.
Hidrocarbonetos e nomenclatura
por bbraga | março 4, 2019 | Uncategorized
Petróleo como principal fonte de hidrocarbonetos O que são hidrocarbonetos?
Os hidrocarbonetos são um grupo de compostos orgânicos que possui apenas átomos dos elementos carbono e hidrogênio, CxHy, cuja principal fonte na natureza é o petróleo.
Eles são os compostos mais importantes estudados em Química Orgânica e utilizados no cotidiano. São geralmente obtidos a partir do petróleo e, por isso, estão presentes nos seus derivados, como a gasolina, o querosene, o óleo diesel, o GLP (Gás Liquefeito de Petróleo), o gás natural, a parafina, a vaselina, vários polímeros, como os plásticos e as borrachas, entre outros. Para se ter uma ideia, eles correspondem a 48% da matriz energética brasileira.
Eles são compostos apolares cujas moléculas apresentam interação fraca do tipo dipolo induzido. Por essa razão, são solúveis em outras substâncias apolares, mas são praticamente insolúveis na água, que é polar. Os hidrocarbonetos são menos densos que a água e a maioria é pouco reativa. Os hidrocarbonetos que possuem de 1 a 5 carbonos são gasosos, como o gás metano (CH4). Os que possuem de 5 a 17 átomos de carbono são líquidos, como um dos principais constituintes da gasolina, o isoctano (C8H19). Os que possuem mais de 17 átomos de carbono são sólidos, como o C36H74, que é um dos componentes da parafina.

Existem milhares de hidrocarbonetos. Alguns exemplos bem conhecidos são:
- o metano, ou gás natural, usado em veículos;
- o propano e o butano, usados em gás de cozinha;
- A gasolina o octano;é uma fração do petróleo composta por uma mistura de hidrocarbonetos
Classificação dos hidrocarbonetos
Apesar de todos os hidrocarbonetos compartilharem a mesma definição básica, alguns tipos apresentam características específicas e, assim, formam grupos diferentes. Vamos ver quais são esses grupos?
Alifáticos
Os hidrocarbonetos alifáticos são aqueles em que a cadeia de carbonos é aberta, ou acíclica.
Cíclicos
Os hidrocarbonetos cíclicos são aqueles em que a cadeia de carbonos tem uma formação cíclica. Isso quer dizer que não há “carbonos terminais”. Um hidrocarboneto pode ser cíclico e, ainda assim, ter um átomo de carbono fora do ciclo.
Saturados
Os hidrocarbonetos saturados são aqueles em que as ligações entre os átomos são simples.
Insaturados
Os hidrocarbonetos insaturados são aqueles em que há ligações duplas ou triplas entre os átomos.
Homogênea
Os hidrocarbonetos de cadeia homogênea são aqueles em que não há nenhum átomo diferente de carbono ou hidrogênio.
Heterogênea
Os hidrocarbonetos de cadeia heterogênea são aqueles em que há átomos de outros elementos.
Visto que o carbono é tetravalente (pode realizar quatro ligações), ele liga-se de maneiras diferentes com outros átomos de carbono e com hidrogênios por meio de ligações simples, duplas e triplas. Com base nisso, os hidrocarbonetos podem ser subdivididos em diferentes grupos, que são:
* Alcanos: Quando há somente ligações simples entre carbonos. São também chamados de parafinas (do latim oleum, que é “óleo”, e affinis, que significa “afinidade”, pois são compostos oleosos).

As velas são constituídas fundamentalmente por uma mistura de alcanos
Sua fórmula geral é dada por CnH2n + 2 (em que n = qualquer número inteiro):
Exemplos:
CH4: n = 1;
H3C ─ CH3: C2H6: n = 2;
H3C ─ CH2 ─ CH2 ─ CH3: C4H10: n = 4.
* Alcenos: Quando há uma ligação dupla entre carbonos. São também chamados de olefinas (do latim parum, que é “pequena”, e affinis, que significa “afinidade”, ou seja, “pequena afinidade”, pois são compostos pouco reativos).
Sua fórmula geral é dada por CnH2n:
Exemplos:
H2C ═ CH2: C2H4;
H2C ═ CH─ CH3: C3H6;
H3C ─ CH═ CH─ CH3: C4H8.
* Alcinos: Quando há uma ligação tripla entre carbonos.
Sua fórmula geral é dada por CnH2n-2:
Exemplos:
HC ≡ CH: C2H2;
HC ≡ C─ CH3: C3H4;
H3C ─ C ≡ C─ CH3: C4H6.
* Alcadienos: Quando há duas ligações duplas entre carbonos.
Sua fórmula geral é CnH2n-2:
Exemplos:
H2C ═ HC ─ CH ═ CH2: C4H6;
H3C ─ H2C ─ CH ═ C ═ CH2: C5H8.
* Hidrocarbonetos cíclicos: Quando sua estrutura apresenta cadeia fechada.
Ciclanos
Os hidrocarbonetos cíclicos e saturados são chamados de ciclanos.
Ciclenos
Os hidrocarbonetos cíclicos e insaturados, que apresentam uma ligação dupla entre seus átomos de carbono, são chamados de ciclenos.
Ciclinos
Os hidrocarbonetos cíclicos e insaturados, que apresentam uma ligação tripla entre seus átomos de carbono, são chamados de ciclinos.
Exemplos:

Exemplos de hidrocarbonetos cíclicos
* Aromáticos: hidrocarbonetos cíclicos que são compostos por, no mínimo, um anel de benzeno são chamados de aromáticos. O anel de benzeno é o nome dado à estrutura C6H6 característica do benzeno.
Alguns compostos que não apresentam a estrutura do benzeno também são considerados aromáticos. Eles seguem a Regra de Hückel, segundo a qual o número de elétrons π (pi) é igual a 4n + 2, onde n = 0, 1 , 2, 3…
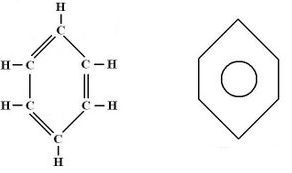
Fórmula estrutural do benzeno e fórmula estrutural simplificada
Aplicação do hidrocarboneto na produção energética
O petróleo é a base principal para a produção de energia e fonte de matérias-primas inúmeras para diferentes tipos de indústrias em nossa sociedade. É uma mistura constituída majoritariamente de hidrocarbonetos e impurezas presentes nos poços dos quais são extraídos. Estes hidrocarbonetos, após separados do petróleo, podem ser utilizados em diferentes tipos de motores para geração de energia devido a uma característica comum destes compostos, a combustão.
COMBUSTÃO
A combustão dos hidrocarbonetos produz gás carbônico (CO ), H
), H O e energia, que pode ser aproveitada para produção de trabalho mecânico.
O e energia, que pode ser aproveitada para produção de trabalho mecânico.
C![]() H
H![]() + O
+ O![]() ⇌ CO
⇌ CO![]() + H
+ H![]() O + energia (equação não balanceada)
O + energia (equação não balanceada)
Segundo o INEA (Instituto Estadual do Ambiente), um dos problemas associados à frota crescente de veículos é a emissão crescente de CO![]() , que é um gás estufa e contribui para o agravamento do efeito estufa.
, que é um gás estufa e contribui para o agravamento do efeito estufa.
Nomenclatura de hidrocarbonetos
Os hidrocarbonetos são compostos orgânicos caracterizados por possuírem apenas átomos de carbono e hidrogênio. Conforme mostrado no texto “Nomenclatura IUPAC”, a nomenclatura dos compostos dessa função, que não apresentam ramificações e são de cadeia aberta, segue a seguinte regra básica:
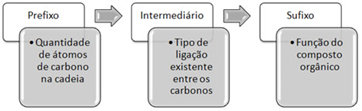
Nomenclatura: prefixo (número de carbonos) + (infixo) indicativo de ligação +(sufixo) O (terminação de função hidrocarbonetos).
Prefixos: observe abaixo a tabela de prefixos que servirá para determinar a nomenclatura de todos os compostos orgânicos.
Prefixo
O prefixo da nomenclatura está relacionado ao número de carbonos encontrados na cadeia principal da molécula. Os prefixos são:
Infixo
O infixo da nomenclatura está relacionado ao tipo de ligação encontrada na molécula de hidrocarboneto. Os infixos são:
- Ligações simples apenas: AN

- 1 ligação dupla: EN



.jpg)
- 1 ligação tripla: IN


- 2 ligações duplas: DIEN
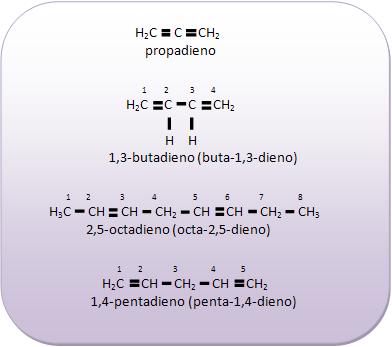
O sufixo dieno mostra que há duas duplas-ligações e os números indicam as posições das ligações.
Ao apresentar duas duplas-ligações no mesmo átomo de carbono, o alcadieno ficará acumulado:
Propa-1,2-dieno CH2=CH=CH2-CH2-CH3 Alcadieno Acumulado
Se apresentar duplas-ligações alternadas, ficará denominado como conjugado.
buta-1,3-dieno CH2=CH-CH=CH2
Se as duplas-ligações estiverem mais separadas, teremos um alcadieno isolado.
penta-1,4-dieno CH2=CH-CH2-CH=CH2
- 2 ligações triplas: DIIN
Sufixo
O sufixo é responsável por indicar a função orgânica. No caso dos hidrocarbonetos, o sufixo é sempre “o”.
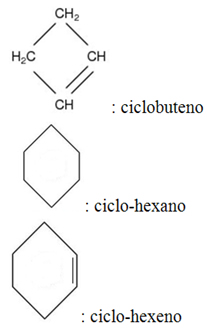
Ciclanos: cadeia fechada saturada
Ciclanos (cicloalcanos) são os hidrocarbonetos que fazem parte da cadeia fechada, saturados e apresentam apenas ligações simples entre os átomos de carbono.
Fórmula geral:

A nomenclatura continua com a mesma regra, basta apenas adicionar a palavra ciclo antes do nome do alcano correspondente.
.jpg)
.jpg)
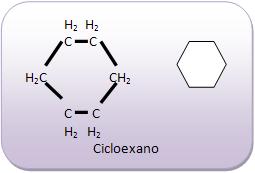
Ciclenos: cadeia fechada com uma ligação dupla
Ciclenos são todos os hidrocarbonetos de cadeia fechada, insaturados que apresentam dupla-ligação.
Fórmula geral:
A nomenclatura continua com a mesma regra dos ciclanos, basta apenas adicionar a palavraeno, que representa a dupla-ligação entre os átomos de carbono.


Nomenclatura de hidrocarbonetos ramificados
A nomenclatura de hidrocarbonetos ramificados depende do tipo de hidrocarboneto utilizado, em razão da sua localização na cadeia principal.
Saber reconhecer um hidrocarboneto é muito importante, pois, com essa habilidade, é possível desenvolver outra, que é realizar corretamente a nomenclatura de hidrocarbonetos ramificados. Esses compostos podem ter representantes nas seguintes subclasses:
- Alcanos
- Alcenos
- Alcinos
- Alcadienos
- Ciclanos
- Ciclenos
- Aromáticos
Os hidrocarbonetos ramificados são todos aqueles cujas cadeias possuem mais de dois carbonos primários (se abertas) e pelo menos um carbono primário (se fechadas), como mostrado nos exemplos abaixo:
Cadeia aberta com pelo menos três carbonos primários
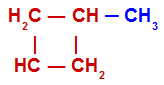
Cadeia fechada com pelo menos um carbono primário
Para realizar a nomenclatura de um hidrocarboneto ramificado, é necessário identificar a cadeia principal, que, geralmente, apresenta o maior número de carbonos. Para isso, temos que levar em consideração a classe dos hidrocarbonetos com a qual estamos trabalhando, como relatado em cada caso:
- A nomenclatura dos ramos “normais” que se ligam à cadeia principal acrescentamos ao prefixo a terminação “il”:
a) Nomenclatura de alcanos ramificados
Passo 1: A cadeia principal de um alcano é sempre aquela que apresentar o maior número de carbonos e o maior número de ramificações;
Passo 2: A numeração da cadeia deve ser iniciada sempre pela extremidade que estiver mais próxima das ramificações;
Passo 3: Ramificações em ordem alfabética com o número de carbono da cadeia principal
Passo 4: Se acontecer de ter mais de uma possibilidade de cadeia com a mesma quantidade de carbonos, você deverá escolher aquela que tiver maior número de ramificações.
Passo 5: Para finalizar, basta utilizar a seguinte regra:
Posições e nomes das ramificações separados por hifens + Prefixo do número de carbonos da cadeia principal + ano
Veja um exemplo:
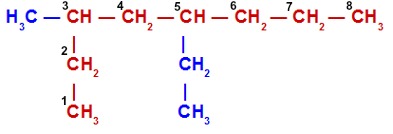
Alcano com duas ramificações
Nesse alcano, a cadeia principal inicia-se no CH3 da parte inferior esquerda e segue para a direita até chegar ao último CH3. Isso acontece porque essa cadeia apresenta o maior número de carbonos (no caso oito – prefixo oct) e ramificações.
A numeração também se inicia no CH3 da parte inferior esquerda, pois ele está mais próximo das ramificações. Dessa forma, temos as ramificações metil (1 carbono) e etil (2 carbonos) ligadas à cadeia principal. Assim sendo, o nome do composto é, seguindo a ordem alfabética, 5-etil-3-metiloctano.
Assim, a nomenclatura dos hidrocarbonetos ramificados de cadeia aberta segue a seguinte ordem:
Agora, veja os exemplos a seguir:
H3C — CH2 — 4CH — 3CH2 — 2CH2 — 1CH3 : 4-etil-heptano
│
5CH2
│
6CH2
│
7CH3
1CH3 │
H3C — CH2 — 3 CH — 2CH — CH3: 3-etil-2,4-dimetilpentano
│
H35C — 4CH2
│
CH3
b) Nomenclatura de alcenos ramificados
Passo 1: Em qualquer alceno, a cadeia principal deve apresentar sempre todos os carbonos que participam das duas duplas e o maior número de carbonos possível. Assim, tudo que ficar de fora da cadeia é ramificação;
Passo 2: A numeração da cadeia principal do alceno deve começar sempre pelo carbono mais próximo das duas duplas e, se possível, haver o menor número possível para as ramificações;
Passo 3: Para finalizar, basta utilizar a seguinte regra:
Posições e nomes das ramificações separados por hifens + Prefixo do número de carbonos da cadeia principal + Posição da dupla + eno
Veja um exemplo:
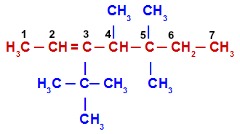
Alceno com quatro ramificações
Nesse exemplo, a cadeia principal e a numeração começarão pelo CH3 (o primeiro da esquerda para direita), pois ele está mais próximo da ligação dupla e essa cadeia apresenta o maior número de carbonos possível. Dessa forma, as ramificações são 1 terc-butil e 3 metil. Assim sendo, o nome do composto, seguindo a ordem alfabética, é 3-terc-butil-4,5,5-trimetil-hept-2-eno.
Obs.: O termo Terc não participa da ordem alfabética por ser utilizado apenas para indicar o tipo de ramificação butil presente na cadeia.
c) Nomenclatura de alcinos ramificados
Passo 1: Em qualquer alcino, a cadeia principal deve apresentar sempre os carbonos que participam da tripla ligação e o maior número de carbonos possível. Assim, tudo que ficar de fora da cadeia é ramificação;
Passo 2: A numeração da cadeia principal do alcino deve iniciar-se sempre pelo carbono mais próximo das duas duplas e, se possível, haver o menor número possível para as ramificações;
Passo 3: Para finalizar, basta utilizar a seguinte regra:
Posições e nomes das ramificações em ordem alfabética separados por hifens + Prefixo do número de carbonos da cadeia principal + a + Posições da tripla + ino
Veja um exemplo:
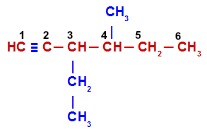
Alcino com duas ramificações
Nesse exemplo, a cadeia principal e a sua numeração começam pela esquerda (por conter a tripla) e seguem até o CH3, pois essa é a cadeia que apresenta o maior número de carbonos possível (total de seis carbonos – prefixo hex). Dessa forma, temos as ramificações metil (1 carbono) e etil (2 carbonos). O nome do composto, seguindo a ordem alfabética, é 3-etil-4-metil-hex-1-ino.
d) Nomenclatura de alcadienos ramificados
Passo 1: Em qualquer alcadieno, a cadeia principal deve apresentar todos os carbonos que participam das duas duplas ligações e o maior número de carbonos possível. Assim, tudo que ficar de fora da cadeia é ramificação;
Passo 2: A numeração da cadeia principal do alcadieno deve começar sempre pelo carbono mais próximo das duas duplas e, se possível, haver o menor número possível para as ramificações;
Passo 3: Para finalizar, basta utilizar a seguinte regra:
Posições e nomes das ramificações em ordem alfabética separados por hifens + Prefixo do número de carbonos da cadeia principal + a + Posições das duplas separadas por vírgulas + Dieno
Veja um exemplo:
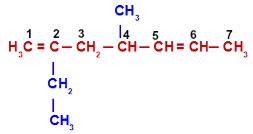
Alcadieno com duas ramificações
A cadeia principal começa à esquerda e termina à direita por ter as duas duplas e o maior número de carbonos possível (sete carbonos – prefixo é hept). Dessa forma, permanecem as ramificações metil (1 carbono) e etil (2 carbonos). Já a numeração iniciou-se à esquerda por estar mais perto das duas duplas. O nome do composto, seguindo a ordem alfabética, é 2-etil-4-metil-hepta-1,5-dieno.
e) Nomenclatura de ciclanos ramificados
Passo 1: Independentemente do ciclano, ele sempre estará na cadeia principal. Assim, qualquer grupo localizado fora da cadeia principal é considerado uma ramificação;
Passo 2: A numeração da cadeia do ciclano é realizada apenas se ele apresentar mais de uma ramificação e inicia-se sempre pelo carbono da ramificação, que é escrita primeiro e segue a ordem alfabética;
Passo 3: Para finalizar, basta utilizar a seguinte regra:
Posições e nomes das ramificações em ordem alfabética separados por hifens + ciclo + Prefixo do número de carbonos da cadeia principal + ano
Veja um exemplo:
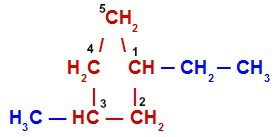
Etil e metil em um ciclano
A cadeia principal é o ciclo com cinco carbonos (prefixo pent). A numeração da cadeia inicia-se a partir do carbono que apresenta a ramificação etil (que é escrito primeiramente por causa da ordem alfabética) e segue no sentido horário para possibilitar o menor número possível para a ramificação metil (um carbono). O nome desse composto, seguindo a ordem alfabética, é 1- etil-3-metil-ciclopentano.
f) Nomenclatura de ciclenos ramificados
Passo 1: O cicleno sempre estará na cadeia principal. Assim, qualquer grupo localizado fora da cadeia principal é considerado uma ramificação;
Passo 2: A numeração da cadeia do cicleno inicia-se obrigatoriamente em um dos carbonos da ligação dupla, sendo obrigatório que o carbono número 2 seja o outro carbono da dupla. O restante da numeração da cadeia é feito para dar o menor número possível para as ramificações;
Passo 3: Para finalizar, basta utilizar a seguinte regra:
Posições e nomes das ramificações em ordem alfabética separados por hifens + ciclo + Prefixo do número de carbonos da cadeia principal + eno
Veja um exemplo:
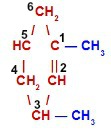
Cicleno com duas ramificações
A cadeia principal é o ciclo, que apresenta seis carbonos; logo, o prefixo é hex ou ex. Dessa forma, há duas ramificações metil na cadeia. A numeração inicia-se no carbono da dupla que tem a ramificação e segue o sentido horário para proporcionar o menor número para a outra ramificação. O nome desse composto é 1,3-dimetil-cicloexeno.
- Hidrocarbonetos cíclicos:
A única diferença entre os hidrocarbonetos de cadeia aberta e os de cadeia cíclica é a presença do prefixo “ciclo”.
Exemplos:
- Hidrocarbonetos Aromáticos:
Não existe uma regra geral para nomear os Hidrocarbonetos Aromáticos, em geral, esses compostos apresentam uma nomenclatura particular.
Quando sua cadeia principal apresentar apenas um anel benzênico, ela é chamada benzeno e pode apresentar um ou mais grupos substituintes. Vejamos as fórmulas estruturais dos aromáticos mais comuns:
g) Nomenclatura de aromáticos ramificados
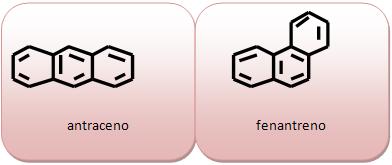
O aromático (benzeno, naftaleno, antraceno e fenantreno) sempre estará na cadeia principal. Logo, qualquer grupo localizado fora da cadeia principal é considerado uma ramificação. Veja a regra de nomenclatura:
Nome ou nomes das ramificações em ordem alfabética + Nome do Aromático
Veja um exemplo:
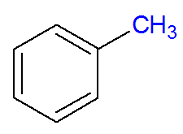
Ramificação metil ligada ao aromático benzeno
Como a cadeia apresenta apenas uma ramificação, não há necessidade de indicar a posição da ramificação. Logo, o nome do composto é metil-benzeno, haja vista que a ramificação, que tem apenas um carbono (met), está ligada ao aromático benzeno.
- Caso o aromático apresente mais de uma ramificação, é necessário numerar a cadeia. A numeração inicia-se sempre a partir do carbono que possui a ramificação, que é escrita primeiro por causa da ordem alfabética. Veja um exemplo:
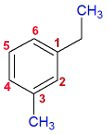
A numeração dessa cadeia aromática inicia-se a partir do etil
Como a cadeia principal é o benzeno, já partimos para a numeração. Devemos priorizar o carbono que possui o etil e seguir no sentido horário para proporcionar o menor número possível para o metil. O nome do composto é: 1-etil-3metil-benzeno.
- Se o aromático não for o benzeno, a cadeia deve ser numerada independentemente da quantidade de ramificações. A numeração sempre se inicia por um dos carbonos da vertical (de cima ou da parte de baixo) e deve dar o menor número possível às ramificações e respeitar a ordem alfabética, caso tenha mais de uma ramificação.
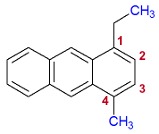
Antraceno com duas ramificações
O antraceno, que é a cadeia principal, é numerado pelo carbono vertical de cima, porque ele possui o etil. Em seguida, a numeração segue no sentido horário em direção ao metil. O nome do composto é 1-etil-4-metil-antraceno.
Radicais
Radicais são todos os agrupamentos atômicos que contêm uma ou mais valências livres e que não podem ocorrer em liberdade. A nomenclatura leva a regra de apenas adicionar a palavra il ou ila nas terminações do nome.
O radical é uma partícula eletricamente neutra, ao inverso do íon que possui carga elétrica.
- Radicais alquilas ou alcoílas
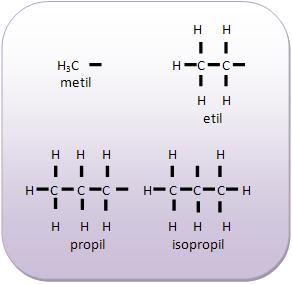
São considerados radicais monovalentes que são derivados dos alcanos.
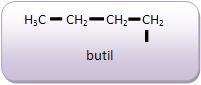
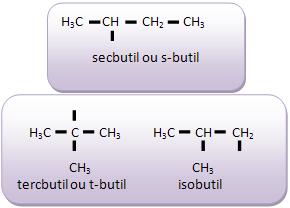
Existem quatros radicais butil (C4H9 –):
- Radicais alquenilas
Os radicais alquenilas são radicais monovalentes decorrentes dos alcenos (alquenos).
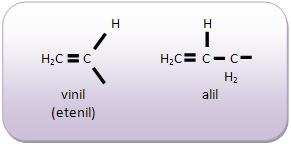
- Radicais alquinilas
Os radicais alquinilas são radicais monovalentes decorrentes dos alcinos (alquinos).
- Radicais arilas
Os radicais arilas são radicais monovalentes, mas sua valência livre está presente em um carbono pertencente em um número de benzênico.
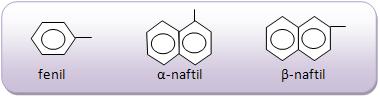
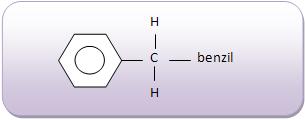
- Observações:
O radical benzil é um radical aromático monovalente, que possui um núcleo benzênico, mas a sua valência livre não está nos carbonos do núcleo. Esta definição está de acordo com a I.U.P.A.C.
As definições de outros autores diferentes:
- Radical alquila apresenta uma valência livre em carbono saturado.
• Radical alquenila possui uma valência livre em carbono de dupla-ligação.
• Radical alquinila apresenta uma valência livre em carbono de tripla-ligação. - Nomenclatura de ramos “não normais”, ou seja, aqueles que apresentam carbonos terciários ou quaternários em suas estruturas.
Já conhecemos o ramo propil:
E o que dizer de um ramo igualmente de três carbonos como este:
Tal ramo é chamado de isopropil e o “i” do “iso” conta para a ordem alfabética no momento de compor o nome do composto orgânico. Qualquer ramificação com algo semelhante em sua extremidade será nomeado com o termo “iso” precedendo o que determina a quantidade de carbonos.
Outras derivações causadas por maior quantidade de carbonos são comuns de se encontrar para o ramo butil
Observe que os carbonos dos ramos que se ligam à cadeia principal são secundário e terciário, respectivamente, em relação ao restante do ramo. Por isso esses nomes.Com cinco, além do isopentil acima mencionado, é comum encontrarmos o neopentil:
Em caso de o ramo ser insaturado, acrescenta-se “en” (dupla) ou “in” (tripla) entre o termo que indica a quantidade de carbonos e a terminação “il”, veja:
Observe que o carbono de número 1 é o carbono ligado à cadeia principal.
Ramos aromáticos e seus derivados:
Resumo de Regras de Nomenclatura de Hidrocarbonetos.
1) Determine a cadeia principal e dê nome a ela.A cadeia principal é aquela que contém a maior quantidade de insaturações, depois ramos e, por fim, carbonos.
2) Reconheça, caso existam, insaturações e ramificações presentes, após isso, seus respectivos nomes.
3) Numere a cadeia principal de modo que se obtenha os menores algarismos possíveis para indicar as posições dos grupos substituintes (ramos) e insaturações, prioridade para estas últimas.
4) Para cadeias que contenham ramos ou insaturações repetidos, os nomes dos serão precedidos de prefixos que indiquem suas quantidades: di, tri, tetra, penta, hexa, etc.
5) Para cadeias que contenham grupos diferentes, os grupos devem ser escritos em ordem alfabética.
6) Prioridade para a insaturação mais próxima da extremidade, em caso de empate, a prioridade é da dupla ligação.
PESQUISA DIRECIONADA – HIDROCARBONETOS E FUNÇÕES ORGÂNICAS
01 Sobre os hidrocarbonetos, abaixo, caracterize e cite exemplos.
a) alcanos.
b) alcinos.
c) alcinos.
02. Apresente a estrutura do
a) dimetilpropano.
b) propino.
c) alqueno.
03. Sobre a octanagem, informe:
a) O conceito.
b) A fórmula do composto cujo grau de octanagem é 100.
04. Sobre o gás natural, informe:
a) suas vantagens.
b) como é obtido.
c) seu nome oficial.
d) sua massa molecular.
05. Apresente o principal componente da gasolina e sua fórmula molecular.
06. Enumere alguns componentes do petróleo.
07. Apresente a fórmula estrutural plana do
3-etil-4,5,5-trimetil-hept-2-eno.
08. A fenilefrina, cuja estrutura está representada abaixo, é usada como descongestionante nasal por inalação.
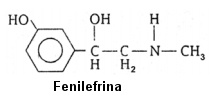
Estrutura da fenilefrina
Sobre a fenilefrina, é correto afirmar que:
01. na sua estrutura existem duas hidroxilas.
02. as funções existentes nesse composto são fenol, álcool e amina.
04. a função amina presente caracteriza uma amina primária, porque só tem um nitrogênio.
08. a função amina presente é classificada como secundária.
16. os substituintes do anel aromático estão localizados em posição meta.
09. Apresente as características do(a)
a)álcool.
b)aldeído.
c)cetona.
d)éter.
e)fenol.
10. Qual das afirmativas a seguir sobre funções orgânicas está incorreta?
a) Todo hidrocarboneto possui apenas carbono e hidrogênio.
b) Os haletos orgânicos são derivados da substituição de um ou mais hidrogênios por átomos de halogênios.
c) Os aldeídos possuem o grupo carbonila entre dois átomos de carbono.
d) Tanto as cetonas quanto os aldeídos possuem o grupo carbonila.
e) As aminas são derivadas da amônia pela substituição de um, dois ou três hidrogênios por cadeias carbônicas.
Exercícios de hidrocarbonetos
A partir dos conceitos que você acabou de ver, que tal praticar com alguns exercícios de fixação sobre hidrocarbonetos? Verifique o quanto você lembra sobre esses compostos, tentando resolver os exercícios abaixo.
Exercício 1
A química orgânica estuda os compostos de carbono e, assim sendo, é importante saber as características básicas deste elemento. Uma das condições mais interessantes é que o carbono é tetravalente, o que significar dizer que:
- Pode formar cadeias com total de quatro outros átomos de carbono
- É capaz de formar ligações quádruplas estáveis
- É capaz de formar quatro ligações covalentes
- Possui um total de oito elétrons em sua camada de valência
Resposta
Letra c.
Exercício 2
Os hidrocarbonetos aromáticos são assim classificados de acordo com alguns critérios conhecidos como critérios de aromaticidade. Identifique entre as alternativas abaixo aquela que se relaciona de modo correto esses critérios.
- Qualquer composto cíclico que possui insaturações é chamado de aromático
- Compostos cíclicos planares que possuem elétrons pi (π) em número par e que seguem a regra de Hückel (4n + 2) π
- Compostos cíclicos que seguem a regra (4n + 2) π, onde n = 0, 1, 2, …
- Apenas o benzeno é classificado como hidrocarboneto cíclico aromático
Resposta
Letra b.
Represente as cadeias abaixo cadeias abaixo.
- 2-metil pentano
- 2,2,4-trimetil pentano
- 2,2,5-trimetil hexano
- 4-etil-2,2,3-trimetildecano
- 4-metil pent-1-eno
- 3-metil pent-1-eno
- 3-etil-3-propil heptano
- 2,6-dimetil-5-propil-octano
- 4-terc-butil-4-etil-2,2,3-trimetiloctano
- 4-etil-5-metil hex-2-eno
- 3-isopropil-4,6-dimetil oct-1-eno
- 4-etil-7-metil-5-propil-nonano
- 2, 3-dietil-2, 3-dimetil-hex-4-eno
- 4,4,6-trimetil oct-2-ino
- 2,2,5-trimetil-3-heptino
- 6-etil-2,2,7-trimetl oct-4-eno
- 5-secbutil-2,2,4,6-tetrametil octano
- 2-benzil-3-hexino
- 2-fenil-3-hexino
- 4,5-dimetil oct-2-ino
- 2-metil hex-3-eno
- 2,2,3-trimetil pentano
- 4-fenil but-1-eno
- 4-fenil-3-metil pent-1-eno
- 4-benzil-5-etil hept-2-ino