Simulado – Cinética química
-
Pergunta 1 de 10
(IFBA/2017)
Os gases butano e propano são os principais componentes do gás de cozinha (GLP – Gás Liquefeito de Petróleo). A combustão do butano (C4H10) correspondente à equação:
C4H10 + O2 → CO2 + H2O + Energia
Se a velocidade da reação for 0,1 mols butano-minuto qual a massa de CO2 produzida em 1 hora?
(UNIRG TO/2017)
A amônia (NH3) é bastante utilizada na fabricação de fertilizantes e pode ser obtida a partir de hidrogênio (H2) e nitrogênio (N2). Considerando que a lei de velocidade para essa reação é V = k [H2]3[N2].
Ao triplicar a concentração de nitrogênio e, ao mesmo tempo, mantendo-se a temperatura constante, ao duplicar a concentração de hidrogênio, é correto afirmar que a velocidade final da reação:
(UEA AM/2017)
Mergulhadores recreacionais respiram ar comprimido (78% de nitrogênio, 21% de oxigênio, 1% de outros gases), contido em um cilindro carregado nas costas. O cilindro comum é feito de alumínio e armazena ar a 3 mil libras por polegada quadrada (psi).

Moléculas de N2 (g) e O2 (g) estão em constante colisão no interior do cilindro. Entretanto, praticamente não ocorre a reação química N2 (g) + O2 (g) → 2NO (g), o que tornaria o ar irrespirável para os mergulhadores. Assinale a alternativa que apresenta uma explicação correta para este fato.
(Mackenzie SP/2018)
O processo equacionado por NO(g) + O3(g) → NO2(g) + O2(g) é classificado, em termos cinéticos, como elementar e de segunda ordem. Desse modo, ao serem feitos dois experimentos, ambos sob determinada temperatura “T”, ao duplicar-se tanto a concentração do NO(g) como do O3(g) em relação ao primeiro experimento, o segundo experimento terá sua velocidade
(ACAFE SC/2016)
Baseado nos conceitos sobre cinética das reações químicas, analise as afirmações a seguir.
I. Catálise heterogênea pode ser caracterizada quando existe uma superfície de contato visível entre os reagentes e o catalisador.
II. A energia de ativação (Ea) varia com a concentração dos reagentes.
III. A constante de velocidade (k) pode variar com a temperatura.
IV. A energia de ativação (Ea) varia com a temperatura do sistema.
Todas as afirmações corretas estão em:
(Fac. Israelita de C. da Saúde Albert Einstein SP/2018)
Para que uma reação química aconteça, as moléculas dos reagentes devem colidir com geometria favorável e devem possuir energia suficiente. Se essas duas condições forem atingidas ocorrerá a formação do complexo ativado, o qual corresponde a um estado de transição. Existem vários fatores que influenciam na rapidez das reações, por exemplo, a superfície de contato e a temperatura.
O gráfico mostra a variação da energia cinética das moléculas em baixa e alta temperatura. Sobre a influência do aumento da temperatura para a formação do complexo ativado e na rapidez das reações químicas foram feitas as afirmações abaixo
I. Com o aumento da temperatura, um maior número de moléculas irá possuir energia suficiente para atingir o estado de ativação.
II. O aumento da temperatura aumenta o número de colisões entre as moléculas dos reagentes e, consequentemente, aumentam os choques não eficazes e os eficazes.
III. Para que ocorra a formação do complexo ativado, as moléculas dos reagentes devem possuir uma quantidade de energia no mínimo igual à energia de ativação e, portanto, o aumento de temperatura favorece a formação do complexo ativado.
IV. A formação do complexo ativado ocorre apenas em reações endotérmicas.
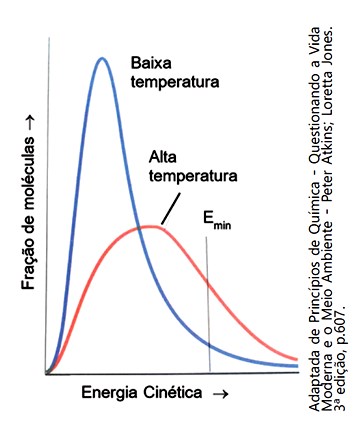 As afirmativas corretas são:
As afirmativas corretas são:
(PUC Camp SP/2017)
Para mostrar a diferença da rapidez da reação entre ferro e ácido clorídrico, foi utilizado o ferro em limalha e em barra. Pingando dez gotas de ácido clorídrico 1,0 mol . L–1 em cada material de ferro, espera-se que a reação seja
(UFRGS RS/2017)
Uma reação genérica em fase aquosa apresenta a cinética descrita abaixo.
3A + B → 2C v = k[A]2[B]
A velocidade dessa reação foi determinada em dependência das concentrações dos reagentes, conforme os dados relacionados a seguir.
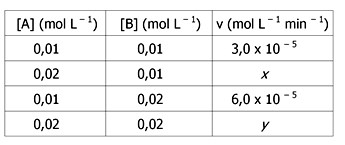
Assinale, respectivamente, os valores de x e y que completam a tabela de modo adequado.
(Mackenzie SP/2017)
O estudo cinético de um processo químico foi realizado por meio de um experimento de laboratório, no qual foi analisada a velocidade desse determinado processo em função das concentrações dos reagentes A e B2. Os resultados obtidos nesse estudo encontram-se tabelados abaixo.

Com base nos resultados obtidos, foram feitas as seguintes afirmativas:
I. As ordens de reação para os reagentes A e B2, respectivamente, são 2 e 1.
II. A equação cinética da velocidade para o processo pode ser representada pela equação v = k[A]2[B2].
III. A constante cinética da velocidade k tem valor igual a 200.
Considerando-se que todos os experimentos realizados tenham sido feitos sob mesma condição de temperatura, é correto que
(UEMG/2017)
Uma reação química hipotética é representada pela seguinte equação:
A(g) + B(g) → C(g) + D(g) e ocorre em duas etapas:
A(g) → E(g) + D(g) (Etapa lenta)
E(g) + B(g) → C(g) (Etapa rápida)
A lei da velocidade da reação pode ser dada por
Gabarito das questões
- Questão – A
- Questão – B
- Questão – A
- Questão – D
- Questão – A
- Questão – C
- Questão – D
- Questão – A
- Questão – E
- Questão – C


