Cálculo Estequiométrico Simulado Enem de Química
Os cálculos estequiométricos correspondem aos cálculos de massa, de quantidade, de matéria e, em alguns casos, de volume das substâncias envolvidas em uma reação química, que são feitos com base na proporção entre os coeficientes estequiométricos da reação (proporção estequiométrica). Confira o resumo e faça as questões do Simulado.
Para você fazer o cálculo estequiométrico de uma reação é necessário conhecer a proporção entre os coeficientes estequiométricos de reação, e isso é possível através do balanceamento das equações químicas.
BALANCEAMENTO QUÍMICO DAS EQUAÇÕES QUÍMICAS
Exercício para você entender Cálculo Estequiométrico. Suponha a seguinte reação:
Ca (OH)2(aq) + Al2(SO4)(aq) →Al(OH)3(s) + CaSO4(s)
O processo de balanceamento pode ser feito de muitas maneiras, sendo o método das tentativas o mais utilizado. Esse método consiste em:
- Iniciar o balanceamento pela espécie que aparece apenas uma vez em cada um dos lados da equação;
- Dar preferência ao elemento que possui maior índice;
No caso da reação dada existem duas espécies que aparecem apenas uma vez em cada lado da equação, o Alumínio (Al) e o Cálcio (Ca), portanto, vamos dar preferência ao elemento que possui maior índice que é o alumínio.
Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + CaSO4(s)
- Primeiramente começamos igualando a quantidade de alumínio do lado direito com a mesma quantidade do lado esquerdo. Portanto, devemos colocar o número 2, no alumínio do lado direito, já que temos dois átomos de alumínio do lado esquerdo da equação;
- Em seguida contamos o número de cálcio e igualamos nos dois lados da equação, inicialmente colocamos o número 1, pois a principio conseguimos igualar o número de cálcio dos dois lados;
1Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + CaSO4(s)
Agora contamos o número dos hidrogênios, que são 2 hidrogênios do lado direito e 6 hidrogênios do lado esquerdo da equação, então é preciso igualar os hidrogênio do lado esquerdo colocando o número 3 na frente da espécie : Ca(OH)2(aq) para que possamos ter o mesmo número de hidrogênios do outro lado da equação. Assim:
3Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + CaSO4(s)
Ops! Agora o número de átomos de cálcio não é o mesmo nos dois lados da equação. Então é preciso balancear o átomo de cálcio, colocando o número 2 na frente da espécie: CaSO4(s)
2Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + 3CaSO4(s)
OBS: Por isso o método é chamado de tentativa, pois se deve ir ajustando os coeficientes estequiométricos até conseguir o balanceamento total da equação.
- Por último é só verificar o número de oxigênios dos dois lados da equação, se o número estiver correto, o balanceamento da equação está pronto! Que é o caso desse exemplo dado.
Então a equação final balanceada é:
2Ca(OH)2(aq) + Al2(SO4)(aq) → 2Al(OH)3(s) + 3CaSO4(s)
CÁLCULO ESTEQUIOMÉTRICO
A quantidade de uma substância, em mol, também pode ser expressa em outras grandezas e, portanto, em outras unidades como:
1 mol = 6,0×1023 moléculas = No estado gasoso 25L (volume molar, a 1 atm a 25oC).
Não esqueça! Sempre serão esses valores para mol e volume, porém a massa em gramas dependerá da fórmula de cada substância. Por exemplo: 1 mol de O2: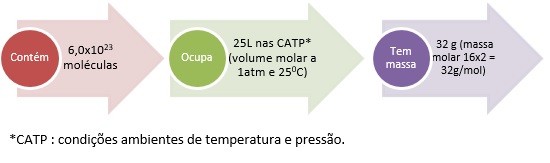
Cálculo Estequiométrico
A partir de um minério denominado galena, rico em sulfeto de chumbo II (PbS), pode-se obter o metal chumbo em escala industrial, por meio das reações representadas pelas equações de oxirredução a seguir, cujos coeficientes estequiométricos encontram-se já ajustados:
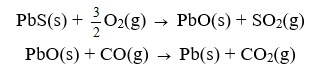
Considerando-se uma amostra de 717 kg desse minério que possua 90 % de sulfeto de chumbo II, sendo submetida a um processo que apresente 80 % de rendimento global, a massa a ser obtida de chumbo será de, aproximadamente,
Dados: massas molares (g·mol–1) S = 32 e Pb = 207
conforme a estequiometria da reação temos que cada 1mol de PbS(s) ao reagir com cada 3/2 mol de O2(g) forma também 1mol de PbO; e o PbO formado, por sua vez, ao reagir com CO(g) origina 1mol de Pb(s).
Em 717kg de minério apenas 90% equivale ao PbS, portanto a massa de sulfeto de chumbo II é 90%*717kg= 645,3kg.
Dos 645,3kg submetidos à reação com O2, somente 80% efetivamente reagiu. Portanto a massa que reagiu é de 80%*645,3kg = 516,24kg.
Sabendo que a massa molar do PbS é 207g/mol + 32g/mol = 239g/mol. Calculamos o número de mol equivalente a essa massa:
n = m/MM
n = 516,24kg/0,239kgmol-¹
n = 2160mols de PbS reagiram.
Como a proporção estequiométrica entre produtos e reagente é 1:1, logo 2160 é também o número de mol formado de Pb(s). Sabendo que a massa molar do Pb é 207g/mol, a massa de Pb(s) formada é:
n = m/MM
n*MM = m
2160*0,207kg.mol-¹ = m
447,12 kg = m
Resposta: C.
Leia mais em Brainly.com.br – https://brainly.com.br/tarefa/17381771#readmore
2. (UNITAU SP/2018) No Brasil, em 2016, foram consumidos, aproximadamente, 369 cigarros per capita, segundo informações publicadas pelo Instituto Nacional do Câncer (INCA). Assumindo que uma árvore adulta consiga absorver 140 kg de CO2 por ano, e que cada cigarro contenha 0,35 g do elemento químico carbono, quantas árvores seriam necessárias, aproximadamente, para absorver todo o CO2 gerado pela queima de todos os cigarros consumidos no Brasil em 2016? Assuma que, na combustão do carbono presente no cigarro, a conversão em CO2 seja igual a 100%.
(Dados: população brasileira igual a 207 milhões de habitantes)
sabendo-se que:
⇒ por dia são consumidos 369 cigarros por pessoa;
⇒ cada cigarro tem 0,35g de C.
1 cigarro tem o seguinte número de mol de carbono:
Massa molar do Carbono = 12g/mol
n = m/MM
n = 0,35g/12gmol-1 = 0,029mol de C em cada unidade de cigarro.
todo o C presente no cigarro é convertido a CO2
C + O2 –> CO2
Em todo o ano de 2016, o número de mol de C, referente aos 369 cigarros fumados por uma só pessoa é:
0,0292mol x 369 cigarros = 10,77 mol de C por pessoa, por ano.
considerando toda a população:
10,77mol x = mols de C, por ano.
Que é também o número de mol de CO2 produzido no ano, referente à queima dos cigarros.
A massa molar do CO2 é de 0,044kg/mol.
E a massa de CO2 produzido, em kg, é:
n = m/MM
n*MM = m
mol * 0,044kgmol-1 = m
98.120.000 kg de CO2 gerados.
1 árvore adulta absorve 140kg de CO2 ao ano, então para absorver todo o CO2 emitido serão necessárias:
1 árvore —- 140kg CO2
x árvores—- 98.120.000kg
x = 700857 árvores.
Leia mais em Brainly.com.br – https://brainly.com.br/tarefa/16335525#readmore
3. (Fac. Direito de São Bernardo do Campo SP/2018) Observe a reação, não balanceada, que representa uma das maneiras de produção do gás cloro.
MnO2(s) + HCl(aq) → MnCl2(aq) + H2O(l) + Cl2(g)
Para produção de 3 mols de Cl2 quantos gramas de HCl são necessários?
4. (UERJ/2018) A capacidade poluidora de um hidrocarboneto usado como combustível é determinada pela razão entre a energia liberada e a quantidade de CO2 formada em sua combustão completa. Quanto maior a razão, menor a capacidade poluidora. A tabela abaixo apresenta a entalpia-padrão de combustão de quatro hidrocarbonetos.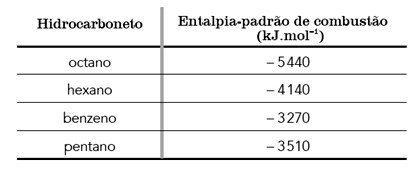
A partir da tabela, o hidrocarboneto com a menor capacidade poluidora é:
5. (Fac. Israelita de C. da Saúde Albert Einstein SP/2018) A pirita (FeS2) é encontrada na natureza agregada a pequenas quantidades de níquel, cobalto, ouro e cobre. Os cristais de pirita são semelhantes ao ouro e, por isso, são chamados de ouro dos tolos. Esse minério é utilizado industrialmente para a produção de ácido sulfúrico. Essa produção ocorre em várias etapas, sendo que a primeira é a formação do dióxido de enxofre, segundo a equação a seguir.
4 FeS2(s) + 11 O2(g) → 2 Fe2O3(s) + 8 SO2(g)
Na segunda etapa, o dióxido de enxofre reage com oxigênio para formar trióxido de enxofre e, por fim, o trióxido de enxofre reage com água, dando origem ao ácido sulfúrico.
Sabendo que o minério de pirita apresenta 92% de pureza, calcule a massa aproximada de dióxido de enxofre produzida a partir de 200 g de pirita.
6. (UERJ/2018) A hemoglobina é uma proteína de elevada massa molar, responsável pelo transporte de oxigênio na corrente sanguínea. Esse transporte pode ser representado pela equação química abaixo, em que HB corresponde à hemoglobina.
HB + 4 O2 →HB(O2)4
Em um experimento, constatou-se que 1 g de hemoglobina é capaz de transportar 2,24 x 10–4 L de oxigênio molecular com comportamento ideal, nas CNTP.
A massa molar, em g/mol, da hemoglobina utilizada no experimento é igual a:
7. (ENEM/2014)
Grandes fontes de emissão do gás dióxido de enxofre são as indústrias de extração de cobre e níquel, em decorrência da oxidação dos minérios sulfurados. Para evitar a liberação desses óxidos na atmosfera e a consequente formação da chuva ácida, o gás pode ser lavado, em um processo conhecido como dessulfurização, conforme mostrado na equação (1).
CaCO3 (s) + SO2 (g) → CaSO3 (s) + CO2 (g) (1)
Por sua vez, o sulfito de cálcio formado pode ser oxidado, com o auxílio do ar atmosférico, para a obtenção do sulfato de cálcio, como mostrado na equação (2). Essa etapa é de grande interesse porque o produto da reação, popularmente conhecido como gesso, é utilizado para fins agrícolas.
2 CaSO3 (s) + O2 (g) → 2 CaSO4 (s) (2)
As massas molares dos elementos carbono, oxigênio, enxofre e cálcio são iguais a 12 g/mol, 16 g/mol, 32 g/mol e 40 g/mol, respectivamente.
BAIRD, C. Química ambiental. Porto Alegre: Bookman, 2002 (adaptado).
Considerando um rendimento de 90% no processo, a massa de gesso obtida, em gramas, por mol de gás retido é mais próxima de
8. (UNIFOR CE/2015) Uma importante premissa para se realizar cálculos estequiométricos a partir de reações químicas é a necessidade da reação apresentar-se devidamente balanceada. Considere a reação de oxidação-redução com balanceamento parcial mostrada a seguir
aKNO2 + bKMnO4 + 3H2SO4 → c KNO3 + dK2SO4 + eMnSO4 +3H2O
A soma de todos os menores coeficientes inteiros resultante do balanceamento da reação apresentada acima (a + b + 3 + c + d + e + 3) é:
9. (UNESP SP/2018) Bicarbonato de sódio sólido aquecido se decompõe, produzindo carbonato de sódio sólido, além de água e dióxido de carbono gasosos. O gráfico mostra os resultados de um experimento em que foram determinadas as massas de carbonato de sódio obtidas pela decomposição de diferentes massas de bicarbonato de sódio.
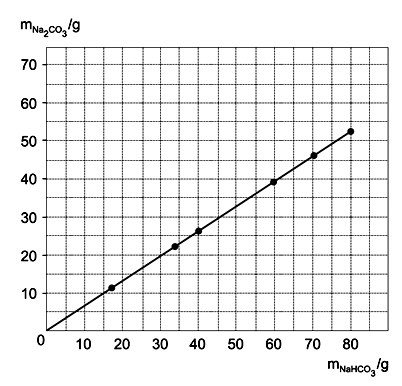
Os dados do gráfico permitem concluir que as massas de carbonato de sódio e bicarbonato de sódio nessa reação estão relacionadas pela equação: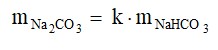 e que o valor aproximado de k é:
e que o valor aproximado de k é:
(Adaptado de Gervásio Paulus, André Muller e Luiz Barcellos, Agroecologia aplicada: práticas e métodos para uma agricultura de base ecológica. Porto Alegre: EMATER-RS, 2000, p. 86.)
Dados de massas molares em g.mol–1: sulfato de cobre (II) pentaidratado = 250; hidróxido de cálcio = 74.
Na preparação da calda bordalesa são usados 100 g de sulfato de cobre(II) pentaidratado e 100 g de hidróxido de cálcio (cal extinta). Para uma reação estequiométrica entre os íons cobre e hidroxila, há um excesso de aproximadamente


