Aula 9
COMO RECONHECER QUE HOUVE UMA TRANSFORMAÇÃO QUÍMICA QUANDO NÃO HÁ EVIDÊNCIAS.
Competências e habilidades: reconhecer a ocorrência de transformações químicas no dia a dia e no sistema produtivo (produção da cal); empregar corretamente a linguagem científica na descrição de transformações químicas.
Sugestão de estratégias de ensino: levantamento das ideias dos alunos; aula expositiva dialógica; experimento; problemas, questões abertas e questões de classificação.
Sugestão de recursos: giz, lousa e materiais e reagentes para a realização do experimento.
Sugestão de avaliação: respostas a questões e problemas e participação na discussão do experimento.
Conteúdos e temas: propriedades das substâncias – temperaturas de ebulição e fusão, densidade, solubilidade; importância das propriedades para caracterizar substâncias.·
Competências e habilidades: empregar a linguagem química para representar transformações químicas; construir e interpretar tabelas e gráficos com dados de propriedades das substâncias.·
Estratégias de ensino: levantamento das ideias dos alunos; leitura e discussão do texto e das questões para a interpretação do texto; atividade experimental; uso de objetos de aprendizagem (simulação).·
Recursos: material para experimentos e textos. Sugestão de avaliação: atividades e questões propostas.
Interações e transformações químicas
Nem toda transformação química é acompanhada de evidências e nem toda evidência indica a ocorrência de uma transformação química.
O ser humano transforma os materiais da natureza para suprir suas necessidades. As interações entre materiais e entre materiais e energia podem gerar transformações químicas. Os materiais de partida (reagentes) dão origem aos novos materiais (produtos) nas transformações químicas.
Uma forma eficiente de se obter informações sobre a formação de novo material é investigando as suas propriedades, que naturalmente devem ser diferentes das propriedades das substâncias iniciais. São propriedades características importantes: a densidade, as temperaturas de fusão e ebulição e a solubilidade.
Considere como exemplo a queima do magnésio. Comparando-se as propriedades das substâncias que compõem o sistema no estado inicial com as propriedades das substâncias no estado final, pode-se concluir que de fato a queimado magnésio é uma transformação química, pois o óxido de magnésio apresenta propriedades diferentes do magnésio e do oxigênio.
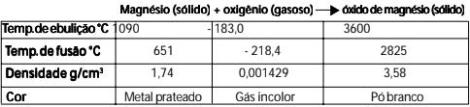
Propriedades das substâncias.
As substâncias podem ser identificadas por suas propriedades características. A cor e o cheiro, por exemplo, podem identificar uma dada substância, porém, tais propriedades não são suficientes para identificá-la ou distingui-la de uma outra.
As propriedades, como a temperatura de fusão, a temperatura de ebulição, a densidade e a solubilidade, são propriedades que servem como meios de identificação das substâncias, pois dependem apenas da natureza delas e independem de sua quantidade ou sua procedência.
É importante que na atividade sejam destacadas as seguintes ideias:
- o ser humano transforma os materiais da natureza para suprir suas necessidades; as interações entre materiais e entre materiais e energia podem gerar transformações químicas;
- os materiais de partida (reagentes) dão origem aos novos materiais (produtos) nas transformações químicas
a calcinação do calcário e a hidratação da cal são exemplos de transformações químicas. - Atente-se para que os alunos possam construir o conceito de transformação química, conceito-chave no ensino de Química. Muitas pesquisas realizadas nas últimas três décadas têm mostrado que os alunos costumam apresentar dificuldades na construção desse conceito, embora seja quase consensual entre os
professores que o ensino desse conteúdo/conceito não é problemático. - Pesquisas indicam que alunos que passaram pelo ensino formal e foram aprovados nas avaliações realizadas podem considerar correto que: mudanças de estado físico ou de aparência das substâncias como sendo transformações químicas; a simples mistura de substâncias como sendo transformação química; fenômenos que ocorrem em organismos vivos, por exemplo, digestão e fotossíntese, como não sendo transformações químicas, pois, segundo eles, “são processos que ocorrem naturalmente”;
- Sempre será necessária mais de uma substância para que ocorra uma transformação química; um dos reagentes é mais importante que os outros;
- fenômenos que ocorrem espontaneamente ou sem a intervenção humana, como o enferrujamento, não são transformações químicas.
Essas ideias são concepções equivocadas ao conceito de transformação química e podem constituir entraves à aprendizagem de outros conteúdos desenvolvidos na Química.
Daí a importância de se estar atento às intervenções dos alunos e ter um olhar mais cuidadoso sobre seus “erros”, que podem revelar concepções sólidas e compartilhadas sobre o conceito de transformação química. Considerando essas concepções, você vai poder auxiliá-los melhor na reconstrução de suas ideias
– o que facilita a aprendizagem em Química na direção desejada.
– Transformações químicas
1. Complete a primeira coluna da tabela a seguir com mais três materiais que são muito utilizados pelo ser humano e que podem ser extraídos diretamente da natureza. A segunda coluna deve ser preenchida com mais três materiais igualmente importantes, mas que só podem ser obtidos mediante processos de transformação de matérias-primas.
Materiais obtidos diretamente da natureza Materiais obtidos por transformações de matérias-primas
Ouro Cal Madeira Plásticos
Mármore Ferro
Oxigênio Alumínio Areia Cimento
Água Álcool
Desde o princípio, o ser humano tem buscado modificar o ambiente que o cerca, seja por necessidade de proteção e segurança, para obtenção de alimentos ou por fatores estéticos. Independentemente dos motivos, desde cedo aprendeu a transformar a matéria disponível, de modo que ela passasse a suprir seus anseios e necessidades, das mais básicas às mais supérfluas.
Quase sempre essa modificação da matéria envolve a formação de substâncias diferentes daquelas que já existiam. Outras vezes busca-se, ao contrário, impedir a ocorrência de transformações na matéria.
As transformações da matéria, na maioria das vezes, envolvem a interação entre diferentes materiais ou entre materiais e alguma forma de energia. Assim, vale a pena considerar a importância do domínio da produção e manutenção do fogo pelo ser humano desde os tempos mais remotos, nas mais diversas áreas da vida: alimentação, segurança, conforto etc.
Nem toda interação entre a energia e a matéria promove a formação de novas substâncias. Pode ser que o estado físico do material sofra alterações sem que isso implique a formação de outro material. É o que ocorre, por exemplo, quando um artesão derrete parafina para a confecção de velas decorativas. A barra de parafina é aquecida em um
recipiente até passar do estado sólido para o líquido a fim de ser moldada na produção da vela. No decurso da confecção da vela, a parafina líquida volta a ser sólida. A partir dessa situação, você pode propor aos alunos
o seguinte questionamento:
A parafina nesse processo sofreu alguma mudança em sua composição ou apenas em seu estado físico e sua
aparência? Esse exemplo é diferente do que ocorre quando a vela é queimada. Nesse processo, a parafina e o oxigênio do ar são transformados em gás carbônico, vapor d’água e fuligem, e esse processo é acompanhado pela
liberação de energia térmica e luminosa. Assim, no caso do derretimento da parafina, a interação não gera uma transformação na composição química da parafina.
Isso é bem diferente do que ocorre no caso da queima, na qual a interação gera uma transformação na composição química dos materiais de partida. As interações que geram transformações na composição química dos materiais de partida são chamadas transformações químicas.
Os materiais de partida, necessários para essa transformação, são chamados reagentes, e aqueles que são formados no fim do processo são chamados produtos da transformação química. Em outras palavras, pode-se dizer que nas transformações químicas ocorre a formação de novas substâncias, diferentes dos reagentes em sua composição e suas propriedades.
É importante lembrar que os alunos ainda não têm em mente um modelo corpuscular da matéria (modelos atômicos de Dalton, Thomson etc.). Por isso, a definição de transformação química a ser adotada neste momento não pode considerar as ideias de rearranjo de átomos ou de quebra e formação de ligações químicas, assuntos que serão abordados apenas nos próximos volumes.
Portanto a definição que será empregada neste momento é a de que “uma transformação química é um processo no qual há a formação de novas substâncias”. O conceito de substância será definido com maior rigor nas próximas atividades. Neste momento basta compreender que substância é um material de composição fixa (diferente das
misturas que podem variar sua composição) e com propriedades e características que serão estudadas mais adiante. Embora substância e material tenham significados diferentes, é aceitável, enquanto os conceitos estão sendo construídos (e não apenas memorizados), tratá-los indistintamente.
Em outras palavras, uma transformação química pode também ser entendida como um processo em que se forma
um novo material.
O texto da Situação de Aprendizagem 1 mostra, de forma esquemática, que o calcário, quando aquecido
a temperaturas superiores a 900 ºC, se transforma em cal viva e gás carbônico. O calcário é uma rocha sedimentar formada basicamente por uma substância chamada carbonato de
cálcio, cuja fórmula química é CaCO3.
Já a calviva, formada na calcinação, é um material constituído especialmente de óxido de cálcio,
CaO. O gás carbônico que também foi formado é o dióxido de carbono, CO2 É interessante destacar o fato de que as
transformações sofridas pelo material de partida (reagente), nesse caso, foram muito mais que uma mudança de estado físico ou de aparência; houve mudança na composição química e a formação de duas novas substâncias. Por
isso, a calcinação pode ser considerada uma transformação química. Esse processo pode ser representado pela equação química a seguir.
CaCO3 (s) + energia = CaO(s) + CO2 (g)
(calcário sólido) = (cal viva sólida) + (gás carbônico)
(carbonato de cálcio) = (óxido de cálcio) (dióxido de carbono)
De forma semelhante, a hidratação da cal viva para a formação da cal extinta (hidróxido
CaO(s) + H2O(l) = Ca(OH)2(s) + energia
(cal viva sólida) + (água líquida) = (cal extinta sólida)
(óxido de cálcio) (água) (hidróxido de cálcio)


