SITUAÇÃO DE APRENDIZAGEM 1 FORÇAS DE INTERAÇÃO ENTRE PARTÍCULAS QUE COMPÕEM OS ESTADOS SÓLIDO, LÍQUIDO E GASOSO
Conteúdos e temas: interações entre íons, átomos e moléculas: volatilidade, temperaturas de fusão e de ebulição e forças de interação. Competências e habilidades: construir e interpretar o conceito de forças interpartículas, relacionando-as às propriedades das substâncias iônicas, moleculares e metálicas; aplicar os conhecimentos adquiridos em situações do cotidiano que envolvem diferentes tipos de interação. Sugestão de estratégias de ensino: trabalho em grupo; análise de tabelas; interpretação de gráficos; aulas expositivas dialogadas; pesquisas; atividade prática; elaboração de textos; seminários. Sugestão de recursos: material para atividade prática; atividades propostas. Sugestão de avaliação: questões propostas; elaboração de texto; busca em fontes de informação; apresentação de seminários; atividade-síntese.
Será que as moléculas, quando próximas exercem algum tipo de força?
A resposta é sim, átomos e moléculas por possuírem um campo magnético, exercem uma força sobre as outras.
Então agora vamos entender exatamente que tipo de força é essa.
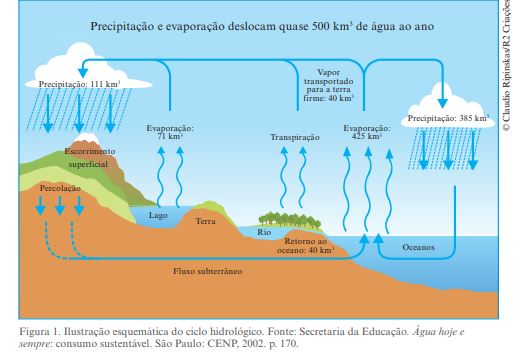
E nosso planeta, a água encontra-se nos estados sólido, líquido e gasoso. A água doce disponível (no máximo 0,3% de toda a água do planeta) já teria sido totalmente consumida se não fosse o ciclo hidrológico, que envolve, sob a ação da energia solar, o movimento contínuo das águas, distribuindo-as em diferentes regiões do planeta: estado sólido nas geleiras e calotas polares; no estado líquido nos oceanos, mares, rios, lençóis freáticos etc.; estado gasoso (vapor-d´ água) na atmosfera. Esse movimento se dá por meio de transformações, algumas envolvendo mudanças de fase- como evaporação, a transpiração e a condensação- que culminam com a precipitação da água, na forma de chuva, e sua infiltração nas camadas subterrâneas do solo. Esses processos estão representados a seguir:
Força intermolecular quando duas moléculas se aproximam há uma interação de seus campos magnéticos o que faz surgir uma força entre elas. É o que chamamos de força intermolecular.Essas forças variam de intensidade, dependendo do tipo da molécula (polar ou apolar).
Polaridade, essa propriedade depende da eletronegatividade dos átomos envolvidos na ligação, ou seja, da capacidade que o átomo tem de atrair para si o par de elétrons que ele compartilha com outro átomo em uma ligação covalente.
Tabela de eletronegatividade
Lembrando que o menor valor é o mais eletropositivo
| Elementos | Eletronegatividade |
| F | 3,98 |
| O | 3,44 |
| Cl | 3,16 |
| N | 3,04 |
| Br | 2,96 |
| I | 2,66 |
| S | 2,58 |
| C | 2,55 |
| Metais Nobres | 2,54 a 2,28 |
| H | 2,20 |
| P | 2,19 |
| Semi-metais | 2,04 a 1,18 |
| Metais Comuns | 2,20 a 0,79 |
| Fr | 0,70 |
Eletronegatividade: É a tendência que um átomo tem de atrair elétrons. É muito característico dos não-metais. Linus Pauling, através de experimentos, tentou quantificar esta tendência e criou uma escala de eletronegatividade. Na tabela periódica, os gases nobres não são considerados, já que não tem tendência a ganhar ou perder elétrons. Já estão estabilizados.
Eletropositividade: É a tendência que um átomo tem de perder elétrons. É muito característico dos metais. Pode ser também chamado de caráter metálico. É o inverso da eletronegatividade. Os gases nobres também não são considerados, por conta da sua estabilidade.
No caso das moléculas orgânicas, todas as ligações entre seus átomos são covalentes, por isso, precisamos analisar a diferença de eletronegatividade entre os átomos das ligações para determinar se as moléculas são polares ou apolares.
Quando a molécula for diatômicas, formadas por átomos iguais, elas exerceram a mesma força não havendo formação de polos, anulando seus vetores, neste caso será uma molécula apolar.
Em uma situção que os átomo são diferentes, o átomo mais eletronegativa exercerá uma força, onde o outro átomo será eletropositivo, ou seja cargas parciais diferentes. Então teremos uma molécula polar.
Exemplo:
Atividade 2 – Forças de interação entre íons: explicando propriedades de sólidos iônicos Nesta atividade, em um primeiro momento, podem-se organizar os alunos em grupos e sugerir a eles que retomem as informações sobre propriedades de algumas substâncias estudadas no volume anterior – NaCl, NaBr, MgCl2 , BaCl2 , Na2 O, CaO, BaO, MgO, C4 H10 (butano) e C8 H18 (octano) –, tais como estado físico, temperaturas de fusão e de ebulição, condutibilidade elétrica, solubilidade em água e outras. 1. Veja a lista de substâncias a seguir: cloreto de sódio (NaCl), brometo de sódio (NaBr), cloreto de magnésio (MgCl2 ), cloreto de bário (BaCl2 ), óxido de sódio (Na2 O), óxi12 do de cálcio (CaO), óxido de bário (BaO), óxido de magnésio (MgO), butano (C4 H10) e octano (C8 H18). Busque, de acordo com a orientação do professor, informações sobre propriedades dessas substâncias, completando os espaços da tabela seguinte
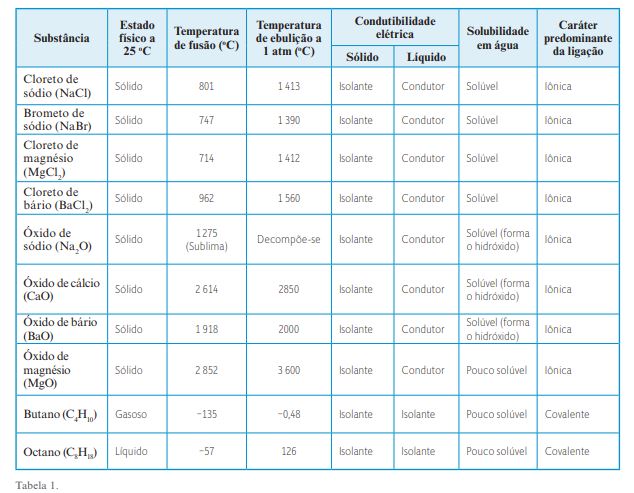
2. Analise as propriedades das substâncias e identifique o tipo de ligação que pode estar ocorrendo entre as partículas que as constituem.
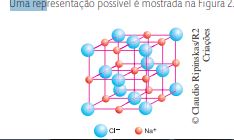
Analisando essas propriedades, pode-se observar que tais substâncias, com exceção do butano e do octano, são sólidas à temperatura ambiente, solúveis em água (com exceção do MgO, os óxidos reagem com água, formando hidróxidos), apresentam temperaturas de fusão e ebulição elevadas e não conduzem corrente elétrica no estado sólido, mas são condutoras quando líquidas. É importante que os alunos concluam, analisando essas propriedades, que essas substâncias devem ser constituídas por íons de cargas opostas, ou seja, são compostos iônicos. No caso do butano e do octano, as ligações estabelecidas entre os átomos são predominantemente covalentes.
3. Como você explicaria as temperaturas de fusão e de ebulição das substâncias, considerando as interações entre as partículas que as constituem?
As altas temperaturas de fusão e de ebulição das substâncias podem ser explicadas se considerarmos que são fortes as interações entre as partículas que as constituem, podendo-se admitir que são íons de cargas opostas. Butano e octano são compostos covalentes cujas partículas interagem de maneira fraca, o que pode explicar as baixas temperaturas de fusão e ebulição.
Como fazê-los perceber a formação da rede tridimensional do cloreto de sódio, no qual cada íon Cl– é rodeado por seis íons Na+ e cada íon de sódio é rodeado por seis íons de cloreto? A atividade a seguir, para a qual os alunos podem ser divididos em grupos, poderá ajudá-los a adquirir essa compreensão.
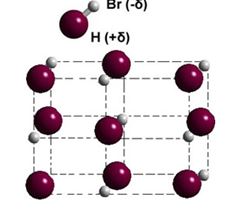
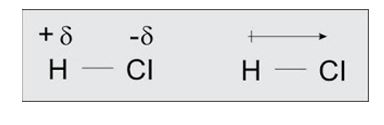
A imagem descreve que o átomo de Cloro é mais eletronegativo que o Hidrogênio.
Exemplo de apolar.
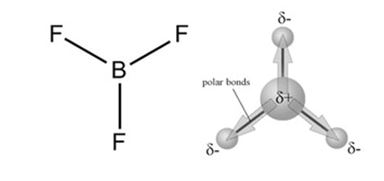
A molécula do BF3 apresenta 3 ligações polares, com os vetores direcionados para o flúor, que é o elemento mais eletronegativo. A geometria trigonal plana da molécula confere uma distribuição eletrônica simétrica ao redor do boro caracterizando a molécula como apolar, já que os três vetores se anulam.
A molécula do dióxido de carbono CO2 é linear, e as ligações entre os átomos de carbono e oxigênio são polares, porém os vetores que definem o momento dipolar se anulam e a molécula é apolar.
O← C → O
Existem três tipos de interações intermoleculares. Elas servem somente para as substâncias que possuem ligações covalentes. São elas:
– Pontes de Hidrogênio ou Ligações de Hidrogênio;
– Forças dipolo-dipolo, dipolo-permanente ou dipolar;
– Forças de London, Forças de Van der Waals ou dipolo-induzido.
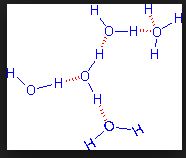
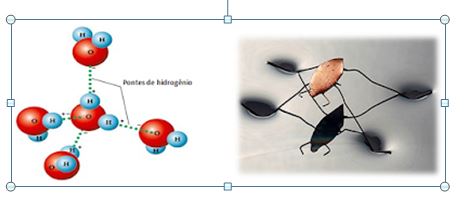
Pontes de Hidrogênio
Uma conseqüência das pontes de hidrogênio que existem na água é a sua elevada tensão superficial. As moléculas que estão no interior do líquido atraem e são atraídas por todas as moléculas vizinhas, de tal modo que as essas forças se equilibram. Já as moléculas da superfície só são atraídas pelas moléculas de baixo e dos lados.
Exemplo: A tensão superficial explica alguns fenômenos, como por exemplo, o fato de alguns insetos caminharem sobre a água e a forma esférica das gotas de água.
Esta interação intermolecular pode ser chamada também de Ligações de Hidrogênio. É realizada sempre entre o hidrogênio e um átomo mais eletronegativo, como flúor, oxigênio e nitrogênio.
Dipolo-Dipolo
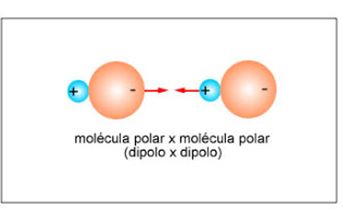
Esta interação intermolecular pode ser chamada também de dipolo-permanente ou dipolar.
Ocorre em polares. É menos intensa que as pontes de hidrogênio.
Quando a molécula é polar, há de um lado um átomo mais eletropositivo e do outro, um átomo mais eletronegativo.
Estabelece-se de modo que a extremidade negativa do dipolo de uma molécula se oriente na direção da extremidade positiva do dipolo de outra molécula.
Assim:
Exemplos:
HCl, HBr, HI
Forças de London
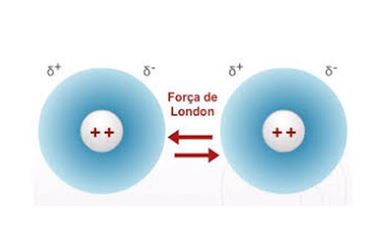
Esta interação intermolecular pode ser chamada também de dipolo-induzido ou Forças de Van der Waals.
É a interação mais fraca de todas e ocorre em moléculas apolares. Neste caso, não há atração elétrica entre estas moléculas. Deveriam permanecer sempre isolados e é o que realmente acontece porque, em temperatura ambiente, estão no estado gasoso.
São cerca de dez vezes mais fracas que as ligações dipolo-dipolo.
A molécula mesmo sendo apolar, possui muitos elétrons, que se movimentam rapidamente. Pode acontecer, em um dado momento, de uma molécula estar com mais elétrons de um lado do que do outro. Esta molécula estará, portanto, momentaneamente polarizada e por indução elétrica, ira provocar a polarização de uma molécula vizinha (dipolo induzido), resultando uma fraca atração entre ambas. Esta atração é a Força de London.
Exemplos: Cl2, CO2, H2
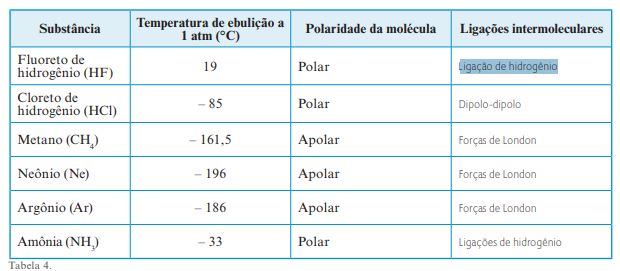
Quais são as possíveis ligações intermoleculares de cada uma das espécies químicas apresentadas na tabela a seguir?
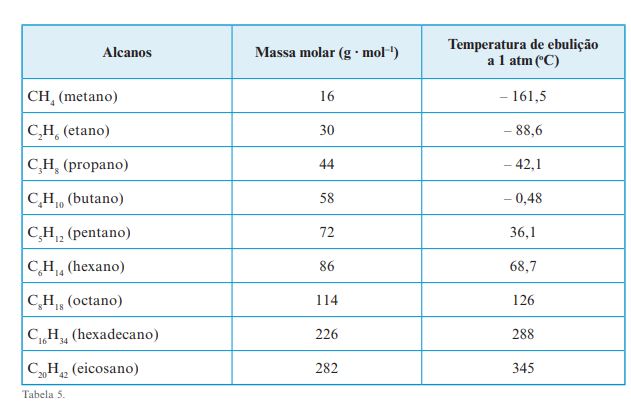
Para melhor aproveitamento do combustível, a formulação da gasolina automotiva utilizada em locais de clima mais quente difere daquela empregada em regiões mais frias. No primeiro caso, a gasolina contém uma mistura de hidrocarbonetos (substâncias formadas somente por átomos de hidrogênio e carbono) com menores quantidades de compostos de baixa massa molar, como butanos e pentanos. Isso ocorre porque, quando comparamos hidrocarbonetos de diferentes massas molares, verificamos que aqueles que possuem cadeias com maior número de carbonos apresentam temperaturas de ebulição maiores e, portanto, são menos voláteis (têm mais dificuldade de passar para o estado gasoso) e sofrem menor perda de material para o ambiente. Elaborado por Maria Fernanda Penteado Lamas especialmente para o São Paulo faz escola
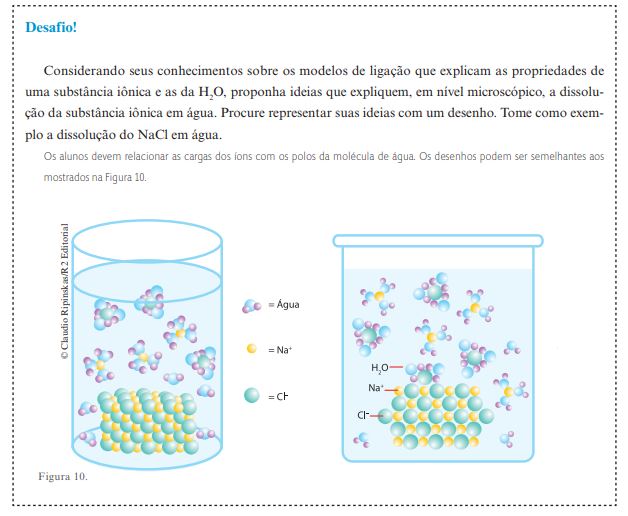
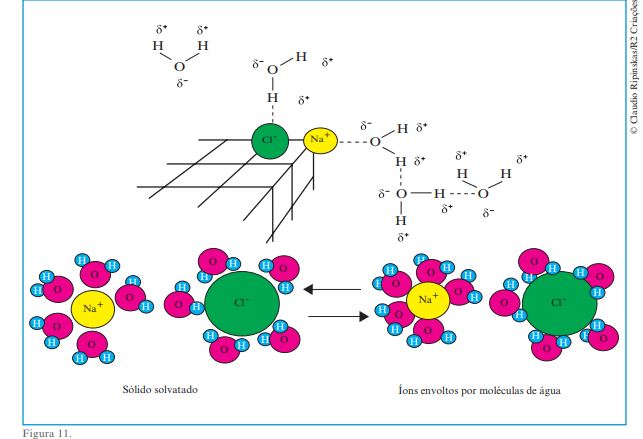
Segundo o modelo de atração eletrostática, as interações se dão entre os cátions e a parte negativa das moléculas de água (átomos Figura 10. © Claudio Ripinskas/R2 Editorial 26 Você pode lembrá-los, ainda, de que alguns sólidos formados por íons, como o AgCl e o BaSO4 , não se dissolvem em água. Para tentar explicar esse fato, eles poderiam argumentar que as atrações entre os íons Ba2+ e SO–2 4, no sulfato de bário, e Ag+ e Cl– , no cloreto de prata, devem superar as atrações entre esses íons e as partículas de H2 O. de oxigênio) e entre os ânions e a parte positiva dessas moléculas (átomos de hidrogênio). Depois, pode informá-los de que o resultado dessas interações é o NaCl solvatado, no qual os íons estão envoltos por moléculas de água (veja a figura a seguir). Dialogando com eles, você poderá levá-los a concluir que ocorrerá a dissolução do sólido iônico em água se as forças de atração que as moléculas de água exercem sobre os íons constituintes do sólido superarem as forças de atração entre as moléculas de água e entre os próprios íons.