Aula 6
Evolução do modelo atômico
Modelos atômicos foram sugeridos, desde a Antiguidade, por gregos como Demócrito de Abdera (420 a.C.) e Leucipo (450 a.C.), que já afirmavam que a matéria era composta por pequenas partículas que receberam a denominação de átomo, palavra que em grego significa indivisível. Esse modelo é um modelo filosófico sem forma definida e sem núcleo, e não tem nenhuma base científica.
Desde então passou por modelos propostos por Dalton(1803) e por Thomson (1898), até chegar ao modelo mais atual que foi criado por Rutherford, em 1911.
Segundo ele, o átomo consiste em um núcleo pequeno que compreende toda a carga positiva e praticamente a massa do átomo, e também de uma região extranuclear que é um espaço vazio onde só existem elétrons distribuídos.
Mais tarde, em 1914, Rutherford conceituou o núcleo atômico que é uma partícula que tem uma massa maior que a do elétron, mas se tratando da carga, o núcleo e o elétron possuem cargas iguais, mas de sinais opostos.
Os elétrons possuem carga negativa e o núcleo possui carga positiva. Rutherford, em 1920, afirmou que essa carga positiva deve-se à presença de prótons, nome proposto por ele.
Em 1913, o átomo passou por um aperfeiçoamento realizado pelo físico dinamarquês Niels Bohr, que dividiu a eletrosfera em sete camadas, chamadas atualmente de camadas de valência.
O Átomo Atual
O átomo atual é um intrincado de partículas e sub-partículas de cargas negativas e positivas em números iguais, ambas neutralizando a sua eletricidade. Igualmente aos modelos apresentados anteriormente, no seu núcleo estão os prótons formados pelas sub-partículas up e down e os nêutrons com suas duas sub-partículas up e down. Mais externamente encontram-se os elétrons.
Aula 6
Estrutura do Átomo
Cálculo das partículas atômicas
O cálculo das partículas atômicas é utilizado para determinar o número de prótons, nêutrons e elétrons de um átomo.
Representação de um átomo e suas partículas
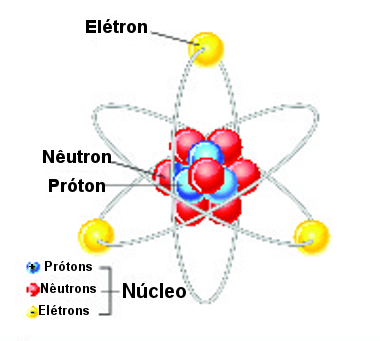
A estrutura de um átomo é composta basicamente por núcleo, níveis, subníveis, orbitais e partículas atômicas. As partículas atômicas são os prótons, nêutrons e elétrons. Os prótons e nêutrons estão localizados no interior do núcleo, e os elétrons, nos orbitais.
Para realizar o cálculo das partículas atômicas, é fundamental que conheçamos algumas características do átomo:
É representado pela letra Z, sempre maiúscula, e indica:
- A quantidade de prótons (p) no interior do núcleo;
- A quantidade de elétrons (e) no interior dos orbitais.
Assim, o número atômico é igual ao número de prótons e elétrons:
Z = p = e
O número atômico é posicionado sempre à esquerda, subscrito, na sigla do átomo do elemento químico, como na representação abaixo:
ZX
É representado pela letra A, sempre maiúscula, e indica a soma do número de prótons (p) com o número de nêutrons (n) presentes no núcleo do átomo:
A = p + n
O número de massa é posicionado sempre à esquerda ou à direita, sobrescrito, na sigla do átomo do elemento químico, como na representação abaixo:
AX ou XA
Agora veja alguns exemplos:
c) Exemplos de cálculo do número de partículas
1º Exemplo: Cálculo das partículas do átomo Sódio (11Na23)
- Número atômico (subscrito à esquerda): 11
Como o número atômico é 11, logo, temos no átomo de Sódio:
- 11 prótons
- 11 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (11) e o número de massa (sobrescrito à direita, 23). Para isso, utilize a fórmula abaixo:
A = p + n
23 = 11 + n
23 – 11 = n
N = 12
2º Exemplo: Cálculo das partículas do átomo Estanho (50Sn119)
- Número atômico (subscrito à esquerda): 50
Como o número atômico é 50, logo, temos no átomo de Estanho:
- 50 prótons
- 50 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (50) e o número de massa (sobrescrito à direita, 119). Para isso, utilize a fórmula abaixo:
A = p + n
119 = 50 + n
119 – 50 = n
N = 69
Exemplo 3: Cálculo das partículas do átomo de Urânio (92U238)
- Número atômico (subscrito à esquerda): 92
Como o número atômico é 92, logo, temos no átomo de Urânio:
- 92 prótons
- 92 elétrons
Para finalizar, basta determinar o número de nêutrons, já que conhecemos o número de prótons (92) e o número de massa (sobrescrito à direita, 238). Para isso, utilize a fórmula abaixo:
A = p + n
238 = 92 + n
238 – 92 = n
N = 146
Cada elemento químico é definido por meio de seu número atômico.
- O número atômico (Z) indica a quantidade de prótons (p) do átomo do elemento.
Por exemplo: Magnésio (Mg) Z=12 (Z=p)
2. O número de massa atômica (A) é a soma das massas unitárias dos prótons (p) com a dos nêutrons (n).
Por exemplo: Magnésio (Mg) A=24 (A=p+n)
Obs.: como os átomos são eletricamente neutros, o número de prótons é igual ao número de elétrons. Já nos íons a uma preponderância de um deles: se o número de prótons é maior que o de elétrons, o íon é positivo; caso contrário, é negativo.
p=número de prótons e=número de elétrons n=número de nêutrons
Existem características que reúnem átomos de um ou mais elementos, formando grupos. São eles:
Os prótons e nêutrons compõem o núcleo do átomo. Os elétrons, por sua vez, distribuem-se na eletrosfera em níveis e subníveis de energia. São 7 níveis, e cada um deles pode ter de 1 a 4 subníveis.
Aula 7
Tabela periódica
Organizar os elementos químicos em grupos com a finalidade de facilitar o estudo das substâncias derivadas destes tem sido tarefa árdua, busca esta realizada desde o século passado.
Inúmeras outras tabelas surgiram até que em 1872, Mendeleev publicou uma tabela que serviu de base para a atualmente em uso.
Além disso, Mendeleev foi capaz de prever a existência de elementos desconhecidos e prever as propriedades das substâncias simples deles derivados.
A grande mudança ocorrida nas tabelas deste século, comparada com as do século passado, foi a do referencial: em vez de ordenar os elementos pelos pesos atômicos, passou-se a usar os números atômicos.
Em 1988, a IUPAC, após consulta a várias Sociedades Científicas, divulgou o modelo que deverá ser adotado gradativamente no mundo inteiro. Tal modelo, numera os grupos de 1 a 18.
A Tabela Periódica organiza os elementos químicos até então conhecidos em uma ordem crescente de número atômico (Z – quantidade de prótons no núcleo do átomo).
Família ou grupo é o conjunto de elementos que ocupam a mesma coluna vertical da tabela periódica.
Assim, temos a família 1 ou família “1 A” , formada pelos elementos H, Li, Na, K, Rb, Cs e Fr. Elementos pertencentes a uma mesma família apresentam distribuição semelhante, isto é, se a distribuição de um terminar em “ s1”, todos os demais também terminarão em “1s1”
Período é o conjunto de elementos que ocupam a mesma coluna horizontal da tabela periódica e corresponde à quantidade de níveis de energia que possuem.
Desse modo, o primeiro período é formado apenas pelo H e He e possuem apenas um nível energético (1s). O segundo pelos elementos Li, Be, B, C, N, O, F e Ne e possuem 2 níveis energéticos (1s, 2s e/ou 2p).
Muitas propriedades químicas e físicas dos elementos e das substâncias simples que eles formam variam periodicamente, ou seja, em intervalos regulares em função do aumento (ou da diminuição) dos números atômicos. As propriedades que se comportam dessa forma são chamadas de propriedades periódicas.
As principais propriedades periódicas químicas dos elementos são: raio atômico, energia de ionização, eletronegatividade, eletropositividade e eletroafinidade.
As físicas são: pontos de fusão e ebulição, densidade e volume atômico.
Propriedades aperiódicas
Os valores somente crescem ou decrescem à medida que aumenta o número atômico.
Massa atômica: É a massa do átomo medida em unidades de massa atômica (u). Com o aumento do número atômico, a massa atômica sempre aumenta.
Calor específico: É a quantidade de calor necessária para elevar de 1°C a temperatura de 1g do elemento. Com o aumento do número atômico o calor específico do elemento no estado sólido sempre diminui.
Elementos representativos
São aqueles cuja distribuição eletrônica apresenta os elétrons mais energéticos na última camada, isto é, a distribuição termina no subnível “s” ou “p”.
São os elementos das famílias 1, 2, 13, 14, ,15, 16, 17 e 18.
Elementos da família 1, terminam em “s1”
Elementos da família 2, terminam em “s2”
Elementos da família 13 terminam em “p1”
Elementos da família 14 terminam em “p2”
Elementos da família 15 terminam em “p3”
Elementos da família 16 terminam em “p4”
Elementos da família 17 terminam em “p5”
Elementos da família 18 ou 0 terminam em “p6”
Elementos de transição
São aqueles cuja distribuição eletrônica apresenta o elétron mais energético na penúltima e na última camada, isto é, a distribuição eletrônica termina no subnível “d” ou “f”.
São elementos das famílias 3 ao 12.
Os elementos de transição podem ser:
- Transição simples: o elétron de diferenciação está no subnível “d” da penúltima camada.
- Transição interna: o elétron de diferenciação está no subnível “f” da penúltima camada. São eles:
b1) Lantanídios: são os elementos de transição interna do sexto período da família 3.
b2) Actinídios: são os elementos de transição interna do sétimo período da família 3.
Exercícios conceituais
- (Ufrs 2006) A observação da tabela periódica permite concluir que, dos elementos a seguir, o mais denso é o:
- a) Fr. b) Po. c) Hg. d) Pb. e) Os.
- (cftmg 2005) O subnível mais energético do átomo de um elemento é o 5p3, portanto, o seu número atômico e sua posição na tabela periódica serão, respectivamente:
- a) 15, 3° período e coluna 5 A.
- b) 51, 5° período e coluna 5 A.
- c) 51, 3° período e coluna 3 A.
- d) 49, 5° período e coluna 3 A.
- Qual alternativa apresenta somente elementos de transição?
- a) F e S b) B e E c) H e U d) G e I e) H e E
- Quais são as letras dos elementos que representam a família dos alcalinos terrosos?
- Qual letra representa o elemento que possui 3 elétrons na camada de valência
- Qual letra representa o elemento mais eletronegativo da tabela?
- Qual letra representa o elemento de maior ponto de fusão e ebulição?
- Qual a letra que representa o elemento de maior raio atômico, considerando o quarto período da tabela?
- Da família dos calcogênios, qual apresenta o maior potencial de ionização?
Obs.: As massas atômicas na tabela periódica são calculadas por uma média ponderada das massas dos isótopos de cada elemento encontrados na natureza.
Aula 8
Distribuição Eletrônica
Camadas Eletrônicas ou Níveis de Energia
A coroa ou eletrosfera está dividida em 7 camadas designadas por K, L, M, N, O, P, Q ou pelos números: n = 1, 2, 3, 4, 5, 6, 7.
O número de camada é chamado número quântico principal (n).
Número máximo de elétrons em cada nível de energia:
1. Teórico:
Equação de Rydberg: x = 2n2
| K | L | M | N | O | P | Q |
| 2 | 8 | 18 | 32 | 50 | 72 | 98 |
- Experimental:
O elemento de número atômico 112 apresenta o seguinte número de elétrons nas camadas energéticas:
| K | L | M | N | O | P | Q |
| 2 | 8 | 18 | 32 | 32 | 18 | 2 |
Camada de valência é a camada mais externa do átomo e pode contar no máximo 8 elétrons
Subcamadas ou Subníveis de Energia
Uma camada de número n será subdividida em n subníveis:
s, p, d, f, g, h, i…
Nos átomos dos elementos conhecidos, os subníveis teóricos g, h, i… estão vazios.
Número máximo de elétrons em cada subnível experimental:
| s | p | d | f |
| 2 | 6 | 10 | 14 |
Distribuição dos elétrons nos subníveis (configuração eletrônica)
Os subníveis são preenchidos em ordem crescente de energia (ordem energética). Linus Pauling descobriu que a energia dos subníveis cresce na ordem:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…
É nessa ordem que os subníveis são preenchidos. Para obter essa ordem basta seguir as diagonais no Diagrama de Pauling abaixo:
Seqüência de preenchimento de orbitais
Deve-se observar a ordem energética dos subníveis de energia, que infelizmente não é igual à ordem geométrica. Isso porque subníveis de níveis superiores podem ter menor energia total do que subníveis inferiores. A energia de um subnível é proporcional à soma (n + l) de seus respectivos números quânticos principal (n) e secundário (l).
O número quântico azimutal ou secundário, representado pela letra l, especifica a subcamada e, assim, a forma do orbital. Pode assumir os valores 0, 1, 2 e 3, correspondentes às subcamadas s, p, d, f.
Método analítico para ordenação dos subníveis:
Exemplos
1)
3d 4s
n = 3 n = 4
l = 2 l = 0
n + l = 5 n + l = 4
3d é mais energético que 4s
2)
3d 4p
n = 3 n = 4
l = 2 l = 1
n + l = 5 n + l = 5
Quando os subníveis apresentarem a mesma soma, o mais afastado ou de maior nível energético terá maior energia.
Ordem geométrica é a ordenação crescente de níveis energéticos.
Exemplo: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p…
Camada de Valência é o último nível de uma distribuição eletrônica, normalmente os elétrons pertencentes à camada de valência, são os que participam de alguma ligação química.
Exemplo: Arsênio (As): Z = 33
– Ordem energética (ordem de preenchimento): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3
– Ordem geométrica (ordem de camada): 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Camadas Energéticas: K = 2; L = 8; M = 18; N = 5
A camada de valência do As é a camada N, pois é o último nível que contém elétrons.
Distribuição Eletrônica em Íons
Átomo: nº de prótons = nº de elétrons
Íon: nº de prótons (p) ≠ nº de elétrons
Íon positivo (cátion): nº de p > nº de elétrons
Íon negativo (ânion): nº de p < nº de elétrons
Distribuição Eletrônica em Cátion
Retirar os elétrons mais externos do átomo correspondente. Exemplo:
Ferro (Fe) Z = 26 → 1s2 2s2 2p6 3s2 3p6 4s2 3d6 (estado fundamental = neutro)
Fe2+ → 1s2 2s2 2p6 3s2 3p6 3d6 (estado iônico)
Distribuição Eletrônica em Ânion
Colocar os elétrons no subnível incompleto. Exemplo:
Oxigênio (O) Z = 8 → 1s2 2s2 2p4 (estado fundamental = neutro)
O2- → 1s2 2s2 2p6
Os números átomos.
Existem quatro números quânticos: quânticos descrevem a posição (e a energia) dos elétrons nos
Número quântico principal: indica o nível (camada) de energia.
Número quântico secundário ou azimutal: indica o sub-nível de energia.
Número quântico magnético: indica o orbital.
Número quântico de spin: indica a orientação do elétron no orbital.
Dois elétrons nunca terão os quatro números quânticos iguais, pois mesmo que estejam no mesmo nível, no mesmo sub-nível e no mesmo orbital, terão spins opostos. Assim, qualquer par de elétrons pode ter até três números quânticos iguais.
- Número quântico principal, n
O número quântico principal terá como valores 1, 2, 3, 4…de acordo com o nível eletrônico que o elétron se encontra.
- Número quântico azimutal, l
O número quântico azimutal, informa-nos sobre a forma dos orbitais (s, p, d, f). Para um dado valor de n, l pode ter como valores possíveis os números inteiros de 0 a (n − 1). Para os sub-níveis s, p d, f, temos:
s = 0, p = 1 , d = 2 , f = 3
- Número quântico magnético, ml
O número quântico magnético especifica a orientação permitida para uma nuvem eletrônica no espaço, sendo que o número de orientações permitidas está diretamente relacionado à forma da nuvem (designada pelo valor de l). Dessa forma, este número quântico pode assumir valores inteiros de -l, passando por zero, até +l. Para os sub-níveis s, p d, f, temos:
| s | 0 | ||||||
| p | -1 | 0 | +1 | ||||
| d | -2 | -1 | 0 | +1 | +2 | ||
| f | -3 | -2 | -1 | 0 | +1 | +2 | +3 |
- Número quântico de spin, ms
O número quântico de spin indica a orientação do elétron ao redor do seu próprio eixo. Como existem apenas dois sentidos possíveis, este número quântico assume apenas os valores -1/2 e +1/2.
- Exemplos: Quais os nºs quânticos do último elétron (elétron diferencial, verificador) de cada átomo abaixo?
Al = 1s22s22p63s23p1
Logo os nºs quânticos são referentes ao elétron de 3p1:
n = 3 (terceiro nível)
l = 1 (sub-nível p)
ml = -1 (primeiro orbital p)
ms = -1/2 (rotação)
Fe = 1s22s22p63s23p64s23d6
Logo os nºs quânticos são referentes ao elétron de 3d6:
n = 3 (terceiro nível)
l = 2 (sub-nível d)
ml = -2 (primeiro orbital d)
ms = +1/2 (rotação)
Questionário
1) O formulador da teoria de que toda a matéria que existe é formada por átomos, que seriam partículas extremamente pequenas, esféricas, maciças, homogêneas, indivisíveis, indestrutíveis e sem carga elétrica, formando compostos a partir da combinação de dois ou mais átomos foi:
- a) Arnold Sommerfeld por volta de 1919.
b) Joseph John Thomson por volta do ano de1898.
c) Ernest Rutherford por volta do ano de 1914.
d) Niels Bhor por volta do ano de 1915.
e) John Dalton por volta do ano de 1803.
2) Com suas experiências realizadas com o tubo de raios catódicos, foi o descobridor da partícula de carga negativa do átomo, também foi o inventor do espectrógrafo de massa que possibilitava medir as massas dos átomos, elaborou a teoria de que o átomo deveria ser uma pequena esfera de massa positiva, com elétrons de carga negativa incrustados ou dispersos na massa dessa esfera formando a partícula, que poderia também sofrer divisão foi:
- a) Arnold Sommerfeld por volta do ano de 1919.
b) Joseph John Thomson por volta do ano de 1898.
c) Ernest Rutherford por volta do ano de 1914.
d) Niels Bhor por volta do ano de 1915.
e) John Dalton por volta do ano de 1803.
3) O pesquisador que determinou o átomo segundo o modelo do sistema solar, na qual o sol no centro seria a representação do núcleo do átomo carregado positivamente e o planetas em suas órbitas representariam os elétrons de carga negativa nos seus orbitais circulares distantes do núcleo separados por espaços vazios, foi:
- a) James Chadwick em 1932.
b) Hans Geiger em 1933.
c) Robert Oppenheimer em 1934.
d) Ernest Rutherford em 1919.
e) Frederick Soddy em 1914.
4) A produção da luz é o fenômeno que ocorre quando o átomo recebe energia elétrica, térmica, luminosa etc, e o seu elétron localizado no seu orbital sofre:
a) um desarranjo exterior e salta para uma camada mais próxima do núcleo. Cessando essa energia sobre o átomo, o elétron se fixa nesse orbital interno liberando o fóton ou luz.
b) um rearranjo em seu exterior e salta para um nível externo ou mais distante do núcleo. Cessando essa energia sobre o elétron do orbital externo, este volta para o interno liberando o fóton ou luz.
c) exterior salta para o nível interno ou mais próximo do núcleo. Cessando essa energia sobre o átomo, o elétron do orbital interno, volta para o externo liberando o fóton ou luz de diferentes comprimentos de ondas produzindo as cores.
d) transição eletrônica do elétron, que do nível exterior salta para o nível interno ou mais próximo do núcleo. Cessando essa energia sobre o elétron do orbital interno, este volta para o externo liberando os raios de luz infravermelha.
e) transição eletrônica, nesse caso, o elétron do nível exterior salta para um nível interno ou mais próximo do núcleo. Cessando esse energia sobre o átomo, o elétron do orbital interno volta para o externo liberando o fóton ou luz.
5) Nos seus experimentos Rutherford determinou a existência de uma região que contém carga elétrica positiva.
a) Essa região está no centro do átomo onde forma o seu núcleo onde há grandes espaços vazios, aí estão localizadas as partículas de carga positiva do átomo.
b) Essa região está no centro do átomo onde forma o seu núcleo que é denso e pequeno, aí estão localizadas as partículas de carga positiva do átomo.
c) Essa região está na eletrosfera do átomo, onde forma o seu núcleo que é denso e pequeno, aí estão localizadas as partículas de carga positiva e negativa átomo.
d) Essa região está no centro do átomo onde forma o seu núcleo que é vazio e pequeno, aí estão localizadas as partículas de carga negativa do átomo.
e) Essa região está no centro do átomo onde forma ao sua eletrosfera que é densa e pequena, aí estão localizadas as partículas de carga positiva do átomo.
Aula 9
Ligações químicas
É impossível se pensar em átomos como os constituintes básicos da matéria sem se pensar em ligações químicas. Afinal, como podemos explicar que porções tão limitadas de matéria, quanto os átomos, possam formar os corpos com que nos deparamos no mundo macroscópico do dia-a-dia. Também é impossível se falar em ligações químicas sem falarmos em elétrons. Afinal, se átomos vão se unir uns aos outros para originar corpos maiores, nada mais sensato do que pensar que estes átomos entrarão em contato entre si. Quando dois átomos entram em contato, o fazem a través das fronteiras das suas eletrosferas, ou seja, de suas últimas camadas. Isso faz pensar que a última camada de um átomo é a que determina as condições de formação das ligações químicas.
Em 1868, Kekulé e Couper, propuseram a utilização do termo valência para explicar o poder de combinação de um átomo com outros. A valência de um dado elemento é que determina as fórmulas possíveis ou não de compostos formados por ele.
A primeira situação seria entender por que dois ou mais átomos se ligam, formando uma substância simples ou composta. Como, na natureza, os únicos átomos que podem ser encontrados no estado isolado (moléculas monoatômicas) são os gases nobres, logo se pensou que os demais átomos se ligariam entre si tentando alcançar a configuração eletrônica do gás nobre mais próximo deles na tabela periódica. Todos os gases nobres, com exceção do He, possuem 8 elétrons.
Esta maneira de pensar a ligação entre os átomos passou a ser conhecida por Teoria do octeto, e foi proposta por Kossel e Lewis no início do século XX. Baseado nessa ideia, a valência de um átomo passou a ser vista como a quantidade de elétrons que um átomo deveria receber, perder ou compartilhar para tornar sua última camada (camada de valência) igual a do gás nobre de número atômico mais próximo.
As ligações químicas podem ser classificadas em três categorias:
– Iônica – Covalente normal e dativa – Metálica
Ligação Iônica
Como o próprio nome já diz, a ligação iônica ocorre com a formação de íons. A atração entre os átomos que formam o composto é de origem eletrostática. Sempre um dos átomos perde elétrons, enquanto o outro recebe. O átomo mais eletronegativo arranca os elétrons do de menor eletronegatividade. Ocorre entre metais e não metais e entre metais e hidrogênio.
Átomo com facilidade para liberar os elétrons da última camada: metal
Átomo com facilidade de adicionar elétrons à sua última camada: não metal
A ligação iônica ocorre entre metais e não metais e entre metais e hidrogênio. Num composto iônico, a quantidade de cargas negativas e positivas é igual.
A ligação entre o sódio (11Na) e o cloro (17Cl) é um exemplo característico de ligação iônica. Observe a distribuição dos elétrons em camadas para os dois elementos:
Na 2 – 8 – 1 Cl 2 – 8 – 7
Para o cloro interessa adicionar um elétron à sua última camada, completando a quantidade de oito elétrons nela. Ao sódio interessa perder o elétron de sua camada M, assim a anterior passará a ser a última, já possuindo a quantidade necessária de elétrons. Na representação da ligação, utilizamos somente os elétrons da última camada de cada átomo. A seta indica quem cede e quem recebe o elétron. Cada elétron cedido deve ser simbolizado por uma seta. Esta representação é conhecida por fórmula eletrônica ou de Lewis.
O sódio possuía inicialmente 11 prótons e 11 elétrons. Após a ligação, a quantidade de prótons não se altera e a de elétrons passa a ser 10. O cloro que inicialmente possuía 17 prótons e 17 elétrons, tem sua quantidade de elétrons aumentada de uma unidade após a ligação. Com isso o sódio se torna um íon de carga 1+ e o cloro 1-. A força que mantém os dois átomos unidos é de atração elétrica, ou seja, uma ligação muito forte. Como foram utilizados um átomo de cada tipo, a fórmula do composto será NaCl.
De maneira análoga podemos observar a ligação entre o flúor (9F) e o alumínio (13Al). O alumínio perde os três elétrons de sua última camada, pois a penúltima já possui os oito elétrons necessários. Como o átomo de flúor possui 7 elétrons em sua última camada, precisa de apenas mais um elétron. São necessários três átomos de flúor para acomodar os três elétrons cedidos pelo alumínio.
De maneira análoga ao exemplo anterior, ocorre a formação de íons positivo e negativo devido a quebra do equilíbrio entre as quantidades de prótons e elétrons nos átomos. O alumínio passa a ser um íon de carga 3+ e o fluor 1-. A fórmula do composto será AlF3.
Ligação covalente simples
É o tipo de ligação que ocorre quando os dois átomos precisam adicionar elétrons em suas últimas camadas. Somente o compartilhamento é que pode assegurar que que estes átomos atinjam a quantidade de elétrons necessária em suas últimas camadas. Cada um dos átomos envolvidos entra com um elétron para a formação de um par compartilhado, que a partir da formação passará a pertencer a ambos os átomos. Ocorre entre não metais e não metais, não metais e hidrogênio e entre hidrogênio e hidrogênio.
O hidrogênio possui somente uma camada contendo um único elétron, compartilhando 1 elétron, atinge a quantidade necessária para a camada K, que é de dois elétrons. Os elétrons compartilhados passam a ser contados para as eletrosferas dos dois átomos participantes da ligação.
Na molécula de nitrogênio ocorrem três ligações covalentes entre os dois átomos.
7N 2 – 5
Estas três ligações garantem que os dois átomos de nitrogênio atinjam a quantidade de oito elétrons nas suas últimas camadas. A ligação covalente entre dois átomos iguais é dita apolar, pois nela os elétrons são compartilhados de maneira igual, nenhum dos átomos tem mais força que o outro para atrair o elétron para si.
A molécula de CO2 é formada por dois átomos de oxigênio e um de carbono unidos através de ligações covalentes.
6C 2 – 4 8O 2 – 6
O átomo de carbono compartilha 4 elétrons e cada átomo de carbono 2, garantindo assim que ambos atinjam os oito elétrons nas últimas camadas.
Como a ligação é entre átomos diferentes e com diferentes eletronegatividades, a ligação é dita polarpois o átomo de oxigênio atrai para si mais fortemente os elétrons compartilhados.
Além da fórmula eletrônica, os compostos covalentes podem ser representados pela fórmula estrutural, onde cada par compartilhado é representado por um traço.
Ex.: H – H, O = C = O.
Uma ligação covalente unindo dois átomos é dita simples. O conjunto de duas ligações unindo dois átomos é dito dupla ligação. O conjunto de rês ligações unindo dois átomos é dito tripla ligação.
Ligação covalente dativa ou coordenada
A existência de algumas moléculas não pode ser explicada simplesmente através da ligação covalente simples. Para estes casos foi formulada a teoria da ligação covalente coordenada. Neste tipo de ligação, um dos átomos que já estiver com última camada completa entra com os dois elétrons do par compartilhado.
Este par de elétrons apresenta as mesmas características do da ligação covalente simples, a única diferença é a origem dos elétrons, que é somente um dos átomos participantes da ligação. Os elétrons do par passam a pertencer a ambos os átomos participantes. A ligação covalente coordenada é representada por uma seta que se origina no átomo doador e termina no átomo receptor.
Dadas as distribuições eletrônicas em camadas para os átomos de 16S e 8O.
S 2 – 8 – 6 O 2 – 6
Compartilhando dois elétrons através de ligações covalentes simples, ambos os átomos atingem os oito elétrons na última camada.
No entanto, esta molécula ainda pode incorporar ainda um ou dois átomos de oxigênio. Tal fato só pode ser explicado se o enxofre utilizar um ou dois pares de elétrons não envolvidos em ligações para formar um ou dois pares dativos com o oxigênio.
Outra molécula que não pode ser explicada somente com a ligação covalente simples é a de CO2. O interessante desta molécula é que a ligação covalente dativa ocorre do átomo mais eletronegativo (O) para o menos eletronegativo (C).
Ligação metálica
É o tipo de ligação que ocorre entre os átomos de metais. Os átomos dos elementos metálicos apresentam forte tendência a doarem seus elétrons de última camada. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última camada. Forma-se então uma rede ordenada de íons positivos mergulhada num mar de elétrons em movimento aleatório. Se aplicarmos um campo elétrico a um metal, orientamos o movimento dos elétrons numa direção preferencial, ou seja, geramos uma corrente elétrica.
A Escala de Pauling foi definida por Linus Pauling e tem a função de medir a eletronegatividade dos elementos químicos.
A eletronegatividade está relacionada à atratividade dos átomos e moléculas, ou seja, ao potencial que estes possuem de atrair elétrons.
Na tabela periódica, a eletronegatividade aumenta da esquerda para a direita e de baixo para cima, ou seja, conforme os períodos aumentam, maior é o número de camadas da eletrosfera dos elementos e, portanto, maior o seu raio, o que influencia diretamente na sua eletronegatividade, já que haverá uma aproximação menor entre os elétrons a serem compartilhados e o núcleo do átomo, que exerce o ponto de atração.
Assim, o elemento mais eletronegativo é o flúor. A ordem de polaridade é, portanto:
F > O > N > Cl > Br > I > S > C > P > H
A eletronegatividade influencia na ligação entre os átomos, já que haverá a possibilidade de maior ou menor atração.
O átomo com mais eletronegatividade atrai para si mais elétrons. A diferença de eletronegatividade entre os elementos determina se a ligação será polar ou apolar. Se a diferença de eletronegatividade for igual a zero, a ligação será apolar, do contrário a ligação será polar.
A polaridade das ligações químicas explica fatores como o fato de água e óleo não se misturarem. Em razão da polaridade das moléculas da água, uma das ligações mais fortes conhecidas, o óleo permanece em sua superfície, já que, para que pudesse imiscuir-se na água seria necessário o fornecimento de uma quantidade razoável de energia para “quebrar” suas moléculas ou, ainda, que sua ligação fosse, também, polar, o que não ocorre, já que as ligações químicas de óleos e gorduras são apolares. Além disso, os hidrocarbonetos, moléculas formadas por Hidrogênio e Carbono, muitos deles derivados do petróleo, são, também, apolares.
Uma substância polar pode imiscuir-se numa substância polar, da mesma forma que as substâncias apolares podem imiscuir-se entre si.
A eletronegatividade está, portanto, relacionada à força para rompimento de ligações químicas das moléculas.
Numa ligação química, o átomo com maior eletronegatividade, ao atrair os elétrons, fica com a carga negativa. Por outro lado, os átomos com menor eletronegatividade perdem elétrons e, em razão disso, adquirem uma carga positiva.
Além do raio atômico, outro fator que influencia a eletronegatividade é o número de elétrons que o átomo possui em sua última camada. Quanto maior o número de elétrons, mais o átomo deseja atrair elétrons externos para alcançar a estabilidade (8 elétrons na última camada). Porém, tal fator não deve ser considerado como único critério, já que demonstrações práticas sugerem que o Cloro, que possui 7 elétrons na camada de valência, é menos eletronegativo que o Oxigênio, que possui 6 elétrons na camada de valência.
Aula 10
Funções inorgânicas
Na Química Inorgânica são classificadas 4 funções:
- Ácidos 2. Bases 3. Sais 4. Óxidos
Ácidos são todas as substancias que, em meio aquoso, produzem somente íons positivos (cátions) H+
Exemplos: HCl (ácido clorídrico) e H2SO4 (ácido sulfúrico)
Um primeiro critério para classificação dos ácido é conforme possuam ou não oxigênio (O) em sua composição. Segundo este critério, temos os Hidrácidos e os Oxiácidos.
Nomenclatura dos Hidrácidos
Nome do elemento + Sufixo ídrico
Nomenclatura de alguns Oxiácidos:
Bases
Obs.: pode-se resumir a nomenclatura como Hidróxido de …(nome do cátion).
Classificação das bases segundo sua força:
Sais
Nomenclatura dos sais:
Nome do sal = sufixo do sal + nome do íon positivo (cátion)
O sufixo do sal provém do sufixo do ácido de origem:
Óxidos
São compostos binários (dois elementos) que contém oxigênio que é o elemento mais eletronegativo.
Nomenclatura dos óxidos:
Nome do óxido = prefixo de quantidade de oxigênios + óxido de + prefixo da quantidade do outro elemento + nome do outro elemento.
Para os óxidos de metais de nox fixo (com o oxigênio com nox 2) a nomenclatura é:
nome do óxido = óxido de + nome do outro elemento.
– Para óxidos de elementos de nox variável (com o oxigênio com nox 2):
Nome do óxido = óxido de + nome do outro elemento + nox do elemento (em algarismos romanos).
Nome do óxido = peróxido de + nome do outro elemento
Exercícios:
- (FUC-MT) O óxido de magnésio (Mg0) precisa ser substituído por um óxido que apresenta propriedades químicas semelhantes e mesma proporção de átomos. Entre os óxidos a seguir, qual você escolheria?
- (Fuvest-SP)Cal viva é óxido de cálcio (CaO).
- Escreva a equação da reação da cal viva com a água.
- b. Por que, na agricultura, a cal viva é acionada ao solo?
- (ENEM)
I – monumento Itamarati – Brasília (mármore).
II – esculturas do Aleijadinho MG (pedra sabão, contém carbonato de cálcio).
III – grades de ferro ou alumínio de edifícios.
A ação da chuva ácida pode acontecer em:
- I, apenas.
- I e II, apenas.
- I e III, apenas.
- II e III, apenas.
- I, II e III.
- (Fuvest-SP)Quando aplicada em ferimentos, a água oxigenada parece “ferver”. Por quê?
- Escreva a equação que representa a reação química envolvida.
- (Fuvest-SP)Na respiração animal, o ar expirado pode ser distinguido do ar inspirado borbulhando-se separadamente em soluções aquosas de hidróxido de bário.
- Qual o critério usado para fazer essa diferenciação?
- Represente o fato observado por meio de uma equação química.



