QUÍMICA-DIAGRAMA DE LINUS PAULING
1) Utilizando o diagrama de Pauling, realize a distribuição eletrônica do elemento tungstênio (W), cujo número atômico (Z) é igual a 74 e, posteriormente, forneça:
a) A distribuição eletrônica em ordem de energia;
b) A ordem geométrica;
c) O número total de elétrons por camada;
d) O número de elétrons no subnível mais energético;
e) O número de elétrons no subnível mais externo.
2) Faça a distribuição eletrônica em níveis de energia para os seguintes elementos:
a) 9F
b) 10Ne
c) 15P
d) 28Ni
e) 56Ba
3) (UNI-RIO)“Os implantes dentários estão mais seguros no Brasil e já atendem às normas internacionais de qualidade. O grande salto de qualidade aconteceu no processo de confecção dos parafusos e pinos de titânio, que compõem as próteses. Feitas com ligas de titânio, essas próteses são usadas para fixar coroas dentárias, aparelhos ortodônticos e dentaduras, nos ossos da mandíbula e do maxilar.”
Jornal do Brasil, outubro 1996.
Considerando que o número atômico do titânio é 22, sua configuração eletrônica será:
a) 1s22s22p6 3s2 3p3
b) 1s22s22p6 3s2 3p5
c) 1s22s22p6 3s2 3p6 4s2
d) 1s22s22p6 3s2 3p6 4s2 3d2
e) 1s22s22p6 3s2 3p6 4s2 3d10 4p6
4) Considerando-se um elemento M genérico qualquer, que apresenta configuração eletrônica 1s2 2s2 2p6 3s2 3p6 4s2 3d5, pode-se afirmar que:
- seu número atômico é 25;
- possui 7 elétrons na última camada;
III. apresenta 5 elétrons desemparelhados;
- pertencem a família 7A.
Estão corretas as afirmações:
a) I, II e III somente
b) I e III somente
c) II e IV somente
d) I e IV somente
e) II, III e IV somente
5) (UFSC) O número de elétrons em cada subnível do átomo estrôncio (38Sr) em ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
6) (OSEC) Sendo o subnível 4s1 (com um elétron) o mais energético de um átomo, podemos afirmar que:
- o número total de elétrons desse átomo é igual a 19;
- esse apresenta quatro camadas eletrônicas;
III. a sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 3d10 4s1
a) Apenas a firmação I é correta.
b) Apenas a firmação II é correta.
c) Apenas a firmação III é correta.
d) As afirmações I e II são corretas.
e) As afirmações II e III são corretas.
7) (CESCEM) Qual dos valores abaixo pode representar o número atômico de um átomo que, no estado fundamental, apresenta apenas dois elétrons de valência?
- a) 16
- b) 17
- c) 18
- d) 19
- e) 20
1) Distribuição eletrônica no diagrama de Pauling:
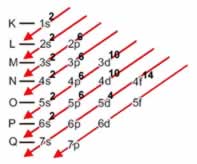
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4
b) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2
c) K = 2; L = 8; M = 18; N = 32 ; O = 12; P = 2
d) O subnível mais energético é sempre o último a receber elétrons no diagrama de Pauling; logo, no átomo de tungstênio esse subnível é o 5d, apresentando 4 elétrons.
e) O subnível mais externo de um átomo é sempre aquele que se encontra mais afastado do núcleo, ou seja, localiza-se na camada de valência. No tungtênio temos 6 níveis de energia; logo, o subnível mais externo está localizado no nível 6 ou na sexta camada. Assim, os elétrons mais externos estão situados no subnível 6s, contendo 2 elétrons.


