| DISCIPLINA: QUÍMICA – 2° SÉRIE – 1° BIMESTRE.
CRONOGRAMA DE ATIVIDADES |
| 1ª semana 01/02/2018
Apresentação, acolhimento, acordo pedagógico. Explicações de como seria avaliações, estratégias de ensino, recuperações da aprendizagem.
|
| 2ª semana 05/02/2018 a 09/02/2018
Situação de Aprendizagem 1 – Propriedades da água para o consumo humano. Conceitos de pureza e potabilidade. Competência e habilidades. Fazer uso da linguagem química para expressar conceitos relativos a pureza das concentrações de solutos em sistemas líquidos; interpretar dados apresentados em tabelas gráficos concernentes ao critério brasileiro de potabilidade da água; aplicar conceitos de concentração para avaliar a qualidade de diferentes águas; reconhecer como algumas propriedades específicas da água possibilitam a vida no planeta.
|
| 4ª semana 19/02/2018 a 23/02/2018
Situação de Aprendizagem 2 – Dissolução de materiais em água e mudança de suas propriedades. Conteúdos e temas: Calor específico; densidade; temperatura de ebulição da água com a presença de solutos; solubilidade; outras propriedades. Competência e habilidades. Reconstruir o conceito de solubilidade em um nível mais amplo, como “extensão da dissolução”; compreender como as propriedades peculiares da água possibilitam a existência de vida no planeta; a partir de dados experimentais, concluir como a presença de solutos afeta as propriedades características da água; aplicar esses conhecimentos na resolução de problemas ambientais, industriais e relacionados com a saúde. |
| 5ª semana 26/02/2018 a 02/03/2018Situação de Aprendizagem 3 – Concentração de Soluções – DiluiçãoConteúdos e temas: Soluções – unidades de concentração; % em massa g.L-1; ppm.Compreender o conceito de concentração; compreender as unidades que expressam a composição das soluções e utiliza-las adequadamente; realizar cálculos envolvendo as diferentes unidades de concentração e aplica-los no reconhecimento de problemas relacionados a quantidade da água para o consumo. |
| 6ª/ 7ª semanas 05/03/2018 a 16/03/2018Situação de Aprendizagem 4 – Utilizando a grandeza quantidade de matéria (mol); concentração em mol . L-1. Fazer usos da linguagem química; construir o conceito de concentração em quantidade de matéria/volume para ampliar a compreensão do significado da concentração e aplica-lo a novas situações que permitem melhor entendimento do mundo físico |
| 8ª/ 9ª semanas 19/03/2018 a 30/03/2018Situação de Aprendizagem 5 – Oxigênio dissolvido na água – uma questão da qualidadeCompetência e habilidades. Fazer usos da linguagem química; compreender a importância do oxigênio dissolvido no meio aquático; construir e aplicar o conceito de DBO e relacionar informações sobre DBO para entender problemas ambientais e poder enfrentar situações; interpretar informações de gráficos. |
| 10ª/11ª Fechamento e avaliação, recuperação do 1° bimestre será realizada nas semanas: |
| 11ª semana 16/04 a 20/04/2018Orientação e revisão do 1 bimestre, a respeito do conteúdo. Auto avaliação do professor e aluno. |
| 12ª semana 23/04 a 27/04/2018Situação de Aprendizagem 6 – Tratamento daÁgua – Uma questão de sobrevivênciaCONTEÚDOS E TEMAS: Etapas de Tratamento da água.COMPETÊNCIA E HABILIDADES.Compreender a necessidade de tornar a água potável; conhecer procedimentos para seu tratamento, aplicando conceitos e processos como separação de sistema heterogêneos, solubilidade e transformação química; organizar e interpretar informações sobre o tratamento e consumo de água para refletir sobre o uso consciente da água e tomar suas decisões dentro dos limites, a esse respeito. |
| 13ª semana 30/04 a 04/05/2018Situação de Aprendizagem 7 – As quantidades em transformações que ocorrem em solução – Um cálculo importante no tratamento da águaCONTEÚDOS E TEMAS:Relações quantitativas de massa e de quantidade de matéria (mol) nas transformações químicas que ocorrem em soluções.COMPETÊNCIA E HABILIDADES.Construir e aplicar conceitos relativos ás proporções de reagentes e produtos numa reação em solução, compreendendo a importância desses cálculos na sociedade; interpretar a equações químicas em termos quantitativos. |
| 14ª semana 07/05 a 11/05/2018Situação de Aprendizagem 8 – Como o ser humano utiliza a água? Podemos interferir nos modos como a sociedade vem utilizando a água?CONTEÚDOS E TEMAS:Poluição ambiental; responsabilidades legais e pessoais; uso da água e sua preservação.COMPETÊNCIA E HABILIDADES.Buscar dados e informações sobre poluição das águas; conhecer aspectos da legislação sobre a água e sobre seus usos, para compreender o problema e refletir sobre formas de atuação que auxiliam no enfretamento das situações cotidianas e na elaboração de propostas de intervenção em sua realidade. |
| 15ª semana 14/05 a 18/05/2018Situação de Aprendizagem 9 – Explicando o comportamento de materiais; modelos sobre a estrutura da matéria.CONTEÚDOS E TEMAS:Natureza elétrica da matéria – condutividade elétrica dos materiais, isolantes e condutores.COMPETÊNCIA E HABILIDADES.Classificação e estabelecimento de critérios; controle de variáveis; elaboração de modelo explicativos; ideias de Thomson, Rutheford e Bohr; Tabela periódica – estrutura e propriedades dos elementos. |
| 16ª semana 21/05 a 25/05/2018Situação de Aprendizagem 10 – Explicando o comportamento de materiais; as ligações entre átomos, íons e moléculas.CONTÉUDOS E TEMAS:Forças de atração e de repulsão elétrica; ligações químicas; localização dos metais e não metais na tabela periódica.COMPETÊNCIA E HABILIDADES.Interpretar a ligação química em termos das atrações e repulsões entre elétrons e núcleos, relacionando as propriedades das substâncias de maneira a ampliar o entendimento do mundo físico; reconhecer a ideia de ligação química como modelo explicativo. |
| 17ª semana 28/05 a 01/06/2018Situação de Aprendizagem 11Transformações químicas; uma questão de quebra e formação de ligações.CONTÉUDOS E TEMAS:Ligações químicas; modelo explicativo para transformação química; energia de ligação; modelo explicativo para transformações químicas exotérmicas e endotérmicas.COMPETÊNCIA E HABILIDADES.Empregar a linguagem química; interpretar a transformação química como a quebra e formação de ligações; compreender e identificar a energia envolvida na quebra e formação de ligações químicas, fazer previsões a respeito da energia envolvida numa transformação química. |
| 18ª semana 04/06 a 08/06/2018
Situação de Aprendizagem 12 – Representando a energia envolvida nas transformações; o uso de diagramas de energia. CONTEÚDOS E TEMAS:Diagramas de energia; calor de reação; reação exotérmicas e endotérmicas. COMPETÊNCIA E HABILIDADES.Fazer uso da linguagem química; compreender, utilizar e saber construir gráficos de energia. |
DISCIPLINA: QUÍMICA – 2° SÉRIE – 3° BIMESTRE.
19ª semana
SITUAÇÃO DE APRENDIZAGEM 1
FORÇAS DE INTERAÇÃO ENTRE PARTÍCULAS
QUE COMPÕEM OS ESTADOS SÓLIDO, LÍQUIDO E GASOSO
Conteúdos e temas: interações entre íons, átomos e moléculas: volatilidade, temperaturas de
fusão e de ebulição e forças de interação.
Competências e habilidades: construir e interpretar o conceito de forças interpartículas,
relacionando-as às propriedades das substâncias iônicas, moleculares e metálicas; aplicar
os conhecimentos adquiridos em situações do cotidiano que envolvem diferentes tipos de
interação.
Sugestão de estratégias de ensino: trabalho em grupo; análise de tabelas; interpretação de gráficos;
aulas expositivas dialogadas; pesquisas; atividade prática; elaboração de textos; seminários.
Sugestão de recursos: material para atividade prática; atividades propostas.
Sugestão de avaliação: questões propostas; elaboração de texto; busca em fontes de informação;
apresentação de seminários; atividade-síntese.
O átomo de Bohr
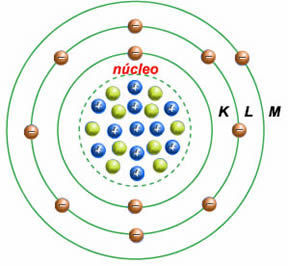
No ano de 1913, o dinamarquês especialista em física atômica Niels Bohr (1885-1962) estabeleceu o modelo atômico sistema planetário que é usado atualmente.
Bohr chegou a esse modelo baseando-se no dilema do átomo estável. Ele acreditava na existência de princípios físicos que descrevessem os elétrons existentes nos átomos. Esses princípios ainda eram desconhecidos e graças a esse físico passaram a ser usados.
Bohr iniciou seus experimentos admitindo que um gás emitia luz quando uma corrente elétrica passava nele. Isso se explica pelo fato de que os elétrons, em seus átomos, absorvem energia elétrica e depois a liberam na forma de luz. Sendo assim, ele deduziu que um átomo tem um conjunto de energia disponível para seus elétrons, isto é, a energia de um elétron em um átomo é quantizada. Esse conjunto de energias quantizadas mais tarde foi chamado de níveis de energia.
Com essas conclusões Bohr aperfeiçoou o modelo atômico de Rutherford e chegou ao modelo do átomo como sistema planetário, onde os elétrons se organizam na eletrosfera na forma de camadas.
Conceito de Bohr: Os elétrons estão distribuídos em camadas ao redor do núcleo. Existem 7 camadas eletrônicas, representadas pelas letras maiúsculas: K, L, M, N, O, P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.
As camadas da eletrosfera representam os níveis de energia da eletrosfera. Assim, as camadas K, L, M, N, O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.
A partir dessa descrição, é fácil deixar-se induzir por uma concepção de um modelo que lembra a órbita de um planeta, com elétrons orbitando ao redor do “núcleo-sol”.
20ª semana
Camada de valência
A camada de valência é o nível mais afastado do núcleo de um átomo e pode ser determinada por meio de distribuição eletrônica ou pela tabela periódica.
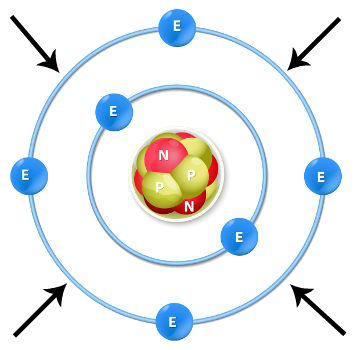
A camada de valência é a camada mais externa que um átomo pode apresentar, ou seja, é a camada mais distante do núcleo de um átomo. Uma das formas de determiná-la é por meio da distribuição eletrônica fundamental no diagrama de Linus Pauling. Como podemos observar no diagrama de Linus Pauling acima, um átomo apresenta sete níveis de energia (1 a 7). Quando realizamos a distribuição eletrônica, a camada de valência será sempre a última. Veja os exemplos a seguir:
Como podemos observar no diagrama de Linus Pauling acima, um átomo apresenta sete níveis de energia (1 a 7). Quando realizamos a distribuição eletrônica, a camada de valência será sempre a última. Veja os exemplos a seguir:
Exemplo 1: Átomo de sódio (11Na)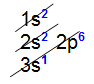 Analisando a distribuição eletrônica acima, é possível constatar que a camada de valência (o nível mais afastado do núcleo) é o terceiro nível e apresenta um elétron (no subnível s).Exemplo 2: Átomo de germânio (32Ge)
Analisando a distribuição eletrônica acima, é possível constatar que a camada de valência (o nível mais afastado do núcleo) é o terceiro nível e apresenta um elétron (no subnível s).Exemplo 2: Átomo de germânio (32Ge)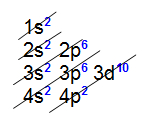 Analisando a distribuição acima, é possível constatar que a camada de valência (nível mais afastado do núcleo) é o quarto nível e possui quatro elétrons (nos subníveis s e p).Exemplo 3: Átomo de urânio (92U)
Analisando a distribuição acima, é possível constatar que a camada de valência (nível mais afastado do núcleo) é o quarto nível e possui quatro elétrons (nos subníveis s e p).Exemplo 3: Átomo de urânio (92U).jpg) Analisando a distribuição eletrônica do urânio, é possível constatar que a camada de valência é o sétimo nível e apresenta dois elétrons (no subnível s).
Analisando a distribuição eletrônica do urânio, é possível constatar que a camada de valência é o sétimo nível e apresenta dois elétrons (no subnível s).
21ª semana
Camada de valência e a tabela periódica Podemos ainda determinar a camada de valência por meio do período e da família do elemento na Tabela Periódica.
a) Período O período (coluna horizontal, numerada de 1 a 7) em que o elemento está é a sua camada de valência.
Exemplo 1: Átomo de estanho (Sn)O estanho está localizado no quinto período da tabela periódica, logo, sua camada de valência é a quinta.
Exemplo 2: Átomo de bário (Ba)O bário está localizado no sexto período da tabela periódica, logo, sua camada de valência é a sexta.
Exemplo 3: Átomo de meitnério(Mt)O meitnério está localizado no sétimo período da tabela periódica, logo, sua camada de valência é a sétima.
b) Família A Quando o elemento pertence à família A, o número da família sempre será o número de elétrons na camada de valência, distribuídos nos subníveis s (limite de 2 elétrons) e p (limite de 6 elétrons).
Exemplo 1: Átomo de estanho (Sn)O estanho está localizado na família IVA da tabela periódica, logo, sua camada de valência apresenta quatro elétrons (dois estão presentes no subnível s e dois estão no subnível p).
Exemplo 2: Átomo de bário (Ba)O bário está localizado na família IIA da tabela periódica, logo, sua camada de valência apresenta dois elétrons (no subnível s).
c) Família B Independentemente da família B a que o elemento pertença, sua camada de valência sempre apresentará 2 elétrons (no subnível s).
Exemplo 1: Átomo de meitnério (Mt)O meitnério está localizado na família VIIB da tabela periódica, logo, sua camada de valência apresenta dois elétrons (no subnível s).
Exemplo 2: Átomo de cobre (Cu)O cobre está localizado na família IB da tabela periódica, logo, sua camada de valência apresenta dois elétrons (no
Publicado por: Líria Alves de Souza em Química Geral 0 Comentários
Publicado por: Diogo Lopes Dias em Química Geral1 Comentário
Assista às nossas videoaulas
Íons
Os íons são átomos que ganham ou perdem elétrons durante uma reação, podendo ser classificado em: ânions ou cátions.
Publicado por: Líria Alves de Souza em Química Geral0 Comentários
Na+ e Cl–
Você sabe o que significa os sinais positivo e negativo destes elementos? Eles aparecem para indicar a presença de íons, neste caso se trata dos íons participantes da reação de formação do Cloreto de Sódio:
Na+ + Cl– ↔ NaCl
A seta indica que a reação é reversível.
Os íons explicam porque o composto é formado: o átomo de sódio (Na) não é estável, pois apresenta 1 elétron livre na camada de valência, a estabilidade só será atingida se ele perder um elétron, o que dará origem ao cátion Na+.
O átomo de cloro (Cl-) por sua vez também não é estável, pelos mesmos motivos que o Na, e atingirá a estabilidade somente se ganhar um elétron, esse átomo dá origem ao íon Cl-.
Sendo assim, a ligação iônica surge através da interação eletrostática e obedece a regra: cargas com sinais opostos se atraem.
Os compostos iônicos adquirem estrutura eletronicamente neutra por possuírem a mesma quantidade de prótons e elétrons, mas os íons formadores, pelo contrário: são reativos e instáveis.
Resumindo: Íons são átomos que perdem ou ganham elétrons durante reações, eles se classificam em ânions e cátions:
Ânion (íon negativo): átomo que recebe elétrons e fica carregado negativamente.
Exemplos: F-1, O-2.
Cátion (íon positivo): átomo que perde elétrons e adquire carga positiva. Exemplos:
Mg+2, Pb+4.
Exemplos de ionização de elementos químicos:9F → 9F-
Átomo neutro recebe 1 elétronO átomo de Flúor (F) se encontrava eletricamente neutro, mas como ganhou 1 elétron passou a se apresentar como um Ânion.
Átomo neutro perde 2 elétronsO átomo de Cálcio (Ca) perdeu 2 elétrons e passou a ser um cátion.
40Ca → 40Ca2+
22ª semana
-
Ligação Iônica
Ligação iônica é uma interação entre átomos na qual ocorre a perda e o ganho de elétrons, resultando em compostos com características e fórmulas bem particulares.

O cloreto de sódio é um exemplo de composto formado a partir de ligação iônica entre os átomos
Ligação iônica é o nome dado a uma das três formas como os átomos podem interagir entre si. As outras formas de interação entre átomos são a ligação covalente, que ocorre entre átomos de ametais, hidrogênios, ou ametal e hidrogênio, e a ligação metálica, a qual acontece somente entre átomos de um mesmo metal.Os átomos dos elementos químicos que participam da ligação iônica devem apresentar, obrigatoriamente, a natureza de ganhar ou perder elétrons, assim, a ligação iônica pode ocorrer entre:
- um metal e um ametal;
- um metal e o hidrogênio.
As fórmulas dos compostos formados a partir de ligação iônica sempre apresentam um padrão YX, em que o Y sempre será o elemento metálico. Dessa forma, para identificar um composto iônico, basta verificar se a fórmula inicia com um elemento metálico.Princípio da ligação iônicaPara um melhor entendimento de como ocorre uma ligação iônica, vamos utilizar a substância iônica mais conhecida entre nós, o cloreto de sódio (NaCl). Nesse composto iônico, estão os elementos:
- Sódio: elemento metálico, pois possui característica de perder elétron; pertencente à família IA, de número atômico 11, com um elétron na camada de valência, como podemos observar na distribuição eletrônica abaixo:
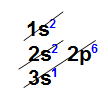 Distribuição eletrônica do elemento sódioA perda de elétron ocorre com relação aos elétrons que estão na camada de valência, logo, o átomo de sódio perde apenas um elétron. Com isso, ele passa a ter uma nova camada de valência, a segunda, que contém oito elétrons (obedecendo, assim, a regra do octeto).
Distribuição eletrônica do elemento sódioA perda de elétron ocorre com relação aos elétrons que estão na camada de valência, logo, o átomo de sódio perde apenas um elétron. Com isso, ele passa a ter uma nova camada de valência, a segunda, que contém oito elétrons (obedecendo, assim, a regra do octeto).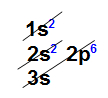 Nova camada de valência do elemento sódio
Nova camada de valência do elemento sódio
- Cloro: elemento ametálico, pois possui característica de ganhar elétron; pertencente à família VIIA, de número atômico 17, com sete elétrons na camada de valência, como podemos observar na distribuição eletrônica abaixo:
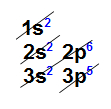 Distribuição eletrônica do elemento cloroO ganho de elétron ocorre na camada de valência, dessa forma, o átomo de cloro ganha um elétron, pois falta apenas um para atingir a regra do octeto. Com isso, ele passa a ter oito elétrons na sua camada de valência.
Distribuição eletrônica do elemento cloroO ganho de elétron ocorre na camada de valência, dessa forma, o átomo de cloro ganha um elétron, pois falta apenas um para atingir a regra do octeto. Com isso, ele passa a ter oito elétrons na sua camada de valência. Nova camada de valência do elemento cloroObs.: Assim, de uma forma geral, seguindo a regra do octeto, na ligação iônica, o metal, ao perder seus elétrons na camada de valência, torna-se estável, pois passará a ter uma nova camada de valência com dois (desde que seja no primeiro nível) ou oito elétrons. Com os ametais ou o hidrogênio não é diferente, pois, ao ganhar elétrons, passarão a ter dois ou oito elétrons na camada de valência.Construção das fórmulas químicas dos compostos formados por ligação iônicaPara construir a fórmula de uma substância formada a partir da ligação iônica, devemos obedecer o seguinte padrão:
Nova camada de valência do elemento cloroObs.: Assim, de uma forma geral, seguindo a regra do octeto, na ligação iônica, o metal, ao perder seus elétrons na camada de valência, torna-se estável, pois passará a ter uma nova camada de valência com dois (desde que seja no primeiro nível) ou oito elétrons. Com os ametais ou o hidrogênio não é diferente, pois, ao ganhar elétrons, passarão a ter dois ou oito elétrons na camada de valência.Construção das fórmulas químicas dos compostos formados por ligação iônicaPara construir a fórmula de uma substância formada a partir da ligação iônica, devemos obedecer o seguinte padrão:
- Determinar a carga do cátion;
- Determinar a carga do ânion;
- Cruzar as cargas, de forma que a carga do cátion seja o índice atômico (número à direita da sigla) do ânion, e vice-versa.
1º Exemplo: Fórmula com os elementos alumínio e bromo.
- Alumínio: é um metal, por isso, tem a tendência de perder elétron; da família IIIA, pois possui três elétrons na camada de valência, logo, sua carga é +3;
- Bromo: é um ametal, por isso, tem a tendência de ganhar elétron; da família VIIA, pois possui sete elétrons na camada de valência, logo, sua carga é -1;
- O número 3, referente à carga do alumínio, será o índice do bromo, e o número 1, referente à carga do bromo, será o índice do alumínio.
Como a carga do alumínio é +3 e a do bromo é -1, assim, a fórmula do composto iônico será AlBr3.2º Exemplo: Fórmula com os elementos magnésio e hidrogênio.
- Magnésio é um metal, por isso, tem a tendência de perder elétron; da família IIA, pois possui dois elétrons na camada de valência, portanto, sua carga é +2;
- Hidrogênio: não é ametal, porém, quando próximo a um metal, apresenta a tendência de ganhar elétron; não pertence a nenhuma família, pois possui um elétron na camada de valência. Assim, sua carga é -1;
- O número 2, referente à carga do magnésio, será o índice do hidrogênio, e o número 1, referente à carga do hidrogênio, será o índice do magnésio.
Como a carga do magnésio é +2 e a do hidrogênio é -1, logo, a fórmula do composto iônico será MgH2.Características dos compostos químicos formados por ligação iônicaDe uma forma geral, os compostos iônicos, isto é, substâncias formadas mediante ligação iônica, apresentam as seguintes características:
- São sólidos à temperatura ambiente;
- Seus átomos organizam-se de uma maneira a produzir um retículo cristalino (um cristal).
Obs.: Nos compostos iônicos, os átomos aglomeram-se de forma a ocupar os vértices de estruturas cristalinas. No cloreto de sódio, por exemplo, um ânion cloreto (esfera roxa) interage ao mesmo tempo com seis cátions sódio (esferas verdes):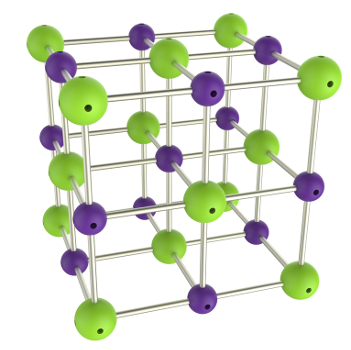 Representação da estrutura cristalina do cloreto de sódio
Representação da estrutura cristalina do cloreto de sódio
- São solúveis em água;
- São capazes de realizar o fenômeno da dissociação (liberação de íons) quando sofrem fusão, ou seja, quando passam do estado sólido para o estado líquido, ou quando estão dissolvidos em água;
- Apresentam elevados pontos de fusão e de ebulição;
- Possuem brilho;
- Conduzem corrente quando dissolvidos em água ou após sofrerem o processo de fusão.
Assista às nossas videoaulas
23ª semana
Ligação Covalente
Publicado por: Jennifer Rocha Vargas Fogaça em Química Geral 0 Comentários
A ligação covalente é um tipo de ligação química realizada entre os átomos de hidrogênio, ametais e semimetais que compartilham entre si pares de elétrons.
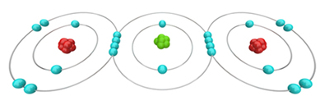
O dióxido de carbono é formado por ligações covalentes entre o carbono e dois átomos de oxigênio
A ligação covalente é um tipo de ligação química que ocorre com o compartilhamento de pares de elétrons entre átomos que podem ser o hidrogênio, ametais ou semimetais.
Segundo a teoria ou regra do octeto, os átomos dos elementos ficam estáveis quando atingem a configuração eletrônica de um gás nobre, ou seja, quando eles possuem oito elétrons em sua camada de valência (camada mais externa) ou dois elétrons — no caso de possuírem somente a camada eletrônica K.
Assim, seguindo essa regra, os átomos dos elementos mencionados possuem a tendência de ganhar elétrons para alcançarem a estabilidade. Por exemplo, o hidrogênio no estado fundamental possui somente um elétron na sua camada eletrônica; assim, para ficar estável, ele precisar receber mais um elétron de outro átomo.
Se tivermos dois átomos de hidrogênio, ambos precisarão receber um elétron cada. Por isso, em vez de transferirem elétrons (como ocorre na ligação iônica), eles farão uma ligação covalente em que compartilharão um par de elétrons. Desse modo, ambos ficarão com dois elétrons, adquirindo a estabilidade:
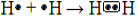
Ligação covalente de formação do gás hidrogênio
Essa forma de representar as ligações químicas, em que os elétrons da camada de valência são colocados ao redor do símbolo do elemento como “pontinhos”, é chamada de fórmula eletrônica de Lewis. Nela, cada par de elétrons compartilhado em uma ligação covalente é representado por um “enlaçamento” entre os dois pontinhos.
Existe outra forma de representar as ligações covalentes, que é por meio da fórmula estrutural. Nessa fórmula, cada par compartilhado é representado por um traço. Veja:

Representação das ligações covalentes em fórmulas estruturais
Assim, a ligação que forma o gás hidrogênio é representada da seguinte forma: H─H. E sua fórmula molecular é H2.
Visto que o hidrogênio é capaz de realizar somente uma ligação covalente, dizemos que ele é monovalente. Veja na tabela a seguir a quantidade de ligações covalentes que os principais ametais e semimetais podem realizar:
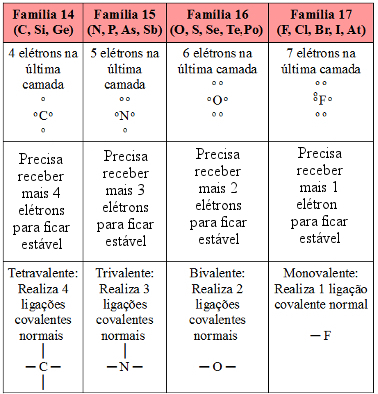
Possibilidades de realização de ligação covalente dos ametais e semimetais principais da Tabela Periódica
Com base nisso, consideremos agora a molécula de dióxido de carbono (CO2). O carbono, que pertence à família 14, possui quatro elétrons na última camada, como mostrado na tabela, e precisa fazer quatro ligações covalentes para ficar estável. Já o oxigênio é da família 16, possui seis elétrons na camada de valência e precisa realizar duas ligações. Desse modo, o carbono compartilha dois pares de elétrons ou faz duas ligações duplas com cada átomo de oxigênio. Veja como ficam as fórmulas eletrônica e estrutural, respectivamente, do dióxido de carbono:
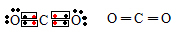
Fórmula eletrônica e estrutural do dióxido de carbono
Veja mais exemplos a seguir:
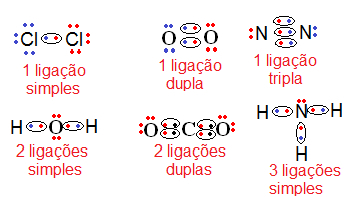
Exemplos de ligações covalentes (fórmulas eletrônicas)
Mas existe um tipo especial de ligação covalente. Estude sobre ela no texto Ligação Covalente Dativa.

Assista às nossas videoaulas
Ligação covalente dativa
A ligação covalente dativa ocorre quando um átomo transfere elétrons, essa transferência é indicada pelo vetor (seta).
Ligação covalente dativa ocorre quando um átomo compartilha seus elétrons. Essa ligação obedece à Teoria do Octeto, onde os átomos se unem tentando adquirir oito elétrons na camada de valência para atingir a estabilidade eletrônica.
Exemplo: formação de dióxido de enxofre (SO2)
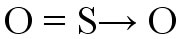
O átomo de enxofre (S) adquire seu octeto através da ligação com o oxigênio localizado à esquerda (ligação dupla coordenada). O oxigênio à direita necessita de elétrons para completar a camada de valência, e então o enxofre doa um par de elétrons para esse oxigênio. Essa transferência de elétrons é indicada pelo vetor (seta) e corresponde à ligação covalente dativa.
Vejamos o compartilhamento de elétrons na formação do composto Sulfato, onde um átomo central de enxofre estabelece ligações covalentes com quatro átomos de oxigênio.
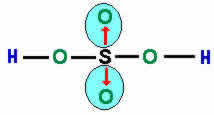
As setas vermelhas indicam as ligações dativas e os traços indicam o compartilhamento de elétrons. Na ligação dativa, o átomo de enxofre “doa” um par de elétrons para cada átomo de oxigênio, estes, por sua vez, atingem a estabilidade eletrônica.
Publicado por: Diogo Lopes Dias em Química Geral0 Comentários
24ª semana
ligação metálica?
O que é ligação metálica? Trata-se da forma como os átomos de um elemento metálico interagem entre si, o que origina diversas propriedades importantes, como a maleabilidade e a ductibilidade.

Os metais são elementos químicos que apresentam como principal característica física a capacidade de perder elétrons e, consequentemente, formar cátions metálicos. Por essa razão, eles podem realizar dois tipos de ligações químicas: a ligação iônica e a ligação metálica.
A ligação iônica ocorre quando um metal interage com um elemento de natureza ametálica, que pode ser um ametal ou o hidrogênio. Nesse tipo de ligação, temos a perda de elétrons por parte dos metais e o ganho de elétrons por parte dos ametais ou do hidrogênio.
Já a ligação metálica é estabelecida entre os átomos de um único elemento metálico. Esse tipo de ligação ocorre apenas entre os átomos de um único metal e exclusivamente porque um metal não pode estabelecer ligação química com outro elemento metálico diferente.
Características gerais dos metais
- Sólidos em temperatura ambiente, com exceção do mercúrio
- São brilhantes;
- Apresentam elevados pontos de fusão e de ebulição;
- Apresentam, em geral, cor prateada, com exceção do ouro, que é dourado, e do cobre, que é avermelhado;
- Os metais puros são formados por aglomerados de átomos (de um único elemento químico) denominados de retículos cristalinos.
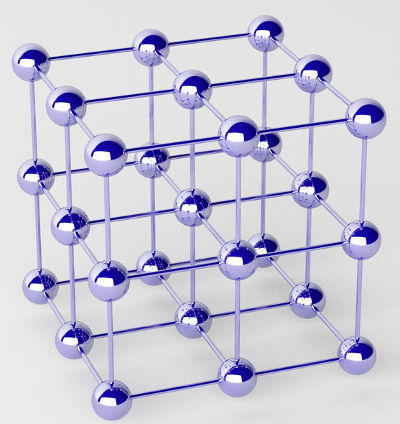
Representação do retículo cristalino de um metal
Princípios da ligação metálica
Na ligação metálica, os retículos cristalinos que formam os metais são, na verdade, um aglomerado iônico (composto apenas por cátions e elétrons). Os elétrons presentes na camada de valência dos átomos do metal são deslocalizados, ou seja, saem da camada de valência, fazendo com que o átomo se torne um cátion (deficiente em elétrons).
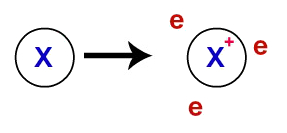
Representação dos elétrons deslocalizados da camada de valência
Após serem deslocalizados, os elétrons provenientes dos átomos do metal passam a rodear os cátions, formando um verdadeiro “mar de elétrons”. Cada um dos elétrons presentes nesse mar possui capacidade de mover-se por meio do retículo cristalino do metal livremente.
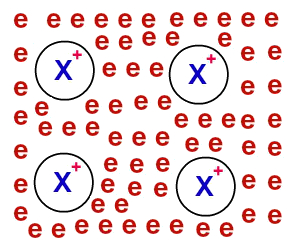
Representação do modelo do mar de elétrons
OBS.: Os elétrons “do mar” não são capazes de abandonar o retículo cristalino e movimentam-se por ele.
Propriedades dos metais justificadas pela ligação metálica
a) Maleabilidade
Por meio de um metal, é possível produzir chapas de diversas espessuras e lâminas. É graças a essa propriedade dos metais que podemos construir diversos objetos, como facas, espadas etc.

A lâmina de uma espada é feita a partir de um metal
b) Condutibilidade
Os metais, de uma forma geral, são bons condutores de corrente elétrica e calor. Quando um metal qualquer está em contato com uma fonte de calor ou com uma fonte de corrente elétrica, ele é capaz de conduzi-los.

Uma panela de alumínio na chama de um fogão fica inteiramente quente em virtude da condutividade
c) Ductibilidade
Por meio de um metal, podemos produzir fios. A utilização de um metal na forma de fios facilita a sua utilização, principalmente em relação à condutibilidade elétrica.

Um metal, como o cobre, pode ser utilizado para a produção de fios
Ligação Metálica

As propriedades de uma ligação são diferentes das propriedades dos seus elementos constituintes. Os metais quando analisados separadamente possuem características únicas que os diferem das demais substâncias: eles são sólidos à temperatura ambiente (25°C) e apresentam cor prateada.
A estrutura atômica dos metais é a Cristalina, que se constitui por cátions do metal envolvidos por uma nuvem de elétrons. A capacidade que os metais têm de conduzir eletricidade se explica pela presença dessa nuvem de elétrons, que conduz corrente elétrica nos fios de eletricidade, não só neles, mas em qualquer objeto metálico.
As ligas metálicas possuem algumas particularidades que os metais puros não apresentam. Justamente por isso, são produzidas e utilizadas em abundância. Vejamos as propriedades das ligações metálicas
Aumento da dureza: se pegarmos, por exemplo, o elemento Ouro (Au) da forma como é encontrado na natureza não conseguiríamos fabricar nenhum objeto consistente, pois ele é mais maleável que a grande maioria dos metais. Mas se adicionarmos a ele a prata (Ag) e o cobre (Cu) formaremos uma ligação metálica, aumentando a dureza e permitindo sua utilização para fabricar joias, como anéis, pulseiras, relógios, etc.
Essa liga metálica é também conhecida por Ouro 18 quilates e apresenta 75% em massa de ouro e os outros 25% correspondem à prata e ao cobre.
Aumento da resistência mecânica: para fabricar materiais que tenham maior resistência ao manuseio, é preciso recorrer à ligação entre os metais. O aço, por exemplo, é formado por ferro (Fe) e carbono (C). Essa liga fica tão resistente que é usada na fabricação de peças metálicas que sofrem tração elevada. Exemplos:
Aço cirúrgico: é usado para a obtenção de instrumentos cirúrgicos, por apresentar alta resistência à oxidação.
Aço inox: é uma liga dos metais ferro (Fe), carbono (C), cromo (Cr) e níquel (Ni); é usada para fabricar talheres para cozinha, peças de carro, etc.
Assuntos Relacionados
-
BronzeConfira aqui qual a composição do bronze e onde ele é comumente utilizado.
- Camada de valênciaClique e entenda o que é a camada de valência e como determiná-la utilizando o diagrama de Linus Pauling ou a tabela periódica.
- Classificação das misturas heterogêneasConfira aqui como ocorre a classificação das misturas heterogêneas!
- Densidade – propriedade periódica dos elementosEntenda por que a densidade é considerada uma propriedade periódica dos elementos químicos.
- Descoberta da primeira partícula subatômica: o elétronA descoberta do elétron foi feita por J. J. Thomson, em 1897, por meio de um experimento com um tubo de raios catódicos.
- Distribuição Eletrônica no Diagrama de PaulingA distribuição dos elétrons de um átomo neutro pode ser feita em um Diagrama de Pauling, em ordem crescente de energia.
- Entendendo o núcleo atômicoSaiba mais sobre o corpo central do átomo.
- Estados físicos da matériaEstados físicos da matéria, estado sólido, estado líquido, estado gasoso, volume, temperatura, pressão, Força de Coesão, força de repulsão, forças de atração, partículas, átomos, substâncias.
- Exceções à Regra do OctetoObserve exemplos de compostos que são exceções à regra do octeto, tendo a capacidade de expandir ou contrair seu octeto.
- Íon-fórmulaAprenda a construir a fórmula que representa qualquer composto iônico, isto é, o chamado íon-fórmula!
- ÍonsClique aqui e entenda o que são os íons negativos e os íons positivos!
- Ligação CovalenteEntenda como ocorre a ligação covalente e como ela é representada por meio de fórmulas eletrônicas e estruturais.
- Ligação covalente dativaClique aqui e aprenda um pouco mais sobre a ligação covalente dativa!
- Ligação iônica e covalente: qual delas é polar?Aprenda a classificar um composto de acordo com sua polaridade.
- Ligação MetálicaConheça mais sobre as propriedades das ligações metálicas.
- Ligações QuímicasEntenda por que os átomos reagem entre si, originando as ligações químicas. Veja também o que diferencia as principais ligações, que são: ligação iônica, covalente e metálica.
- Ligações químicas entre elétrons de camadas internasVeja novos estudos que mostram a possibilidade de ligações químicas entre elétrons de camadas internas, o que vai contra as regras básicas da química.
- Nomenclatura dos óxidosClique e conheça as regras de nomenclatura utilizadas para realizar a nomenclatura de óxidos (iônicos e moleculares).
- Polaridade das moléculasAprenda neste texto como é simples determinar a polaridade das moléculas por meio das nuvens eletrônicas ou da soma dos vetores momento dipolar.
- Pressão parcial (Lei de Dalton)Conheça a Lei de Dalton que explica o que é considerado como sendo a pressão parcial dos gases em uma mistura, relacionando-as com a pressão total.
- Reações com hidretosClique e aprenda os princípios e como devemos proceder na montagem de equações que representam reações com hidretos.
- Regra do OctetoComo os átomos se ligam para atingir a estabilidade eletrônica?
- Segurança em laboratórioComo interpretar os símbolos de alerta em reagentes?
- TonoscopiaConheça as características da tonoscopia e aprenda como a pressão máxima de vapor de um solvente pode diminuir após a adição de um soluto não volátil.
- Vetor momento dipolar resultante em moléculasClique e aprenda por meio de vários exemplos a determinar o vetor momento dipolar resultante de uma molécula.
- Volume dos GasesEntenda por que o volume dos gases é sempre igual ao volume do recipiente, quais são as unidades de medida usadas nesse caso e como fazer suas conversões.



