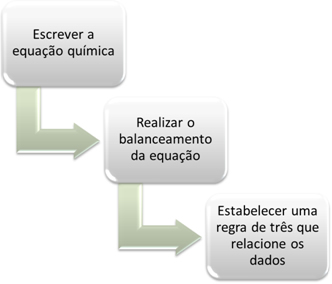
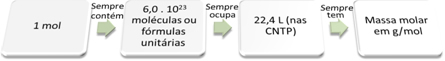
| DISCIPLINA: QUÍMICA – 1° SÉRIE – 1° BIMESTRE.
Transformações químicas na natureza e no sistema produtivo. |
Aula 1.Acordo Pedagógico.Seu ingresso no CURSO deve lhe representar uma nova fase de vida em relação a atitudes cada vez mais maduras, tanto nos estudos como em respeito ao próximo, solidariedade humana e cidadania. |
| O QUE PRECISO FAZER? Trazer o caderno do aluno em todas as aulas. Ler o texto em casa. Tentar responder às Questões durante a semana, Assistir vídeo aulas. Na sala de aula faremos discussão do texto e responder as questões do texto, se necessário tirar as dúvidas. |
| ESTRATÉGIASDesenvolve aulas a partir de um levantamento prévio do conhecimento dos alunos, solicita pesquisas sobre o tema para introduzir o conteúdo utilizando debates e discussões e interligando com questões do cotidiano, finalizando com exercícios de fixação. Interesse por mostrar ao aluno a utilização do conteúdo com o mercado de trabalho, ética e cidadania. Apoia suas aulas com textos, recursos áudio visuais, filmes, notícias, experimentos entre outros. |
| RECURSOSConteúdos retirados de livros didáticos, apostilas, pesquisas, vídeos, exemplos e experimentos.Análise de situações do cotidiano e suas relações com os conteúdos trabalhados.Livro Didático (Química na abordagem do cotidiano), Caderno do aluno.
AVALIAÇÃO |
| RECUPERAÇÕES DA APRENDIZAGEM O processo de recuperação da aprendizagem é realizado de maneira continua e imediata, explorando suas habilidades sobre os conteúdos ministrados no bimestre. Assim, findada a avaliação do processo ensino-aprendizagem, referente a cada situação didática, é efetuada a retomada dos processos dos conteúdos estudados para esclarecimento de eventuais e/ou pendentes dúvidas e, em seguida realizada uma nova avaliação do processo, utilizando-se desta vez, de distintos instrumentos nos quais são sempre considerados os avanços no aprendizado e o comprometimento por parte de discente, respeitando sua individualidade e seu tempo de aprendizagem por isso os alunos não são avaliados da mesma forma |
Aula 2-1 PRODUÇÃO E USO DE CAL Conteúdos e temas: produção e uso da cal.· Competências e habilidades: ler e compreender as informações referentes à produção da cal, bem como os fatores que nela influem.· Estratégias de ensino: levantamento das ideias dos alunos; leitura e discussão do texto e das questões para a interpretação do texto.· Recursos: Texto – Produção e uso da cal. Sugestão de avaliação: respostas às questões e participação na discussão do texto. |
Aula 3INTERAÇÕES E TRANSFORMAÇÕES· COMPETÊNCIA E HABILIDADES: Reconhecer a ocorrência de transformações químicas no dia a dia e no sistema produtivo, Empregar Corretamente A Linguagem Significativa Na Descrição De Uma Transformação Químicas.· ESTRATÉGIA DE ENSINO: Levantamento das ideias dos alunos; leitura e discussão do texto e das questões para interpretação do teto.· RECURSOS: Giz, lousa, texto, questões presentes no caderno do aluno.· AVALIAÇÃO: Resposta das questões e participação das discussões do texto. |
Aula 4-FATORES QUE PODEM SE ANALISADOS NAS TRANSFORMAÇÕES QUÍMICAS. Conteúdos e temas: transformações químicas; energia em processos endo/exotérmicos; tempo envolvido nas transformações; revertibilidade de algumas transformações.· Competências e habilidades: reconhecer a importância dos fatores tempo, energia e revertibilidade nas interações e transformações químicas que ocorrem no dia a dia e no sistema produtivo.· Estratégias de ensino: levantamento das ideias dos alunos; aula expositiva dialógica; experimento; problemas, questões abertas e questões de classificação.· Recursos: materiais e reagentes para realização do experimento. Sugestão de avaliação: respostas às questões e aos problemas e participação na discussão do experimento. |
Aula 5PRODUÇÃO DO ÁLCOOL COMBUSTÍVEL E DO FERRO· Conteúdos e temas: fermentação alcoólica; siderurgia do ferro; transformações químicas. Competências e habilidades: reconhecer no sistema produtivo a importância das transformações químicas e impactos ambientais ao meio ambiente.· Estratégias de ensino: levantamento das ideias dos alunos; leitura e discussão dos textos.· Recursos: Texto – Fermentação alcoólica na produção de etanol; Texto – A produção do ferro nas siderúrgicas. Avaliação: participação na discussão dos textos. |
Aula 6Semana-5 –COMO RECONHECER QUE HOUVE UMA TRANSFORMAÇÃO QUÍMICA QUANDO NÃO HÁ EVIDÊNCIAS. Conteúdos e temas: propriedades das substâncias – temperaturas de ebulição e fusão, densidade, solubilidade; importância das propriedades para caracterizar substâncias.· Competências e habilidades: empregar a linguagem química para representar transformações químicas; construir e interpretar tabelas e gráficos com dados de propriedades das substâncias.· Estratégias de ensino: levantamento das ideias dos alunos; leitura e discussão do texto e das questões para a interpretação do texto; atividade experimental; uso de objetos de aprendizagem (simulação).· Recursos: material para experimentos e textos. Sugestão de avaliação: atividades e questões propostas. |
Aula 7Semana-6 A NECESSIDADE DE SEPARAR MISTURAS E SUA IMPORTÂNCIA PARA O SISTEMA PRODUTIVO. Competências e habilidades: compreender os processos de separação das misturas ferro/escória no alto-forno e água/álcool aplicando as propriedades específicas estudadas na Situação de Aprendizagem 5. Sugestão de estratégias de ensino: leituras de textos orientadas por perguntas; pesquisa orientada e apresentações. Sugestão de recursos: Texto – A produção de álcool; Texto – Separação de ferro e escória no alto-forno.· Avaliação: respostas às perguntas e apresentação oral e escrita da pesquisa. |
Aula 8
|
Aula 9SemanaTempo previsto: 4 aulas– 7 COMBUSTÍVEIS: COMBUSTÃO NO DIA A DIA E NO SISTEMA PRODUTIVO.· Conteúdos e temas: uso de diferentes combustíveis; caloria; poder calorífico; reação de combustão.· Competências e habilidades: analisar dados referentes às massas e à energia envolvida na queima de combustíveis, estabelecendo relações de proporcionalidade entre essas duas grandezas.· Sugestão de estratégias de ensino: levantamento das ideias dos alunos; exposição dialogada.· Sugestão de recursos: lousa e giz; questões presentes neste Caderno. Sugestão de avaliação: respostas às questões e participação nas aulas. |
Aula 10
|
Aula 11Semana-9 IMPLICAÇÕES SOCIOAMBIENTAIS DA PRODUÇÃO E O USO DE COMBUSTÍVEIS.· Conteúdos e temas: problemas sociais e ambientais ligados à produção e ao uso de combustíveis; conceito operacional de ácido e base.· Competências e habilidades: selecionar, organizar, relacionar e interpretar dados e informações apresentados em textos, tabelas e gráficos referentes aos problemas socioambientais provenientes da produção e do uso de combustíveis (chuva ácida e efeito estufa) para tomar decisões e enfrentar situações-problema; relacionar informações obtidas por meio de observações diretas e de textos descritivos para construir argumentações consistentes num debate sobre desenvolvimento tecnológico e impactos socioambientais.· Sugestão de estratégias de ensino: levantamento das ideias dos alunos; leitura de textos; experimentos; debate; exposição dialogada.· Sugestão de recursos: lousa e giz; roteiros experimentais; textos e questões presentes neste Caderno; materiais e reagentes indicados nos roteiros dos experimentos. Sugestão de avaliação: respostas às questões e participação na aula; material escrito sobre o tema do debate Impactos AmbientaisOs minérios são indispensáveis para a manutenção da atividade industrial, tendo em vista que produtos como automóveis, máquinas, tratores, cimento, entre outros, são fabricados a partir de matérias-primas vindas dessa extração. No Brasil, os principais problemas oriundos da mineração podem ser englobados em quatro categorias: poluição da água, poluição do ar, poluição sonora, e subsidência do terreno. Em geral, a mineração provoca um conjunto de efeitos não desejados que podem ser denominados de externalidades. Algumas dessas externalidades são: alterações ambientais, conflitos de uso do solo, depreciação de imóveis circunvizinhos, geração de áreas degradadas e transtornos ao tráfego urbano. Estas externalidades geram conflitos com a comunidade, que normalmente têm origem quando da implantação do empreendimento, pois o empreendedor não se informa sobre as expectativas, anseios e preocupações da comunidade que vive nas proximidades da empresa de mineração.  Inicialmente, a mineração afeta a cobertura vegetal, em graus variados, desde a supressão total ou parcial na área a ser minerada, até a utilização de grandes volumes de água, em geral oriundas do próprio lençol freático, através de poços perfurados para trabalhos de estudos preliminares. A atividade de extração gera profundas alterações, modificando toda estrutura física e social do local onde está situada a mina e a região no entorno. O método de lavra é o mais utilizado na exploração das substâncias minerais e é um dos principais fatores determinantes do nível de impacto ao ambiente, tendo grande influência na modificação da paisagem e escasseamento de recursos naturais. A grande maioria dos bens minerais é lavrada por métodos tradicionais a céu aberto onde o comprometimento ambiental é muito grande. Nesse método de extração, para se ter um maior aproveitamento do minério, acaba-se gerando uma maior quantidade de estéril, poeira em suspensão, vibrações e maiores riscos de poluição das águas subterrâneas e superficiais. Minas a céu aberto elevam gradativamente a produção de rejeitos, os subprodutos da mineração ou lixo, resultantes da escavação e extração que não interessam a empresa mineradora e, portanto precisam ser descartados. Considerando que o objetivo da empresa é livrar-se dos rejeitos da forma menos onerosa possível, para tanto se necessita da criação de uma área de descarte adjacente à área de lavra, sacrificando ainda mais a vegetação existente no entorno da mina. A depender da posição geográfica das barragens, construídas para serem depositados os rejeitos, não são descartadas as possibilidades de vazamentos ou rompimentos, comprometendo significativamente todo o ambiente através da contaminação dos reservatórios de águas superficiais e subterrâneas. A má utilização da água por parte das grandes mineradoras tem gerado conflitos em função da inversão dos usos prioritários e por políticas públicas que suprimem a população local. As políticas públicas sempre vêm em benefício das grandes empresas, excluindo principalmente a população pobre. Comumente as indústrias mineradoras sugam grande parte da água através da perfuração de poços ou canalização de rios, limitando o uso para fins industriais negando sempre o uso humano e animal No Brasil, a extração de pedras preciosas ou semipreciosas é desenvolvida por uma atividade denominada de garimpo, nela são obtidos ouro, diamante, esmeralda, cassiterita e etc. A garimpagem geralmente é executada de forma tradicional nas margens de rios, em locais que recebem grande volume de sedimentação e em planícies fluviais, principalmente nas Bacias hidrográficas do Amazonas e do Paraguai. O garimpo mecanizado produz profundos impactos nos ambientes fluviais, destruindo as margens dos rios e modificando profundamente a paisagem. Sem contar que contamina as águas com aplicação de mercúrio e outros detritos; o prejuízo ambiental é muito elevado, pois os rios são assoreados, a fauna é contaminada, a cobertura vegetal é retirada e compromete a saúde do homem. Os danos gerados nas áreas onde são desenvolvidas a mineração ou garimpagem são irreversíveis. Diante desses fatos percebemos que a lucratividade oriunda da extração mineral fica nas mãos de uma minoria e os prejuízos ambientais para toda a população atual e também futura. Fonte. Geografia humana do Brasil http://https://www.youtube.com/watch?v=8sovsUzYZFM
|
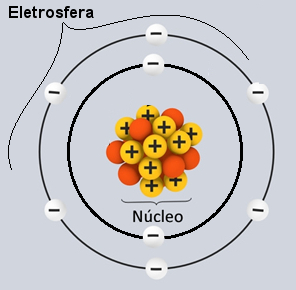
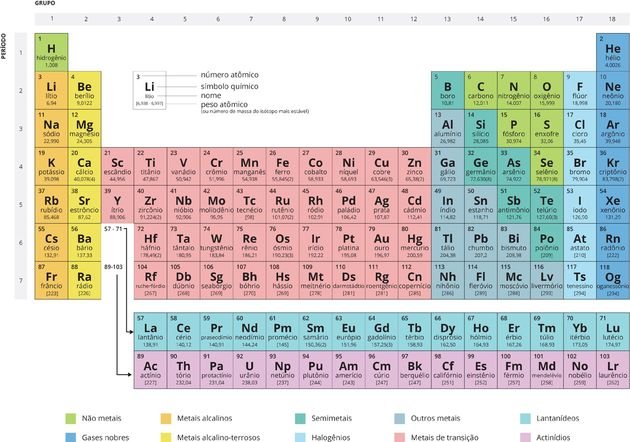
Aula 12Semana 20/08 a 06/09SITUAÇÃO DE APRENDIZAGEM 1 A LINGUAGEM QUÍMICA E A CONSTRUÇÃO HISTÓRICA DA TABELA PERIÓDICA A linguagem química: Símbolos e fórmulas Estrutura AtômicaOs átomos são partículas infinitamente pequenas que constituem toda matéria no universo. Ao longo do tempo, a ideia de como seria a estrutura atômica foi mudando de acordo com as novas descobertas feitas pelos cientistas. Você poderá saber mais sobre isso no texto Evolução do Modelo Atômico. Um modelo é uma representação da realidade (não a própria realidade), assim, os modelos atômicos são representações dos principais componentes do átomo e de sua estrutura e explicam determinados comportamentos físicos e químicos da matéria. Isso é feito porque ainda não é possível ao ser humano enxergar um átomo isolado nem mesmo com ultramicroscópios. Para se ter uma ideia do quanto o átomo é pequeno, saiba que a menor partícula visível em um microscópio comum contém mais de dez bilhões de átomos! O átomo é tão pequeno que, se colocássemos um milhão deles lado a lado, não atingiríamos a espessura de um fio de cabelo. Entre os modelos atômicos, o mais usado atualmente no Ensino Médio para o entendimento da estrutura do átomo e suas propriedades é o de Rutherford-Bohr. Segundo esse modelo, a estrutura do átomo é constituída de duas partes principais: o núcleo e a eletrosfera. Os átomos são partículas infinitamente pequenas que constituem toda matéria no universo. Ao longo do tempo, a ideia de como seria a estrutura atômica foi mudando de acordo com as novas descobertas feitas pelos cientistas. Você poderá saber mais sobre isso no texto Evolução do Modelo Atômico. Um modelo é uma representação da realidade (não a própria realidade), assim, os modelos atômicos são representações dos principais componentes do átomo e de sua estrutura e explicam determinados comportamentos físicos e químicos da matéria. Isso é feito porque ainda não é possível ao ser humano enxergar um átomo isolado nem mesmo com ultramicroscópios. Para se ter uma ideia do quanto o átomo é pequeno, saiba que a menor partícula visível em um microscópio comum contém mais de dez bilhões de átomos! O átomo é tão pequeno que, se colocássemos um milhão deles lado a lado, não atingiríamos a espessura de um fio de cabelo. Entre os modelos atômicos, o mais usado atualmente no Ensino Médio para o entendimento da estrutura do átomo e suas propriedades é o de Rutherford-Bohr. Segundo esse modelo, a estrutura do átomo é constituída de duas partes principais: o núcleo e a eletrosfera.
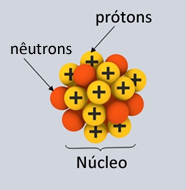
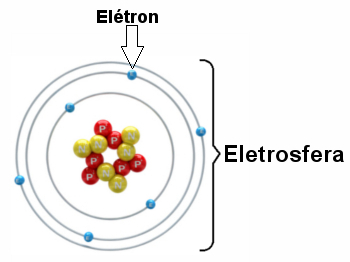
A estrutura atômica é composta por três partículas fundamentais: prótons (com carga positiva), nêutrons (partículas neutras) e elétrons (com carga negativa). Toda matéria é formada de átomo sendo que cada elemento químico possui átomos diferentes. A eletricidade chega às nossas casas através de fios e da movimentação de partículas negativas que fazem parte dos elétrons, que circulam pelos fios.
No núcleo de um átomo estão os prótons e os nêutrons e, girando em torno desse núcleo, estão os elétrons. Cada núcleo de um determinado elemento químico tem o mesmo número de prótons. Esse número define o número atômico (Z) identifica um elemento e determina sua posição na tabela periódica. PrótonsO próton é uma partícula fundamental na estrutura atômica. Juntamente com os nêutrons, forma todos os núcleos atômicos, exceto para o hidrogênio, onde o núcleo é formado de um único próton. A massa de um átomo é a soma das massas dos prótons e nêutrons. Como a massa do elétron é muito pequena (tem cerca de 1/1836,15267377 da massa do próton), ela não é considerada. A massa do átomo é representada pela letra (A). O que caracteriza um elemento é o número de prótons do átomo, conhecido como número atômico do elemento. É representado pela letra (Z). O número da massa (A) do átomo é formado pela soma do número atômico (Z) com o número de nêutrons (N), ou seja, A = Z + N. NêutronsO nêutron são partículas neutras que fazem parte da estrutura atômica dos átomos, juntamente com os prótons. Ele tem massa, mas não tem carga. A massa é muito parecida com a do próton. O nêutron se localiza na porção central do átomo (núcleo). Para se calcular a quantidade de nêutron que um átomo possui basta fazer a subtração entre o número de massa (A) e o número eletrônico (Z). ElétronsO elétron é uma partícula subatômica que circunda o núcleo atômico, sendo responsável pela criação de campos magnéticos elétricos. Um próton na presença de outro próton se repele, o mesmo ocorre com os elétrons, mas entre um próton e um elétron existe uma força de atração. Dessa maneira atribui-se ao próton e ao elétron uma propriedade física denominada carga elétrica. Os elétrons dos átomos giram em órbitas específicas e de níveis energéticos bem definidos. Sempre que um elétron muda de órbita, um pacote de energia seria emitido ou absorvido. Essa teoria envolve conhecimentos da mecânica quântica e estes pacotes de energia são chamados quantum. Fonte http://www.todamateria.com.br/fisica-quantica/ Leia também: Isótopos, isóbaros e isótonos. São conhecidos atualmente mais de 100 elementos químicos. Cada um deles tem um nome e um símbolo diferente.
Os símbolos são a representação dos elementos químicos.
São formados por uma, duas ou três letras. A primeira é sempre maiúscula e a segunda, é sempre minúscula. O símbolo de um elemento vem de uma ou duas letras tiradas de seu nome em latim. Por causa disso, nem todos os símbolos têm relação lógica com o nome do elemento em português.
Os que têm três letras não têm nomes oficiais, atribuídos pela Iupac (União Internacional de Química Pura e Aplicada). Fórmulas Todas as substâncias são formadas por átomos. As substâncias simples são formadas por átomos de um único elemento e as substâncias compostas são formadas por átomos de dois ou mais elementos diferentes.
As moléculas são as menores unidades que apresentam a composição característica de uma substância. As moléculas são formadas pela união de dois ou mais átomos.
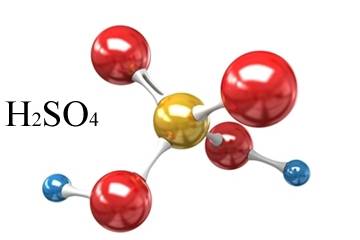
Para representar graficamente as moléculas de uma substância, seja ela simples ou composta, os químicos utilizam fórmulas. A fórmula da água é H2O. Outras fórmulas usadas pelos químicos são CO2 (gás carbônico), N2(gás nitrogênio), O2 (gás oxigênio), O3 (gás ozônio), C2H6O (etanol), C6H12O6 (glicose), NH3 (amônia) eH2SO4 (ácido sulfúrico).
Na fórmula de uma substância são colocados os símbolos dos elementos que tornam parte de sua composição e os índices de atomicidade (ou, simplesmente, atomicidade), que indicam a proporção em que os átomos do elemento estão presentes na substância. Se o índice de atomicidade não for escrito, é porque seu valor é 1. Fonte: Caderno do Professor: Ciências, Ensino Fundamental – 9º Ano, Volume 1. São Paulo: SEE, 2009. Duas partes principais da estrutura de um átomo – eletrosfera e núcleo * Núcleo: Constituindo-se como a parte central do átomo, ele é compacto, maciço e muito denso, além de ser formado pelas partículas de maior massa, que são os prótons e os nêutrons.
– Prótons: são partículas de carga elétrica positiva (carga relativa = +1; carga em coulomb (C) = +1,602 . 10-19) e a sua massa relativa é igual a 1. O fato de que os prótons formam o núcleo e dão a ele uma carga total positiva foi descoberto por Eugen Goldstein, em 1886, através de uma modificação na ampola de Crookes e alguns experimentos. Ele viu que, sob voltagens elevadíssimas, apareciam emissões (raios anódicos – restos de átomos do gás que estavam dentro da ampola e que tiveram seus elétrons arrancados pela descarga elétrica). Ao colocar um campo elétrico ou magnético externo à ampola, esses raios eram desviados no sentido do polo negativo. Isso significava que existiam partículas subatômicas positivas, que foram chamadas de prótons. Mais tarde, Ernest Rutherford (1871-1937) realizou o experimento descrito no texto O átomo de Rutherford, que o levou à descoberta da localização do próton: no núcleo. – Nêutrons: são partículas de massa igual à dos prótons (1), mas como o próprio nome indica, eles são neutros, ou seja, não possuem carga elétrica. Os nêutrons foram descobertos, em 1932, por James Chadwick (1891-1974), que percebeu que o núcleo do berílio radioativo emitia partículas neutras com a massa praticamente igual à massa dos prótons (na verdade, O diâmetro do núcleo depende da quantidade de prótons e nêutrons que o átomo possui, mas, em média, fica em torno de 10-14 m e 10-15 m. O núcleo atômico concentra praticamente toda a massa do átomo, sendo uma parte muito pequena mesmo: tanto o próton como o nêutron são cerca de 100 mil vezes menores do que o próprio átomo inteiro! A título de comparação, imagine que aumentássemos o núcleo do átomo do elemento hidrogênio (que possui somente um próton) até o tamanho de uma bola de tênis, o elétron mais próximo ficaria a uns três quilômetros de distância! Mesmo se um átomo fosse aumentado até ficar da altura de um prédio de 14 andares, seu núcleo seria do tamanho de um mero grão de sal no sétimo andar. É realmente algo espantoso, não acha?! * Eletrosfera: É uma região onde os elétrons ficam girando ao redor do núcleo. Apesar de ser uma região de volume muito maior que o do núcleo, ela é praticamente vazia, pois cada elétron é 1836 vezes menor que 1 próton (ou que 1 nêutron). É por isso que a massa do átomo concentra-se praticamente toda no núcleo. Os elétrons são partículas de carga elétrica negativa (-1). Os elétrons foram descobertos, em 1897, por Joseph John Thomson (1856-1940), o criador do modelo atômico de Thomson. O experimento de Thomson pode ser visto em detalhes no texto O experimento de Thomson com descargas elétricas, mas, de forma resumida, ele usou a ampola de Crookes já mencionada e percebeu que os raios catódicos eram sempre atraídos pelo polo positivo, o que provava que o átomo possuia partículas negativas, que foram chamadas de elétrons. Os elétrons giram ao redor do núcleo bilhões de vezes por milionésimo de segundo, dando forma ao átomo e fazendo-o comportar-se como se fosse sólido.
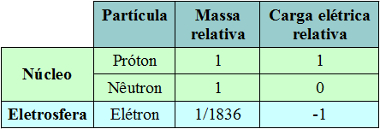
Resumidamente, podemos fazer uma tabela para diferenciar as três partículas subatômicas principais que fazem parte da estrutura do átomo:
Os átomos de todos os elementos químicos são compostos por essas três partículas subatômicas. O que difere um elemento químico de outro é a quantidade em que essas partículas aparecem, principalmente a quantidade de prótons no núcleo, que é chamada de número atômico. Continue estudando sobre isso por meio do texto Elemento Químico. Por Jennifer Fogaça FOGAçA, Jennifer Rocha Vargas. “Estrutura do Átomo”; Brasil Escola. Disponível em <https://brasilescola.uol.com.br/quimica/estrutura-Atomo.htm>. Acesso em 25 de agosto de 2018. Assista às nossas videoaulas
Teste seus conhecimentos
Questão 1
No ano de 2032, comemoraremos a descoberta do nêutron, partícula localizada no interior do núcleo do átomo cuja principal função é estabilizá-lo por meio da diminuição da força de repulsão entre os elétrons. Entre os cientistas citados a seguir, qual deles foi o descobridor do nêutrons? a) R. A. Millikan b) E. Rutherford c) J. Chadwick d) J.J. Thomson e) C. Goldstein Aula 14
|











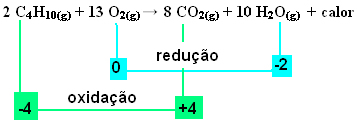


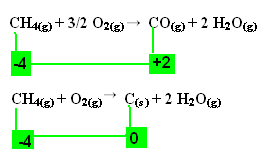
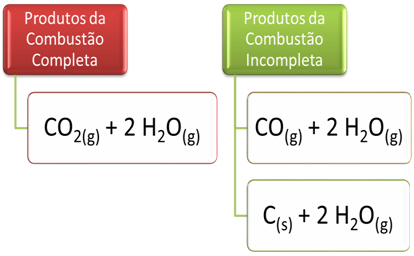 .
.