Roteiro semanal EJA 1 Série
Aula 1
Caro Aluno: Seja bem-vindo ao curso de Química.
Acordo Pedagógico.
Seu ingresso no CURSO deve lhe representar uma nova fase de vida em relação a atitudes cada vez mais maduras, tanto nos estudos como em respeito ao próximo, solidariedade humana e cidadania.“Amarás ao teu próximo como a ti mesmo” Respeito Mútuo é o principal compromisso ético que todo ser humano deve assumir é o de tratar as pessoas como pessoas, procurando entender o ponto de vista do outro mesmo que não esteja de acordo com seus princípios e teorias.
O intuito é ajudar crianças e adolescentes a aprenderem a aprender, a buscarem o desenvolvimento a serem protagonistas da própria aprendizagem como ser integral e vislumbrarem suas potencialidades de ação social.
Não seja vítima da sua própria história! Não espere que alguém faça por você aquilo que só você pode fazer; escrever a sua história. Não seja manipulado por discursos políticos que promovem o coitadismo e por isso merecem uma recompensa do Estado.
Nossa recompensa é o fruto que colhemos. A colheita é consequência do que plantamos. Nada funciona de forma diferente, se você plantar e perseverar, você vai colher.
Visando manter a necessária organização em todos os momentos dentro do Curso e, em nome do clima de cooperação e amizade que deve imperar entre todos, solicitamos sua atenção para que sejam rigorosamente observadas as seguintes normas:
Procure adotar uma postura ativa e não passiva na aprendizagem, para que tenha um ótimo aproveitamento escolar. É isso que todos os professores esperam de você: seu interesse, esforço, determinação e comprometimento.
É tempo de descobrir, conhecer, questionar. Entretanto procure ser sempre cooperativo com sua equipe e amigo de seus professores; cultive o bom-humor e disposição à aprendizagem. Essa é a base de sua formação de atitudes em direção à vida adulta, sejam quais forem seus cursos e especializações (não importa a área). Desejamos a você muito sucesso nesta jornada que se inicia!
Sabemos quanto é difícil para quem trabalha ou procura um emprego se dedicar aos estudos, principalmente quando se parou de estudar há algum tempo. No entanto os estudantes jovens e adultos têm experiências pessoais que devem ser consideradas no processo de aprendizagem. Trata-se de um conjunto de experiências, conhecimentos e convicções que se formou ao longo da vida. Dessa forma, procuramos respeitar a trajetória daqueles que apostaram na educação como o caminho para a conquista de um futuro melhor. Esperamos que você conclua o Ensino Médio e, posteriormente, continue estudando e buscando conhecimentos importantes para seu desenvolvimento e sua participação na sociedade.
Afinal, o conhecimento é o bem mais valioso que adquirimos na vida e o único que se acumula por toda a nossa existência.
“A educação é a arma mais poderosa para mudar o mundo, a educação liberta, quem estuda não aceito ser escravo” Nelson Mandela
O QUE PRECISO FAZER?
Estudar trazer o caderno do aluno em todas as aulas. Ler o texto em casa. Tentar responder às Questões durante a semana, Assistir vídeo aulas. Na sala de aula faremos discussão do texto, tiraremos as dúvidas e responderemos as questões do texto, veja as dicas no Blog de como estudar, Lembre-se estudar é em casa, na sala de você assisti aula!
ESTRATÉGIAS
Desenvolve aulas a partir de um levantamento prévio do conhecimento dos alunos, solicita pesquisas sobre o tema para introduzir o conteúdo utilizando debates e discussões e interligando com questões do cotidiano, finalizando com exercícios de fixação. Interesse por mostrar ao aluno a utilização do conteúdo com o mercado de trabalho, ética e cidadania. Apoia suas aulas com textos, recursos áudio visuais, filmes, notícias, experimentos entre outros.
RECURSOS
Conteúdos retirados de livros didáticos, apostilas, pesquisas na internet, vídeos, exemplos e experimentos.Análise de situações do cotidiano e suas relações com os conteúdos trabalhados.Livro Didático (Química na abordagem do cotidiano), Caderno do aluno.
AVALIAÇÃO
• Todas as atividades desenvolvidas pelos estudantes serão avaliadas no processo de aprendizagem: O sistema de avaliação está fundamentado numa concepção formativa, valorizando a efetiva aprendizagem qualitativa e não apenas a obtenção de notas. Processa-se de forma contínua, pois o professor acompanha o desenvolvimento do aluno através da verificação dos resultados obtidos, utilizando múltiplos instrumentos de avaliação.
• 50% (Avaliação atitudinal): responsabilidade, pontualidade, participação em aula, tarefas de casa, comprometimento, empenho em aprender, respeito e tolerância às limitações dos colegas, disciplina, cooperação, frequência, caderno, apostila, trabalhos, participação em projetos.
• 50% (Avaliação conceitual): exercícios de fixação e atividades toda aula é avaliada.
RECUPERAÇÕES DA APRENDIZAGEM
O processo de recuperação da aprendizagem é realizado de maneira continua e imediata, explorando suas habilidades sobre os conteúdos ministrados no bimestre. Assim, findada a avaliação do processo ensino-aprendizagem, referente a cada situação didática, é efetuada a retomada dos processos dos conteúdos estudados para esclarecimento de eventuais e/ou pendentes dúvidas e, em seguida realizada uma nova avaliação do processo, utilizando-se desta vez, de distintos instrumentos nos quais são sempre considerados os avanços no aprendizado e o comprometimento por parte de discente, respeitando sua individualidade e seu tempo de aprendizagem por isso os alunos não são avaliados da mesma forma
CONTEÚDOS DO SEMESTRE:
TEMA 1- CONSTITUIÇÃO DA MATÉRIA TEMA
TEMA 2- PROPRIEDADES DA MATÉRIA TEMA
TEMA 3 – TRANSFORMAÇÃO FÍSICA E QUÍMICA
TEMA 4 – PROPRIEDADES DAS SUBSTÂNCIAS QUÍMICAS
TEMA 5 – TIPOS DE MISTURA
TEMA 6 – SEPARAÇÃO DE MISTURAS
TEMA 7- ESTRUTURA DA MATÉRIA SIMBOLOGIA QUÍMICA
TEMA 8– TABELA PERIÓDICA-
TEMA 9– REAÇÕES DE COMBUSTÃO
Estes temas são para pesquisar e fazer o resumo no caderno, no final dos temas responder as questões no caderno demonstrando os cálculos. Esta atividade é para fixação e compreensão dos conceitos para que seja possível a avaliação do conhecimento adquirido ao longo do estudo do tema.
No final de cada tema faça no caderno um resuma das idéias principais do texto, responda as questões no caderno, demonstrando os cálculos, de preferência a caneta, vou deixar assim que possível um gabarito das questões, na sala de aula você me diz quantas questões acertou.
Esta atividade é para fixação e compreensão dos conceitos para que seja possível a avaliação do conhecimento adquirido ao longo do estudo do tema.
Bons estudos!!!
Química Introdução
Historicamente, o homem primitivo começa a perceber as transformações químicas com o domínio do fogo. Naturalmente observou que a madeira ao ser queimada se transformava em cinzas, que as rochas do solo chegavam a se fundir, tomando uma aparência mais resistente. Com o domínio de produzir o fogo o homem primitivo passou a tirar vantagens, afugentando as feras, não tendo medo da escuridão e também, nas regiões mais frias as noites passaram a ser mais quentes (devido ao calor liberado pela combustão). Nota-se, que esse conhecimento proporciona mais segurança e gera um crescimento da espécie humana devido a melhor condição de vida. A utilização do fogo trouxe vários benefícios sendo, um deles, o cozimento dos alimentos diminuindo a contaminação por bactérias que eram responsáveis por muitas doenças da época primitiva. Essas mudanças proporcionaram melhores condições de vida, além do crescimento populacional da época.Com o domínio de produzir o fogo o homem primitivo passou a tirar vantagens, afugentando as feras, não tendo medo da escuridão e também, nas regiões mais frias as noites passaram a ser mais quentes (devido ao calor liberado pela combustão).
Mais segurança. O cozimento dos alimentos diminuiu a contaminação por bactérias que eram responsáveis por muitas doenças da época primitiva.Melhorou a condição de vida. Maior crescimento populacional da época.
Os recipientes de barro (argila) tiveram transformação ao serem levados ao fogo, adquirindo uma resistência em sua superfície, beneficiando utensílios para o preparo dos alimentos.
O domínio dos recursos naturais, como as ligas metálicas (bronze, latão, aço, etc.) geram o conhecimento sobre a metalurgia e siderurgia, e assim outras áreas do conhecimento vão surgindo.
O desenvolvimento da civilização foi surgindo à medida que suas habilidades nas transformações da matéria foram sendo aperfeiçoadas, como: o vidro, as joias, as moedas, as cerâmicas e inevitavelmente as armas mais resistentes e eficazes.
A liga de aço acelerou um profundo impacto da química sobre a sociedade. Assim, a força muscular foi sendo substituída por máquinas. Com meios de transporte melhores e maior produtividade das fábricas, o comércio e o mundo se transformam, simultaneamente.
Em casa, no trabalho, no lazer ou em qualquer lugar está ocorrendo transformações da matéria, como a situação de preparar um simples café, chá ou mesmo a dissolução de um suco em pó na água.
O fato de nós suarmos, respirarmos, digerirmos, pensarmos, raciocinarmos, ou seja, sobrevivermos nos leva a muita transformação química.Fonte http://blogdequimicaeja.blogspot.com/2017/
Aula 2
TEMA 1- CONSTITUIÇÃO DA MATÉRIA TEMA
A composição do Universo

De que é composto o Universo? Essa pergunta é curiosa e ao mesmo tempo comum, afinal o que compõe as estrelas, a água, a terra, os seres humanos e tudo que os cerca? Tudo provém da matéria e a matéria é constituída de átomos. Sobre o núcleo atômico sabe-se que é constituído de prótons e nêutrons, aliás, essa teoria existe desde o ano de 1932, já nessa época defendia-se a ideia do átomo ser indivisível e recebeu a denominação de partícula fundamental.
Foram necessários vários anos de estudo para se chegar a essa concepção de átomo, e atualmente se faz importante o conhecimento da teoria atômica para entender a tecnologia presente o tempo todo em nossas vidas como, por exemplo, aparelhos eletrodomésticos como o forno microondas, a televisão, esses aparelhos possuem seus princípios de funcionamento baseados no átomo.
Os átomos possuem a propriedade de se agregar com outros átomos e compor diferentes materiais, é simples! Quando um átomo se junta com outro átomo logo surgem as moléculas, e essas por sua vez podem se unir a outras moléculas dando origem a moléculas cada vez maiores, até que se chegue no produto final: a composição da matéria.
Para um melhor entendimento acompanhe o seguinte raciocínio:
O ouro é uma matéria, mas se ele é usado para se obter uma jóia, esse produto será considerado um objeto. Assim também acontece com a madeira, é uma matéria que dá origem a diferentes objetos: cadeiras, mesas, etc.
E é basicamente assim que é formado tudo que vemos ao nosso redor, e esse conceito vai mais além, faz parte da composição do que não temos contato, como as estrelas, a lua, o sol, enfim, o átomo compõe o Universo.
Todas as coisas que compõem o universo são constituídos de matéria e energia. A matéria e a energia caminham juntas, pois se não existisse matéria não existiria energia e, não existindo energia não teríamos a matéria.
 Matéria – é tudo aquilo que tem massa e ocupa lugar no espaço.
Matéria – é tudo aquilo que tem massa e ocupa lugar no espaço.
Algumas formas de energia são térmica, solar, eólica, sonora, energia mecânica, elétrica e química, cinética, potencial, magnética, nuclear.Todas as formas podem converter-se umas nas outras, no entanto, a energia total do sistema permanece sempre constante. A matéria tem duas características fundamentais: possui massa e ocupa lugar no espaço. Lembre-se que “ocupar lugar no espaço” é sinônimo de dizermos “tem volume”. Assim, massa e volume são coisas que tudo que é material tem. A matéria é formada por pequeníssimas partículas que chamamos de átomos; essas partículas podem se unir e formar o que chamamos de moléculas.
Corpo é qualquer porção limitada da matéria.Objeto é uma porção limitada de matéria quer por sua forma especial ou por sua (utilidade).
 Massa é a quantidade de matéria que um corpo possui, sendo, portanto, constante em qualquer lugar da terra ou fora dela.Peso de um corpo é a força com que esse corpo é atraído (gravidade) para o centro da terra. Varia de acordo com o local em que o corpo se encontra. Por exemplo: A massa do homem na Terra ou na Lua tem o mesmo valor. O peso, no entanto, é seis vezes maior na terra do que na lua.Explica-se esse fenômeno pelo fato da gravidade terrestre ser 6 vezes superior à gravidade lunar. Obs: A palavra grama, empregada no sentido de “unidade de medida de massa de um corpo”, é um substantivo masculino. Assim 200 g, lê-se “duzentos gramas”.
Massa é a quantidade de matéria que um corpo possui, sendo, portanto, constante em qualquer lugar da terra ou fora dela.Peso de um corpo é a força com que esse corpo é atraído (gravidade) para o centro da terra. Varia de acordo com o local em que o corpo se encontra. Por exemplo: A massa do homem na Terra ou na Lua tem o mesmo valor. O peso, no entanto, é seis vezes maior na terra do que na lua.Explica-se esse fenômeno pelo fato da gravidade terrestre ser 6 vezes superior à gravidade lunar. Obs: A palavra grama, empregada no sentido de “unidade de medida de massa de um corpo”, é um substantivo masculino. Assim 200 g, lê-se “duzentos gramas”.
Fonte: Material de apoio ao currículo do Estado de São Paulo: Caderno do Professor, Química, Ensino fundamental, Ensino Médio, 1ª Série. São Paulo: SE, 2014
http://blogdequimicaeja.blogspot.com/2017/
Aula 3
TEMA 2- PROPRIEDADES DA MATÉRIA
Para executar determinada atividade em casa ou no trabalho, você precisa escolher a ferramenta certa. Para varrer a casa, uma vassoura ajuda muito mais do que, por exemplo, um pincel ou uma escova de dentes. Isso porque a vassoura tem propriedades, como tamanho das cerdas e comprimento do cabo, mais adequadas à aplicação que se tem em mente.
Com as substâncias químicas, acontece o mesmo. Ao preparar uma tinta para pintar paredes, por exemplo, um químico precisa escolher substâncias com propriedades indicadas a essa aplicação, como cor, odor, viscosidade e tempo de secagem. Portanto, as escolhas que você faz dependem das propriedades (químicas e físicas) que as substâncias possuem.
São essas propriedades que caracterizam as substâncias, ou seja, que permitem diferenciá-las e identificá-las. Da mesma maneira que você distingue uma pessoa a distância por suas características físicas, como altura, cor dos cabelos etc., pode-se identificar uma substância conhecendo suas propriedades químicas e físicas. Nenhuma substância tem o mesmo conjunto de propriedades de outra. Na Química, três propriedades físicas se destacam: a temperatura de fusão,a temperatura de ebulição e a densidade.
Temperaturas de fusão e de ebulição
Você já estudou, no Ensino Fundamental, que as substâncias podem se apre- sentar em três estados físicos: o sólido, como o sal de cozinha; o líquido, como o álcool; ou o gasoso, como o gás oxigênio. Em nosso planeta a água é encontrada nesses três estados físicos; além disso, essa substância passa de um estado físico para outro naturalmente, isto é, sem a intervenção direta dos seres humanos.
As mudanças de estado físico de qualquer substância recebem os nomes indi- cados no diagrama a seguir.
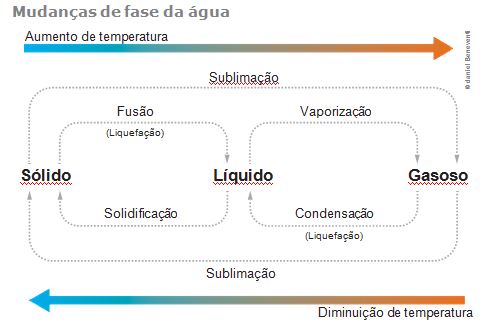
Fusão é a passagem do estado sólido para o líquido, e a do estado líquido para o sólido é a solidificação.
Vaporização é a passagem do estado líquido para o gasoso,e a do estado gasoso para o líquido é a condensação.
Sublimação é a mudança do estado físico sólido para o gasoso, como ocorre com o gelo seco (gás carbônico sólido); também é o nome dado ao processo inverso, ou seja, a passagem do estado gasoso para o sólido, como quando os vapores da naftalina encontram uma superfície fria.
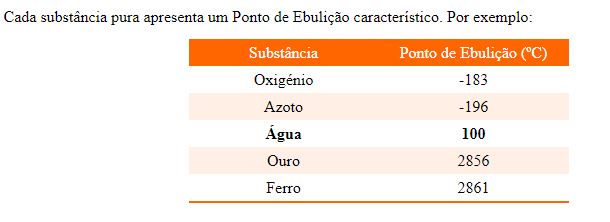
A temperatura em que uma substância sofre fusão e aquela em que há vaporização por ebulição são características de cada substância, portanto, importantes para identificá-las.
Para o estudo das temperaturas de ebulição e fusão, acompanhe a construção de um gráfico de temperatura versus tempo de aquecimento de uma amostra de água no estado sólido até chegar ao estado gasoso.
Mudanças de Estado Físico
O que caracteriza e define um estado físico da matéria são as forças atuantes em seu interior; coesão, a qual tende a aproximar as partículas, e repulsão, a qual tende a afastá-las. Quando a força de coesão supera a de repulsão, a substância se apresentará na fase de agregação chamada de sólido, quando as forças apresentarem a mesma intensidade, teremos um líquido, quando a de repulsão superar a de coesão, teremos então um gás.
Cada um desses estados físicos distingue-se dos outros, entre outros fatores, por sua forma e volume. O estado sólido apresenta forma e volume constante, o líquido forma variável e volume constante, e o gasoso, forma e volume variáveis.
Na fase de agregação sólida, as partículas não apresentam liberdade de movimento, cabendo-lhes apenas movimentos de ordem vibracional, e a matéria terá maior densidade molecular. No estado líquido, as partículas podem literalmente “rolar” umas sobre as outras. Já na fase gasosa, as partículas terão ampla liberdade de movimento, e a matéria estará em sua fase de menor densidade molecular possível.
A matéria pode apresentar-se em qualquer estado físico, dependendo dos fatores pressão e temperatura. Assim, de modo geral, o aumento de temperatura e a redução de pressão favorecem o estado gasoso, e pode-se dizer que o inverso favorece ao estado sólido.
As transformações de estado físico da matéria apresentam denominações características, como se pode ver abaixo:
a) FUSÃO: representa a passagem do estado sólido para o estado líquido. A temperatura na qual ocorre recebe o nome de Ponto de Fusão. Por exemplo, o derretimento de um cubo de gelo.
b) VAPORIZAÇÃO: representa a passagem do estado líquido para o estado gasoso. A temperatura na qual ocorre recebe o nome de Ponto de Ebulição. Uma vaporização pode ocorrer de três modos distintos:
 C – CALEFAÇÃO: passagem do estado líquido para o gasoso de modo muito rápido, quase instantâneo. Por exemplo, gotas de água sendo derramadas em uma chapa metálica aquecida.
C – CALEFAÇÃO: passagem do estado líquido para o gasoso de modo muito rápido, quase instantâneo. Por exemplo, gotas de água sendo derramadas em uma chapa metálica aquecida.
– EBULIÇÃO:passagem do estado líquido para o estado gasoso por meio de aquecimento direto, envolvendo todo o líquido. Por exemplo, o aquecimento da água em uma panela ao fogão.
– EVAPORAÇÃO:passagem do estado líquido para o estado gasoso que envolve apenas a superfície do líquido. Por exemplo, a secagem de roupas em um varal.
c) LIQUEFAÇÃO ou CONDENSAÇÃO: representa a passagem do estado gasoso para o estado líquido. Por exemplo, a umidade externa de um frasco metálico ao ser exposto a uma temperatura relativamente elevada.
d) SOLIDIFICAÇÃO:representa a passagem do estado líquido para o estado sólido. Por exemplo, o congelamento da água em uma forma de gelo levada ao refrigerador.
e)SUBLIMAÇÃO:representa a passagem do estado sólido para o estado gasoso ou o processo inverso, sem passagem pelo estado líquido. Por exemplo, a sublimação do gás carbônico sólido, conhecido por gelo seco, em exposição à temperatura ambiente.
Material de apoio ao currículo do Estado de São Paulo: Caderno do Professor, Química, Ensino Médio. São Paulo: SE, 2014
Fonte:
http://blogdequimicaeja.blogspot.com/2017/
Aula 4
TEMA 3 – Transformações Físicas
A matéria que nos rodeia está em constante mudança, sofrendo inúmeras transformações. Um copo que parte, uma floresta que arde, o gelo das calotas polares que funde, tudo isto são exemplos de transformações que ocorrem todos os dias. Estas transformações podem ser Físicas ou Químicas.
Transformações Físicas
As transformações físicas da matéria ocorrem quando há por exemplo mudança de estado físico de um determinado material ou uma dissolução de um soluto num solvente. Neste tipo de transformação, não há formação de novas substâncias. É exemplo de uma Transformação Física…



Aula 5
Mudanças de estado físico da matéria
Influência da temperatura e da pressão nas mudanças de estados físicos.
Passando pelos processos de fusão e vaporização e a sublimação é necessário aquecer o material.
Esse aquecimento aumenta a agitação das partículas.
Ocorre o aumento da temperatura e absorção de calor.
Processo chamado de Endotérmico.
As substâncias podem mudar de estado físico (sólido, líquido, gasoso).
O que diferencia essas substâncias em cada estado físico são as disposições e a agitação das moléculas.
É possível mudar o estado físico de uma substância provocando afastamento e aproximação de suas moléculas, o que é conseguido por meio de alterações na temperatura ou na pressão.
As mudanças de um estado físico para outro recebem denominações específicas
Passando pelos processos de solidificação, condensação e ressublimação é necessário reduzir a temperatura do material.
Essa redução da temperatura diminui a agitação das moléculas.
Ocorre diminuição da temperatura e liberação de calor.
Processo denominado Exotérmico.
Pressão atmosférica: Toda a massa de ar existente que exerce uma força sobre tudo o que está na superfície da Terra.
Ao nível do mar, a pressão atmosférica atinge o seu valor máximo, que corresponde a 1 atm.
Todas as temperaturas de ebulição e fusão citadas foram consideradas ao nível do mar.
O que acontece no processo de ebulição da água?
As moléculas recebem energia em forma de calor e assim agitam-se mais e “escapam” para a atmosfera.
Se a pressão que atua no líquido diminui, as moléculas se desprendem com mais facilidade, ou seja, com menor grau de agitação, reduzindo a temperatura de ebulição.
SÓLIDO
No estado sólido, as partículas encontram-se muito próximas e unidas por intensas forças de ligação. Elas vibram em posições fixas. Forma e volume constantes e definidos. Permite pouca compressibilidade.
LÍQUIDO
As partículas estão mais afastadas uma das outras, reduzindo as forças de ligação que as mantém unidas. Estão mais livres e se movem com facilidade. Forma variável (recipiente), Volume constante
GASOSO
As partículas encontram-se muito afastadas umas das outras e são praticamente livres. Se movimentam rapidamente em todas as direções e sentidos. A forma e volume são variáveis (de acordo com o recipiente).
Transformações Químicas
Antes de começar o estudo deste tema, reflita a respeito do que você já sabe sobre transformações químicas. Para isso, pense nas seguintes questões:
Quando um objeto metálico enferruja, ele passa a ter certas características diferentes do Reflita sobre algumas dessas características: elas evidenciam que ocorreu uma transformação química?
Como você reconhece que um alimento está podre ou impróprio para o consumo? Quais características dele se altera
As Transformações Químicas ocorrem sempre que há formação de novos materiais, ou seja, a partir dos materiais iniciais formam-se outros materiais diferentes. Ocorre uma transformação química quando…
… se forma um sólido de cor diferente;
… há mudança de cor da solução;
… se forma um gás;
… há variação de temperatura do sistema;
… as substâncias iniciais desaparecem;
… se origina um cheiro característico.
São Exemplos de Transformações Químicas…
… a Respiração Celular que ocorre nos seres vivos;
.. a Fotossíntese realizada pelas plantas;

… cozinhar os alimentos;

… o fogo de artifício.

Evidências da ocorrência de uma transformação química
Até agora, você viu alguns exemplos de transformações físicas, como as que ocorrem durante uma mudança de estado físico ou a separação dos componentes de uma mistura. O que ocorre de especial em uma transformação química?
Você já deve ter tomado algum remédio na forma de pastilha efervescente. Quando a pastilha é adicionada à água, pode-se observar a liberação de um gás. Esse gás não estava lá antes do contato entre a pastilha e a água,o que indica que ele é uma substância nova que se formou no sistema.

Agora, acompanhe uma observação experimental. Em um laboratório, um químico adicionou uma so- lução aquosa incolor de nitrato de chumbo a uma solução também incolor de iodeto de potássio (veja a figura na página seguinte). Imediatamente, surgiu a geração de gás é uma evidência de transformação química, pois aconteceu a formação de um novo material.
 um sólido amarelo – uma nova substância que não existia antes da mistura. Se tanto a solução aquosa de nitrato de chumbo quanto a de iodeto de potássio são incolores, o surgimento de um sólido de cor amarela indica a formação de uma nova substância.
um sólido amarelo – uma nova substância que não existia antes da mistura. Se tanto a solução aquosa de nitrato de chumbo quanto a de iodeto de potássio são incolores, o surgimento de um sólido de cor amarela indica a formação de uma nova substância.
Aula 6
Questões para fixação dos temas trabalhados, responder no caderno, demonstrar os cálculos.
- Recorde as definições de matéria.
- Matéria é tudo aquilo que ocupa lugar no espaço e pode, de alguma forma, ser medido.
- Matéria é tudo o que tem massa. Marque com X o que não é exemplo de matéria.
A) Borracha
B) Ar
C) Calor
D) Fumaça
2) Para cada exemplo de propriedade da matéria, acrescente pg ( propriedade geral) ou pe ( propriedade específica).
( ) massa ( ) ebulição ( ) dureza ( ) volume
É propriedade geral da matéria somente:
A) cor e volume
B) volume e massa
C) volume , ebulição e cor
D) dureza e volume
3) Qual das propriedades físicas abaixo é específica da matéria?
Cor
Massa
Volume
Ponto de Fusão
Temperatura
4) Em condições normais, o ponto de ebulição da água é 100 °C. Podemos afirmar que esta é uma propriedade:
a) específica
b) genérica
c) funcional
d) geral
e) organoléptica
5) A seguir são apresentadas algumas propriedades do cloreto de sódio (NaCl – sal de cozinha):
I. Sólido;
II. Cristalizado no sistema cúbico com faces centradas;
III. Branco;
IV. Com ponto de fusão a 800,4 °C;
V. Com ponto de ebulição a 1413 °C;
VI. Com solubilidade de 357 g/L a 25 °C;
VII. Com sabor salgado;
VIII. Inodoro;
IX. Em água, origina solução neutra;
X. No estado sólido, reage com ácido sulfúrico concentrado, produzindo gás clorídrico.
São propriedades especificas:
a) somente I, III e VIII.
b) somente IV, V e VI.
c) somente III, V e VII
d) somente I e X.
e) nenhuma das citadas.
6) Considere a mistura abaixo:
Sobre a mistura podemos afirmar que:
A) O gelo é mais denso que a água.
B) A água é mais densa do que o enxofre, e menos densa do que o gelo.
7) (PUC-MG) Em um laboratório de química, foram encontrados cinco recipientes sem rótulo, cada um contendo uma substância pura líquida e incolor. Para cada uma dessas substâncias, um estudante determinou as seguintes propriedades:
1. Ponto de ebulição
2. Massa
3. Volume
4. Densidade
8) Assinale as propriedades que podem permitir ao estudante a identificação desses líquidos.
a) 1 e 2
b) 1 e 3
c) 2 e 4
d) 1 e 4
10) As mudanças de estado físico do gasoso para o líquido e do sólido para o líquido respectivamente é:
A) fusão e solidificação.
B) vaporização e sublimação.
C) condensação e fusão.
D vaporização e solidificação.
11) Indique o volume: 2 Kg de chumbo ( densidade = 11,3 g/cm3 ) e 2 Kg de alumínio ( densidade = 2,7 g/cm3 ). Efetue e demonstre os cálculos. (Lembre um 1 Kg e igual a mil gramas)
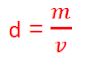
12) Se um liquido possui volume de 166 cm3 e a massa correspondente a 498 g . A densidade do líquido é: demonstre os cálculos
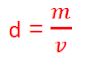
13) Um corpo tem densidade igual a 7,6 g/cm3 e o volume ocupa uma extensão de 200 cm3. Sua massa é:demonstre os cálculos
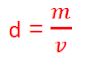
14) O latão, o bronze e o aço são misturas, denominadas ligas metálicas. Pode-se dizer que o latão, o bronze e o aço são tipos diferentes de:
A) misturas heterogêneas.
B) soluções líquidas.
C) soluções sólidas.
D) minerais rochosos.
15) Em geral, as pessoas consideram água mineral engarrafada como água pura, do ponto de vista químico, entretanto, se observarmos o rótulo de uma garrafa de água mineral, podemos afirmar que ela constitui uma:
A) mistura heterogênea.
B) mistura homogênea.
C) substância pura.
D) substância composta.
16) Um aluno deseja calcular a densidade de uma bola de gude. Primeiramente, mediu numa balança a massa do objeto 10 g. Depois, determinou o volume utilizando uma proveta com água que indicava 50 mL: mergulhou a bola de gude e a nova leitura foi 54 mL.
Os valores obtidos permitem saber a densidade do material que é feita a bola de gode é:
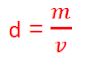
17) (Fuvest-SP) Quais propriedades a seguir são as mais indicadas para verificar se é pura uma certa amostra sólida de uma substância conhecida?
- Cor e densidade.
- Cor e dureza.
- Ponto de fusão e densidade.
- Cor e ponto de fusão.
- Densidade e dureza.
18) (FAAP-SP) No texto: “Um escultor recebe um bloco retangular de mármore e, habilmente, o transforma na estátua de uma celebridade do cinema”, podemos identificar matéria, corpo e objeto e, a partir daí, definir esses três conceitos.
I. Matéria (mármore): tudo aquilo que tem massa e ocupa lugar no espaço.
II. Corpo (bloco retangular de mármore): porção limitada de matéria que, por sua forma especial, se presta a um determinado uso.
III. Objeto (estátua de mármore): porção limitada de matéria.
Assinale a alternativa correta:
a) se somente a afirmativa I é correta.
b) se somente a afirmativa II é correta.
c) se somente a afirmativa III é correta.
d) se somente as afirmativas I e II são corretas.
e) se as afirmativas I, II e III são corretas
19) (CFT-PR) As propriedades de um material utilizadas para distinguir-se um material do outro são divididas em Organolépticas, Físicas e Químicas. Associe a primeira coluna com a segunda coluna e assinale a alternativa que apresenta a ordem correta das respostas.
PRIMEIRA COLUNA
(A) Propriedade Organoléptica
(B) Propriedade Física
(C) Propriedade Química
SEGUNDA COLUNA
( ) Sabor
( ) Ponto de Fusão
( ) Combustibilidade
( ) Reatividade
( ) Densidade
( ) Odor
( ) Estados da Matéria
a) A, B, C, C, B, A, B
b) A, B, C, A, B, C, B
c) A, C, B, C, B, C, B
d) A, B, C, B, B, A, B
e) C, B, A, C, B, A, B
20) Observe a tabela que apresenta as temperaturas de fusão e de ebulição de algumas substâncias.
| Substância | TF ( °C) | TE ( °C) |
| I | -117,3 | 78,5 |
| II | -93,9 | 65 |
| III | 801 | 1413 |
| IV | 1550 | 2827 |
Em relação aos estados físicos das substâncias, a alternativa errada é:
a) I é sólido a -125 °C
b) II é gasoso a 80°C
c )III é líquido a 1000°C
d) IV é gasoso a 2900°C
Aula 7
TIPOS DE MISTURA
Na natureza, é raro encontrar substâncias puras. Os materiais produzidos artificialmente também são, em geral, misturas de várias substâncias. A água que bebemos, por exemplo, mesmo que seja potável, não é pura, porque contém pequenas quantidades de sais minerais dissolvidos; os objetos metálicos, tão comuns no nosso dia a dia, não são compostos de metais puros, mas de uma mistura de vários deles.
Chama-se mistura a união física de duas ou mais substâncias, e a maior parte delas pode ser separada por métodos físicos.
Há dois tipos de mistura.
Mistura homogênea ou solução: é aquela cujos componentes (soluto e solvente) não se distinguem visualmente, ou seja, ela apresenta uma única fase, que tem as mesmas propriedades por toda a sua extensão. Por exemplo: ar atmosférico filtrado, ligas metálicas e água potável.
Mistura heterogênea: é aquela cujos componentes (ou fases) podem se distinguir visualmente. Por exemplo: granito, concreto, mistura de farinha e água, água e óleo, água e areia.
Soluto
Todo componente minoritário em uma solução.
Solvente
Componente que está em maior quantidade em uma solução.
Fase
Porção de um sistema que apresenta as mesmas propriedades em toda a sua extensão.
Liga
Mistura homogênea de duas ou mais substâncias, sendo pelo menos uma delas um metal.
Aula 8
SEPARAÇÃO DE MISTURAS
Qualquer separação de misturas só é possível se Até agora, você estudou três propriedades físicas importantes: a densidade, a temperatura de fusão e a de ebulição. Como elas poderiam ser utiliza- das para separar a mistura de areia, casca- lho, cortiça e sal seus componentes tiverem propriedades diferentes. De cozinha?
Observe os dados apresentados na tabela a seguir para compreender como as diferenças de densidade podem ajudar a resolver esse problema.
| Densidades de alguns materiais (a 20 °C) | |
| Material | Densidade (g/cm3) |
| Sílica (principal componente da areia e do cascalho) | 2,2 a 2,6 |
| Cloreto de sódio (sal de cozinha) | 2,2 |
| Água | 1,0 |
| Cortiça | 0,05 |
Fonte:LIdE,davidR.(Ed.).cRcHandbookofchemistryandPhysics.87.ed.BocaRaton:cRcPress,2007.
Consultando a tabela, percebe-seque areia, cascalho e sal de cozinha têm densidades muito próximas, e a cortiças e destaca com uma densidade bem menor. Uma maneira de separar a cortiça do restante da mistura é pela adição de água a um recipiente que contenha a mistura.
Como as densidades do cascalho e da areia são maiores que a da água, e a den- sidade da cortiça é menor que a da água, após essa adição, a cortiça vai flutuar, e o cascalho e a areia irão para o fundo do recipiente. Nesse caso, é só retirar a cortiça que estará flutuando na água.
E o que acontece com o sal ao se adicionar água à mistura? Como você sabe, o sal de cozinha (cloreto de sódio) se dissolve na água. Isso acontece graças a uma propriedade química chamada de solubilidade. Essa propriedade o diferencia da areia e do cascalho, que são insolúveis em água.
A solubilidade será estudada mais adiante, mas, por ora, basta você saber que, sendo o cloreto de sódio solúvel em água, ele formam uma mistura homogênea, que pode ser separada da areia e do cascalho por decantação. Assim, se a água com sal for vertida em outro recipiente, restará, no primeiro, apenas a mistura de areia e cascalho.
A mistura heterogênea de areia e cascalho, por sua vez, pode ser separada por peneiração. A propriedade que diferencia esses dois materiais é o tamanho de seus grãos (ou granulometria). Os grãos de areia têm menos de 1 mm de diâmetro médio, e os de cascalho, menos de 1 cm. Usando uma peneira com furos de cerca de 2 mm, por exemplo, a areia passará pela tela, enquanto o cascalho ficará retido.
Resta, agora, separar a mistura de sal e água. Nesse caso, a diferença de temperaturas de ebulição pode ser a chave. Basta lembrar que, à temperatura ambiente (25 °C), o cloreto de sódio é sólido e a água é líquida. Confira as temperaturas de fusão e de ebulição dessas duas substâncias na tabela Temperaturas de fusão e de ebulição de diferentes substâncias à pressão de 1atm, apresentada anteriormente.
Para separar substâncias com temperaturas de ebulição distintas, pode-se utilizar a evaporação ou a destilação simples. Caso se queira obter apenas o sólido, o cloreto de sódio, pode-se fazer a evaporação da água em um recipiente aberto, para que o sal permaneça.
Em uma destilação, a mistura é aquecida em um balão de destilação. Quando a temperatura atinge a de ebulição de uma das substâncias presentes, esta começa a vaporizar, e o vapor gerado sai do balão para o condensador, onde é resfriado e, como o próprio nome sugere, condensa-se, para depois ser recolhido em um frasco conhecido por Erlenmeyer. No caso da mistura tomada como exemplo aqui, a água será o destilado (substância recolhida no Erlenmeyer), e o sal, a substância que res- tará no balão de destilação por ter uma temperatura de ebulição muito mais alta que a daágua.
Há muitos métodos para a separação de misturas. Veja a seguir alguns exemplos.
| Filtração: serve para a separação de misturas que contêm sólidos e líquidos ou sólidos e gases. Como meio filtrante, podem ser utilizados filtros de papel, algodão ou qualquer material poroso que permita a passagem de pelo menos uma das substâncias. Exemplos de misturas que podem ser separadas por filtração: água e areia, poeira e ar. Ao coar o café, você está realizando uma filtração. |
| Peneiração: utiliza-se uma peneira com furos de tamanho adequado para separar sólidos de dimensões distintas. Exemplos de misturas que podem ser separadas por peneiração: areia e brita, cimento para ser ensacado.
Flotação: serve para separar sólidos de densidades diferentes. É realizada adicionando-se um líquido com densidade intermediária entre os sólidos que se deseja separar. Exemplos de misturas que podem ser separadas por flotação:areia e serragem,areia e cortiça. Decantação: utilizada para separar sólidos de líquidos e misturas de líquidos imiscíveis (que não se misturam) e de densidades diferentes. No caso de líquidos, usa-se um funil de separação. Ele é dotado de uma torneira que possibilita, primeiro,a passagem do líquido mais denso e, depois, do menos denso. Pode-se, também, retirar o líquido menos denso pela parte de cima do funil. Exemplos de misturas que podem ser separadas por decantação: água e argila, água e azeite deoliva. Se você fizer um suco de melancia, vai perceber que rapidamente a parte sólida da polpa da frutas e concentra e se decanta,separando-se da água. Extração com solventes: serve para separar sólidos,líquidos e líquidos de sólidos com solubilidades diferentes. Adiciona-se à mistura um solvente que dissolva apenas um dos seus compostos. O solúvel é removido com o solvente. Exemplos de misturas que podem ser separadas por extração com solventes: óleo de sementes, separação de solventes etc. Dissolução fracionada: processo de separação utilizado para misturas heterogêneas de sólidos quando um dos componentes é solúvel em um líquido e o outro,não,como a misturas sal e areia. No exemplo citado,o líquido utilizado é a água, que dissolve o sal, e não a areia. Centrifugação: utilizada para separar um ou mais sólidos suspensos em um líquido. Quando um sólido apresenta grãos muito finos, a separação por filtração ou decantação pode se tornar muito difícil. Na centrifugação, a mistura é girada a velocidades elevadas, e a força centrífuga gerada acelera a deposição da fração sólida no fundo do tubo de amostra. Exemplos de situações em que a centrifugação é utilizada: componentes do sangue, secagem do sal, nas máquinas de lavar roupas etc. Separação magnética: quando um dos componentes da mistura é uma substância ferromagnética, ou seja, que é atraída por um ímã (ferro, níquel e cobalto, por exemplo), pode-se utilizar um ímã para removê-lo.Exemplo de misturas que podem ser separadas magneticamente: peças ferrosas em sucata para reciclagem. Destilação: para separar misturas homogêneas de sólidos e líquidos ou de líquidos com temperaturas de ebulição distintas, utiliza-se adestilação simples. Para misturas homogêneas de líquidos com valores próximos de temperatura de ebulição, utiliza-se a destilação fracionada. Exemplos de misturas que podem ser separadas por destilação: sal de cozinha e água (destilação simples), frações do petróleo, como gasolina, diesel etc. (destilação fracionada), gases oxigênio e nitrogênio do ar atmosférico (destilação fracionada). |
http://saberenemquimicaefisica.com.br/wp/processo-de-separacao-de-misturas/
Aula 9
Propriedades Químicas:
Referem-se àquelas que, quando são coletadas e analisadas, alteram a composição química da matéria, ou seja, referem-se a uma capacidade que uma substância tem de transformar-se em outra por meio de reações químicas.
Por exemplo, a combustibilidade é uma propriedade química, pois a água não tem essa propriedade, enquanto o álcool (etanol) tem. Quando o álcool queima, ele converte-se em outras substâncias (gás carbônico e água), como mostra a reação abaixo:
1 C2H6OH + 3 O2 → 2 CO2 + 3 H2O
- Combustão
É um processo químico de oxidação, no qual o material combustível se combina com o oxigênio em condições favoráveis (calor), produzindo luz e calor.
- FOGO: É uma forma de combustão, caracterizada por uma reação química que combina materiais combustíveis com o oxigênio do ar, com desprendimento de energia luminosa e energia térmica.
- Triângulo do Fogo
(combustível, comburente e calor)
Outro exemplo é o enferrujamento do prego (corrosão), que, em termos simples, é uma reação de oxidação do ferro, quando exposto ao ar úmido (oxigênio (O2) e água (H2O)), formando o óxido de ferro (III) mono-hidratado (Fe2O3 . H2O), que é um composto que possui coloração castanho-avermelhada, isto é, a ferrugem que conhecemos.

As reações envolvidas nesse processo são mostradas abaixo:
Fe(s) → Fe2+ + 2e–
2H2O + 2e– → H2 + 2OH–
Fe2+ + 2OH– → Fe(OH)2
2Fe(OH)2 + H2O + 1/2O2 → 2 Fe(OH)3
Outros exemplos de propriedades químicas são: oxidar, explosão, poder de corrosão e efervescência.
Propriedades Funcionais
Propriedades Funcionais da matéria são aquelas apresentas por grupos de substâncias. Ou ainda, é um conjunto de substâncias com propriedades químicas semelhantes. Como por exemplo, as substâncias químicas podem ser divididas em quatro grandes grupos: ácidos, bases, sais e óxidos. Todos os grupos com propriedades próprias e bem definidas.
Aula 10
Questões
01-(UFPR) Pode-se atravessar uma barra de gelo usando-se uma arame com um peso adequado, sem que a barra fique dividida em duas partes.
Qual é a explicação para o fenômeno?
a) A pressão exercida pelo arames sobre o gelo abaixa seu ponto de fusão.
b) O gelo já cortado pelo arame, devido a baixa temperatura, se funde novamente.
c) A pressão exercida pelo arame sobre o gelo aumenta seu ponto de fusão, mantendo a barra sempre solida.
d) O arame, estando naturalmente mais aquecido, funde o gelo; essa energia, uma vez perdida para a atmosfera, deixa a barra novamente solida.
e) Há uma ligeira flexão da barra, e as duas partes, já cortadas pelo arame, são comprimidas uma contra a outra, soldando-se.
Na patinação sobre o gelo, o deslizamento é facilitado porque, quando o patinador passa, parte do gelo se transforma em água, reduzindo o atrito. Estando o gelo a uma temperatura inferior a 0ºC, isso ocorre porque a pressão da lâmina do patim sobre o gelo faz com que ele derreta.
02-(UFPEL-RS) Na patinação sobre o gelo, o deslizamento é facilitado porque, quando o patinador passa, parte do gelo se transforma em água, reduzindo o atrito. Estando o gelo a uma temperatura inferior a 0ºC, isso ocorre porque a pressão da lâmina do patim sobre o gelo faz com que ele derreta.
De acordo com seus conhecimentos e com as informações do texto, é correto afirmar que a fusão do gelo acontece por que
- a) a pressão não influencia no ponto de fusão.
- b) o aumento da pressão aumenta o ponto de fusão.
- c) a diminuição da pressão diminui o ponto de fusão.
- d) a pressão e o ponto de fusão não se alteram.
- e) o aumento da pressão diminui o ponto de fusão.
Por que o gelo das pistas de patinação é tão escorregadio?
Quem já ficou em pé sobre uma pista sabe o quanto é tarefa difícil. Bobeou, você leva um tombo. Antes, o pessoal acreditava que a pressão dos pés sobre o gelo era a culpada. E até com razão. Pressionando, o gelo se funde parcialmente, tornando-se escorregadio. Mas pesquisas mostraram que a pressão nem sempre é suficiente para fundir a superfície do gelo.
Cientistas do Laboratório Nacional Lawrence Berkeley, na Califórnia, nos Estados Unidos, descobriram por que ele causa tantos tombos. O gelo é formado por uma seqüência de camadas de moléculas de água firmemente ligadas umas às outras. As moléculas vibram constantemente, apesar da baixa temperatura. Os pesquisadores descobriram que as moléculas da primeira camada trepidam mais rápido do que as das camadas inferiores. Esse ligeiro movimento coloca-as em um estágio intermediário entre o sólido e o líquido. Ou seja, elas se comportam como líquido, porque suas moléculas estão mais agitadas, só que sua temperatura ainda é inferior ao ponto de fusão.
Esse estado intermediário, que os pesquisadores deram o nome de quasi-liquid (quase líquido), diminui muito o atrito entre os patins e o gelo, tornando-o por isso tão escorregadio.
Influência da pressão no ponto de fusão
Para a maioria das substâncias, a fusão tem por fim aumentar o seu volume, e como já vimos anteriormente, quando o volume tende aumentar, consequentemente, a pressão tende a diminuir o volume das substâncias. Com base na Lei de Chatelier, podemos concluir que com o aumento de pressão, irá dificultar a fusão, ou seja, aumenta a temperatura de fusão.
Portanto, se pensarmos no gráfico da pressão em função da temperatura de fusão, pode-se dizer que a curva será crescente
03-(FUVEST-SP) Nos dias frios, quando uma pessoa expele ar pela boca, forma-se uma espécie de “fumaça” junto ao rosto. Isso ocorre porque a pessoa:
- a) expele ar quente que condensa o vapor de água existente na atmosfera.
b) expele ar quente e úmido que se esfria, ocorrendo a condensação dos vapores expelidos.
c) expele ar frio que provoca a condensação do vapor de água na atmosfera.
d) provoca a evaporação da água existente no ar.
e) provoca a liquefação do ar, com seu calor.
04-(UFPEL-RS) Um bloco de chumbo está sendo fundido.
Durante esse processo, à pressão constante, é correto afirmar que
- a) ele recebe calor e sua temperatura aumenta.
- b) ele cede calor e sua temperatura aumenta.
- c) ele recebe calor e sua temperatura permanece constante.
- d) o calor evidenciado é sensível, pois há mudança de temperatura.
- e) ele cede calor e sua temperatura diminui.
Aula 11
Símbolos e Fórmulas
Símbolos
São conhecidos atualmente mais de 100 elementos químicos. Cada um deles tem um nome e um símbolo diferente.

Os símbolos são a representação dos elementos químicos. São formados por uma, duas ou três letras. A primeira é sempre maiúscula e a segunda, é sempre minúscula. O símbolo de um elemento vem de uma ou duas letras tiradas de seu nome em latim.
Por causa disso, nem todos os símbolos têm relação lógica com o nome do elemento em português.
Os que têm três letras não têm nomes oficiais, atribuídos pela Iupac (União Internacional de Química Pura e Aplicada).

Fórmulas
Todas as substâncias são formadas por átomos. As substâncias simples são formadas por átomos de um único elemento e as substâncias compostas são formadas por átomos de dois ou mais elementos diferentes.

As moléculas são as menores unidades que apresentam a composição característica de uma substância. As moléculas são formadas pela união de dois ou mais átomos.

Para representar graficamente as moléculas de uma substância, seja ela simples ou composta, os químicos utilizam fórmulas. A fórmula da água é H2O. Outras fórmulas usadas pelos químicos são CO2 (gás carbônico), N2 (gás nitrogênio), O2 (gás oxigênio), O3 (gás ozônio), C2H6O (etanol), C6H12O6 (glicose), NH3 (amônia) e H2SO4 (ácido sulfúrico).

Na fórmula de uma substância são colocados os símbolos dos elementos que tornam parte de sua composição e os índices de atomicidade (ou, simplesmente, atomicidade), que indicam a proporção em que os átomos do elemento estão presentes na substância. Se o índice de atomicidade não for escrito, é porque seu valor é 1.

Aula 12
Elementos químicos que formam o corpo humano
O organismo é composto de uma porção de integrantes da tabela periódica. Na maioria dos casos, eles aparecem combinados e desempenham diferentes funções da cabeça aos pés. Entenda o papel de 21 moléculas fundamentais à nossa existência.
H (Hidrogênio):
Compõe a água, que representa cerca de 70% do peso de um ser humano.

Tem a função de, entre outras coisas, transportar substâncias, limpar órgãos e regular a temperatura.
Não-metais
C (Carbono):
Sem ele, a vida não seria possível. Todas as moléculas orgânicas possuem carbono. Durante a respiração, é expirado junto com o oxigênio na forma de gás carbônico.

N (Nitrogênio):
É indispensável ao DNA, estrutura localizada no núcleo das células que carrega toda a nossa receita genética.
Também é o elemento básico das proteínas do corpo.
O (Oxigênio):
Obtido principalmente por meio da respiração, é usado por todas as células na hora de converter os nutrientes em energia. Por essa razão é o elemento mais abundante do corpo.

F (Flúor):
Reside em especial na boca, formando uma camada que protege os dentes do ataque das bactérias da cárie e da gengivite. 
Entra no corpo pra valer por meio da água fluoretada das torneiras.
P (Fósforo) e Mg (Magnésio):
A dupla, encontrada em cereais e legumes, está na composição do trifosfato de adenosina, o ATP, que armazena energia. O fósforo ainda é peça-chave nas cadeias de DNA.

S (Enxofre):
Transforma itens tóxicos que podem contaminar comidas e bebidas em substratos inofensivos à saúde.

Contudo, alguns maus odores emitidos pelo organismo se devem a ele.
Cl (Cloro):
Neutraliza a carga positiva de vários elementos, condição básica para que reações químicas aconteçam em diversos tecidos.

O cloro está, por exemplo, no sal de cozinha.
I (Iodo):
Componente dos hormônios T3 e T4, que são produzidos pela tireoide e regulam todo o metabolismo.
Vem do sal e de hortaliças. Carência ou excesso geram disfunções na glândula tireoide.

Metais
Na (Sódio) e K (Potássio):
Contraem e relaxam os músculos.
O potássio fica dentro das fibras musculares e o sódio, do lado de fora. A troca de posições garante os movimentos.
Daí por que precisam estar em equilíbrio.
Ca (Cálcio):
É o mineral mais comum, presente em ossos e dentes. Ainda está nas membranas celulares, onde trabalha como porteiro, decidindo o que entra e sai.
É obtido sobretudo com os laticínios.

Cr (Cromo):
Um importante parceiro da insulina na hora de colocar a glicose das refeições, recém-chegada à circulação, no interior das células.
À mesa, é fornecido por ovos e carnes.

Fe (Ferro) e Co (Cobalto):
O cobalto ajuda a formar as hemácias do sangue. O ferro integra a hemoglobina, proteína dessas células que carrega o oxigênio pela circulação.
Eles vêm das carnes e das oleaginosas.

Cu (Cobre):
Constitui a membrana da mitocôndria, estrutura da célula que produz a molécula de ATP, o combustível celular.
Sua presença faz a liberação de energia ser gradual.

Zn (Zinco):
Oferecido por peixes e frutos do mar, participa da digestão, atua no transporte de oxigênio e nas nossas defesas, além de ser essencial à cicatrização de feridas.

Não-metais (Se) e metais (Mn e Mo)

Se (Selênio), Mn (Manganês) e Mo (Molibdênio):

O trio é responsável por combater os temidos radicais livres, agentes que envelhecem as células e danificam o DNA.
Aula 13
ESTRUTURA DA MATÉRIA
ESTRUTURA DA MATÉRIA O termo matéria refere-se a todos os materiais ou coisas que compõem o universo. A matéria é constituída por partículas muito pequenas denominadas átomos. Os átomos apresentam vários tipos diferentes, chamados também de elementos químicos. A união entre átomos é chamada de ligação química que por sua vez forma as moléculas.
1 grão de areia (1mm) / 10.000.000 = tamanho de um átomo
Átomos Elementos Químicos
| Nome | Símbolo | Natureza |
| Ferro | Fe | Fe3O4 |
| Cálcio | Ca | CaCO3 |
| Prata | Ag (Argentum) | Ag |
| Oxigênio | O | O2 |
A união entre átomos é chamada de ligação química. Os átomos de combinam (ligação química) para formar as moléculas ou aglomerados iônicos.
Um conjunto de espécies químicas iguais – moléculas – forma as substâncias químicas. As substâncias químicas são responsáveis pela constituição de toda matéria
ESTUDO DAS SUBSTÂNCIAS E MISTURAS
SUBSTÂNCIA: forma particular de matéria, apresentando composição fixa, definida.
Na grande maioria dos casos, os materiais que constituem um corpo ou um objeto são compostos por várias substâncias químicas diferentes.
Ex Em um fio de cobre encontramos muitos átomos de cobre.
No leite encontramos água, lactose, galactose, caseína e albumina, etc.
A água do mar é constituída água, cloreto de sódio, além de outros tipos de sais
Substância simples: é constituída de uma molécula formada por átomos do mesmo elemento químico (mesmo tipo de átomo).
Substância composta: é constituída por uma molécula formada por mais de um elemento químico.
Substâncias Puras
Aula 14
A Linguagem dos químicos
A representação simbólica dos elementos químicos foi mudando ao longo dos tempos.
Tornou-se importante para os químicos representar cada elemento, de um modo simples e entendido por todos, com caráter universal.
Foi Berzelius, cientista sueco, quem introduziu a notação simbólica, moderna, dos elementos.
Jacob Berzelius 1779-1848
São formados por uma, duas ou três letras do nome do elemento (escrito em latim, grego ou inglês):
– 1ª letra maiúscula; – Restantes letras minúsculas (quando necessárias). Exemplificando:
Carbono
Símbolo químico: C Letra maiúscula
Cálcio
Símbolo químico: Ca 1ª letra maiúscula – Restantes letras minúsculas
Letra minúscula
Nomes de alguns elementos e respectivos símbolos químicos:
Nome do elemento Cobre – do latim Cuprum – Símbolo químico Cu
Nome do elemento Sódio – do latim Natrium – Símbolo químico Na
Nome do elemento Prata – do latim Argentum – Símbolo químico Ag
O símbolo químico de um elemento representa:
– o nome desse elemento;
– um átomo desse elemento.
Exemplo:
Símbolo químico H – Nome do elemento Hidrogênio – representa um átomo do elemento hidrogênio.
Quando se pretende representar mais do que um átomo de um dado elemento (não ligado quimicamente) deves: Indicar, antes do símbolo químico e ao mesmo nível, o número de átomos desse elemento.
Por exemplo:
2 H – representa dois átomos do elemento hidrogénio;
3 O – representa três átomos do elemento oxigénio;
4 C – representa quatro átomos do elemento carbono;
As substâncias moleculares representam-se por meio de fórmulas químicas.
Há regras para escrever a fórmula química de qualquer substância molecular:
Ä Escrever os símbolos químicos dos elementos que entram na constituição da molécula;
Ä Colocar um índice numérico à direita, ligeiramente abaixo do símbolo do
elemento. Este índice indica o número de átomos de cada elemento constituinte da molécula.
Ä Quando na molécula há apenas um átomo de um elemento químico, omitese o índice 1 (um) após o símbolo.
Por exemplo:
A água é uma substância molecular formada pelos elementos oxigênio e hidrogênio.
A fórmula química da água é: H2O1
Símbolo químico do hidrogênio, Símbolo químico do oxigênio.
A fórmula química de qualquer substância molecular tem um significado qualitativo e um significado quantitativo:
Ä qualitativamente, indica os elementos que constituem essa substância;
Ä quantitativamente, informa acerca do número de átomos de cada elemento que constituem a molécula.
Fórmulas químicas
H2 – Nome da substância – Di-hidrogénio -Significado quantitativo e qualitativo – Molécula formada por 2 átomos de hidrogênio.
N2 – Nome da substância – Diazoto -Significado quantitativo e qualitativo, Molécula formada por 2 átomos de azoto.
Exercício
Água H2O, Dióxido de Carbono CO2, Amoníaco NH3, Propano C3H8
Nome da substância Modelo da molécula Significado quantitativo e qualitativo
Molécula formada por 2 átomos de hidrogénio e 1 átomo de oxigénio
Molécula formada por 1 átomo de carbono e 2 átomos de oxigénio
Molécula formada por 1 átomo de azoto e 3 átomos de oxigénio Molécula
Aula 15
Equações Químicas
As equações químicas são representações gráficas das reações químicas que ocorrem entre os diversos elementos presentes na Tabela Periódica.
Elas são formadas por átomos, moléculas, e se apresentarem íons são chamadas de equações iônicas:
- H2(g) + O2(g) → H2O (l) – equação comum
- H++ OH–→ H2O – equação iônica
Observe que os elementos que estão à esquerda da seta são denominados reagentes, os quais participam das reações químicas, enquanto aqueles que estão à direita são chamados de produtos, ou seja, as substâncias que são formadas a partir dessa reação.
Fique atento, pois alguns símbolos são utilizados nas equações para indicar determinadas ações que ocorrem:
- Quando ocorre a reação química dos elementos: +
- Sentido que ocorre a reação química e indica o que será produzido: →
- Quando há presença de catalisadores ou aquecimento: ∆
- Quando há formação de um sólido que se precipita:↓
- Quando a reação é reversível: ↔
- Quando há presença de luz: λ
- Elemento no estado gasoso: (g)
- Elemento no estado sólido: (s)
- Elemento no estado de vapor: (v)
- Elemento no estado líquido: (l)
- Presença de solução aquosa: (aq)
Aula 16
TIPOS DE EQUAÇÕES QUÍMICAS
As classificações das equações químicas são determinadas pelo tipo de reação química que ocorre, classificadas de quatro maneiras:
- Reações de Síntese ou Adição
(A+B → AB): reação entre duas substâncias gerando uma nova e mais complexa, por exemplo: C + O2 → CO2.
- Reações de Análise ou de Decomposição
(AB → A+B): ao contrário da reação de adição, essa reação ocorre de modo que uma substância composta se divide em duas ou mais substâncias simples, por exemplo: 2 HgO → 2 Hg + O2.
- Reações de Deslocamento ou de Substituição ou de Simples Troca
(AB+C → AC+B ou AB+C → CB+A): corresponde a reação entre uma substância simples e outra composta, resultando na variação da substância composta em simples, por exemplo: Fe + 2HCL → H2 + FeCl2.
- Reações de Dupla-Troca ou de Dupla Substituição
- (AB+CD → AD+CB): reação entre duas substâncias compostas que trocam entre si os elementos químicos, resultando em duas novas substâncias compostas, por exemplo: NaCl + AgNO3→ AgCl + NaNO3.
Exemplos de Equações Químicas
Veja abaixo alguns exemplos de equações químicas:
C (s) + O2 (g) → CO2(g)
2H2 (g) + O2 (g) → 2 H2O (l)
Zn + CuSO4 → ZnSO4 + Cu
Para aprofundar seus conhecimentos, leia também os artigos:
Aula 17
BALANCEAMENTO DAS EQUAÇÕES QUÍMICAS
O balanceamento das equações químicas demostra sua estabilidade e equilíbrio, uma vez que deve conter o mesmo número de átomos de cada elemento em ambos os lados da equação.
Os coeficientes estequiométricos são os números que aparecem na frente dos elementos, indicando quantos átomos existem na reação.
Quando o coeficiente for 1 geralmente ele fica subentendido e não aparece descrito. De tal modo, podemos dizer que as fórmulas (H2, O2, C2, H2O, HCl, CaO, etc.) oferecem um sentido qualitativo, enquanto os coeficientes dão o sentido quantitativo das equações químicas.
Para que uma equação química fique balanceada, devemos atentar para a “Lei da Conservação de Massa” de Lavoisier a qual postula:
“Na natureza nada se cria, nada se perde, tudo se transforma” donde “A soma das massas das substâncias reagentes é igual à soma das massas dos produtos da reação”.
Para entender melhor esse conceito, vejamos o exemplo abaixo:
Al+O2 → Al2O3
Para balancear a equação química acima, primeiramente devemos escolher o elemento que surge somente uma vez na primeira e na segunda parte da equação, sendo que nesse caso é igual para o Alumínio (Al) e o Oxigênio (O).
Observado isso, devemos escolher o elemento com índices maiores, nesse caso, o oxigênio (O), com 2 (no primeiro membro) e 3 (no segundo membro). Por conseguinte, devemos transpor os índices do primeiro e do segundo membro, usando-os como coeficientes.
Logo, para que a equação acima fique balanceada devemos acrescentar os coeficientes 4 (2.2=4) e 2 na frente do elemento alumínio (Al) no primeiro e no segundo membro respectivamente, e ainda, o 3 no oxigênio (O) do primeiro membro.
Assim, o número de total de átomos de cada elemento da reação química fica balanceado no 1° e 2° membro da equação:
4Al + 3O2 → 2Al2O3
Exercício Resolvido
Para fixar seus conhecimentos sobre o balanceamento de equações, segue abaixo cinco equações que devem ser balanceadas:
- a) H2O → H2+O2
b) H2S+SO2→ H2O+S
c) H2+I2→ HI
d) NH3+O2→ NO+H2O
e) FeS2+O2→ Fe3O4+SO2
Aula 18
Tabela periódica
A partir do século XIX, cientistas começaram a perceber que os elementos químicos poderiam ser agrupados em colunas, formadas pela reunião de elementos com propriedades semelhantes.
O número de elementos químicos conhecidos pelo homem aumentou com o passar dos séculos, principalmente no XIX. Observe a tabela:
| ATÉ O FINAL DO SÉCULO: | Nº DE ELEMENTOS QUÍMICOS |
| XVI | 14 |
| XVII | 33 |
| XIX | 83 |
| XX | 112 |
Alguns elementos já eram conhecidos antes de 1650, como Ag, C, As, Au, Hg, Pb, Sn, Sb, Cu, S. Depois de tantos químicos tentarem classificar os elementos químicos, Dimitri Ivanovitch Mendeleyev foi o que mais se destacou.
Seu trabalho em classificar os elementos é usado até hoje. Ele criou uma tabela periódica dos elementos, que serviu de base para organizar a que temos hoje.
Mendeleyev observou que há uma periodicidade das propriedades quando os elementos químicos eram colocados em ordem crescente de suas massas atômicas.
Lei da periodicidade – muitas propriedades físicas e químicas dos elementos variam periodicamente na sequência de seus números atômicos.
Como utilizar a tabela periódica?
Cada quadro da tabela fornece os dados referentes ao elemento químico: símbolo, massa atômica, número atômico, nome do elemento, elétrons nas camadas e se o elemento é radioativo.
As filas horizontais são denominadas períodos. Neles, os elementos químicos estão dispostos na ordem crescente de seus números atômicos. O número da ordem do período indica o número de níveis energéticos ou camadas eletrônicas do elemento. A tabela periódica apresenta sete períodos:
1º período – 2 elementos
2º período – 8 elementos
3º período – 8 elementos
4º período – 18 elementos
5º período – 18 elementos
6º período – 32 elementos
7º período – até agora 30 elementos
As colunas verticais constituem as famílias ou grupos, nas quais os elementos estão reunidos segundo suas propriedades químicas. As famílias ou grupos vão de 1 a 18. Algumas famílias possuem nome, como por exemplo:
1 – alcalinos
2 – alcalinos terrosos
13 – família do boro
14 – família do carbono
15 – família do nitrogênio
16 – família dos calcogênios
17 – família dos halogênios
18 – gases nobres
Da família 1 e 2 e 13 até 18 chamamos de elementos representativos. Da família do 3 até 12 chamamos de elementos de transição.
Os elementos que ficam na série dos lantanídeos e actinídeos são os elementos de transição. Como eles estão no grupo 3, como se estivessem numa “caixinha” para dentro da tabela, são chamados de elementos de transição interna. E os demais são chamados de elementos de transição externa.
Os elementos químicos estão reunidos em três grandes grupos: metais, não-metais e gases nobres. O hidrogênio (H) não se encaixa em nenhuma dessas classificações porque possui características próprias. Algumas tabelas mostram esta divisão.
Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.
Quase todos os metais têm brilho, pois são capazes de refletir muito bem a luz. Ouro, prata e alumínio são exemplos de metais com muito brilho. Os metais são bons condutores elétricos.
Como em geral apresentam ductibilidade, ou seja, podem ser reduzidos a fios, são usados como tal na condução de eletricidade. Os metais conduzem bem o calor.
Nem sempre um metal puro apresenta as propriedades desejáveis para determinadas aplicações. Por isso são produzidas as ligas metálicas, onde dois ou mais metais são misturados. São exemplos o bronze e o latão. O bronze é uma mistura de cobre, estanho e o latão é resultado da mistura de cobre e zinco.
A maioria das ligas é formada por dois ou mais metais, mas algumas contêm não-metais, como o carbono. A liga mais usada desse tipo é o aço. Os não-metais são maus condutores de eletricidade, quase não apresentam brilho, não são maleáveis e nem dúcteis. Tendem a formar ânions (íons negativos).
Os gases nobres ou inertes, ou ainda raros, constituem cerca de 1% do ar. É muito difícil se conseguir compostos com estes gases. Raramente eles reagem porque são muito estáveis. Suas camadas exteriores estão completamente preenchidas de elétrons. Estão todos no grupo 18 da tabela periódica.
Na tabela periódica atual, existem elementos naturais e artificiais. Os naturais são os elementos encontrados na natureza e os artificiais são produzidos em laboratórios.
Dois estão localizados antes do urânio (U-92), os chamados elementos cisurânicos, que são o tecnécio (Tc – 43) e o promécio (Pm – 61). Outros elementos artificiais vêm depois do urânio, chamamos de transurânicos que são todos os outros após o U – 92. Dentre eles: Pu, Am, Bk, Fm, No, Sg, Ds
Aula 19
ESTRUTURA DO ÁTOMO
Evolução dos modelos atômicos
MATÉRIA
– Átomos são os componentes básicos das moléculas e da matéria comum.
– São compostos por partículas subatómicas.
- As mais conhecidas são os prótons, os nêutrons e os elétrons.
- Formado por : núcleo atômico e a eletrosfera.
– O núcleo é constituído de prótons (cargas positivas) e nêutrons (cargas neutras). Os nêutrons estabilizam o núcleo, uma vez que cargas de mesmo sinal tendem a se repelir.
– Em torno do núcleo, na eletrosfera, estão os elétrons (cargas negativas). Os elétrons são atraídos pela carga positiva dos prótons e então ficam ao seu redor, na eletrosfera.
Da família 1 e 2 e 13 até 18 chamamos de elementos representativos. Da família do 3 até 12 chamamos de elementos de transição.
17 – família dos halogênios
18 – gases nobres
Os elementos que ficam na série dos lantanídeos e actinídeos são os elementos de transição. Como eles estão no grupo 3, como se estivessem numa “caixinha” para dentro da tabela, são chamados de elementos de transição interna. E os demais são chamados de elementos de transição externa.
Os elementos químicos estão reunidos em três grandes grupos: metais, não-metais e gases nobres. O hidrogênio (H) não se encaixa em nenhuma dessas classificações porque possui características próprias. Algumas tabelas mostram esta divisão.
Os metais são elementos químicos que possuem várias propriedades específicas, como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade. Todos os metais são sólidos à temperatura de 25ºC e pressão de 1atm, exceto o mercúrio (Hg) que é líquido nestas condições.
Quase todos os metais têm brilho, pois são capazes de refletir muito bem a luz. Ouro, prata e alumínio são exemplos de metais com muito brilho. Os metais são bons condutores elétricos.
Como em geral apresentam ductibilidade, ou seja, podem ser reduzidos a fios, são usados como tal na condução de eletricidade. Os metais conduzem bem o calor.
Nem sempre um metal puro apresenta as propriedades desejáveis para determinadas aplicações. Por isso são produzidas as ligas metálicas, onde dois ou mais metais são misturados. São exemplos o bronze e o latão. O bronze é uma mistura de cobre, estanho e o latão é resultado da mistura de cobre e zinco.
A maioria das ligas é formada por dois ou mais metais, mas algumas contêm não-metais, como o carbono. A liga mais usada desse tipo é o aço. Os não-metais são maus condutores de eletricidade, quase não apresentam brilho, não são maleáveis e nem dúcteis. Tendem a formar ânions (íons negativos).
Os gases nobres ou inertes, ou ainda raros, constituem cerca de 1% do ar. É muito difícil se conseguir compostos com estes gases. Raramente eles reagem porque são muito estáveis. Suas camadas exteriores estão completamente preenchidas de elétrons. Estão todos no grupo 18 da tabela periódica.
Na tabela periódica atual, existem elementos naturais e artificiais. Os naturais são os elementos encontrados na natureza e os artificiais são produzidos em laboratórios.
Dois estão localizados antes do urânio (U-92), os chamados elementos cisurânicos, que são o tecnécio (Tc – 43) e o promécio (Pm – 61). Outros elementos artificiais vêm depois do urânio, chamamos de transurânicos que são todos os outros após o U – 92. Dentre eles: Pu, Am, Bk, Fm, No, Sg, Ds.












[1].jpg)












