DUVIDA PODE COMENTAR E PERGUNTAR QUE AJUDAMOS A RESOLVER SEU PROBLEMA NESSES ASSUNTOS. DEIXE UMA RESPOSTA NO COMENTÁRIO NO FINAL DA ATIVIDADE.
TEMA “O AR ATMOSFÉRICO COMO FONTE
DE MATÉRIA PRIMA”
ATIVIDADE 1: DESTILAÇÃO FRACIONADA
1A Reflita com seus colegas sobre os questionamentos a seguir:
- Como é o ar que respiramos?
Segundo a representante da ONU Meio Ambiente no Brasil, Denise Hamú, “Muitas vezes, não vemos os poluentes que estão no ar. Mas esta forma de poluição está matando tanto que já é chamada de ‘o novo tabaco’. A escolha do tema para guiar as ações neste ano é uma oportunidade para disseminar informações e estimular mais e melhores políticas públicas pela qualidade do ar, em todas as esferas – global, nacional, estadual e municipal. Também é um chamado para mais investimentos em tecnologias verdes e mudanças de hábito no dia a dia de cada cidadão”. Os dados da ONU Meio Ambiente, agência ambiental da Organização das Nações Unidas apontam que 9 em cada 10 pessoas no mundo estão expostas a altos níveis de poluição do ar. Aproximadamente 7 milhões de pessoas morrem por anos de forma prematura acometidas de doenças ocasionadas pela poluição no ar. Nas grandes cidades, o problema é maior, devido, às grandes indústrias e a concentração urbana.
2. Como o ar atmosférico pode ser utilizado, além da respiração dos seres vivos?
3. Como o ar pode ser usado na indústria?
1B Após a discussão, registre as suas ideias e hipóteses com relação a cada situação-problema.
1C Leia o texto “Qualidade do Ar” do Ministério do Meio Ambiente. Elabore um resumo com referência nas questões abaixo e socialize com seus colegas:
Texto 1: Ministério do Meio Ambiente. Qualidade do ar.
Disponível em:
http://www.mma.gov.br/cidades-sustentaveis/qualidade-do-ar
Qualidade do Ar
Os processos industriais e de geração de energia, os veículos automotores e as queimadas são, dentre as atividades antrópicas, as maiores causas da introdução de substâncias poluentes à atmosfera, muitas delas tóxicas à saúde humana e responsáveis por danos à flora e aos materiais.
A poluição atmosférica pode ser definida como qualquer forma de matéria ou energia com intensidade, concentração, tempo ou características que possam tornar o ar impróprio, nocivo ou ofensivo à saúde, inconveniente ao bem-estar público, danoso aos materiais, à fauna e à flora ou prejudicial à segurança, ao uso e gozo da propriedade e à qualidade de vida da comunidade.
De uma forma geral, a qualidade do ar é produto da interação de um complexo conjunto de fatores dentre os quais destacam-se a magnitude das emissões, a topografia e as condições meteorológicas da região, favoráveis ou não à dispersão dos poluentes.
Frequentemente, os efeitos da má qualidade do ar não são tão visíveis comparados a outros fatores mais fáceis de serem identificados. Contudo, os estudos epidemiológicos tem demonstrado, correlações entre a exposição aos poluentes atmosféricos e os efeitos de morbidade e mortalidade, causadas por problemas respiratórios (asma, bronquite, enfisema pulmonar e câncer de pulmão) e cardiovasculares, mesmo quando as concentrações dos poluentes na atmosfera não ultrapassam os padrões de qualidade do ar vigentes. As populações mais vulneráveis são as crianças, os idosos e as pessoas que já apresentam doenças respiratórias.
A poluição atmosférica traz prejuízos não somente à saúde e à qualidade de vida das pessoas, mas também acarretam maiores gastos do Estado, decorrentes do aumento do número de atendimentos e internações hospitalares, além do uso de medicamentos, custos esses que poderiam ser evitados com a melhoria da qualidade do ar dos centros urbanos. A poluição de ar pode também afetar ainda a qualidade dos materiais (corrosão), do solo e das águas (chuvas ácidas), além de afetar a visibilidade.
A gestão da qualidade do ar tem como objetivo garantir que o desenvolvimento sócio-econômico ocorra de forma sustentável e ambientalmente segura. Para tanto, se fazem necessárias ações de prevenção, combate e redução das emissões de poluentes e dos efeitos da degradação do ambiente atmosférico.
Gestão da Qualidade do Ar no Ministério do Meio Ambiente
A gestão deste tema no MMA é atribuição da Gerência de Qualidade do Ar (GQA), vinculada ao Departamento de Qualidade Ambiental na Indústria. Esta gerência foi criada com o objetivo de formular políticas e executar as ações necessárias, no âmbito do Governo Federal, à preservação e a melhoria da qualidade do ar.
A GQA tem como atribuições formular políticas de apoio e fortalecimento institucional aos demais órgãos do SISNAMA, responsáveis pela execução das ações locais de gestão da qualidade do ar, que envolvem o licenciamento ambiental, o monitoramento da qualidade do ar, a elaboração de inventários de emissões locais, a definição de áreas prioritárias para o controle de emissões, o setor de transportes, o combate às queimadas, entre outras.
Cabe ainda à GQA propor, apoiar e avaliar tecnicamente estudos e projetos relacionados com a preservação e a melhoria da qualidade do ar, implementar programas e projetos na sua área de atuação, assistir tecnicamente aos órgãos colegiados de assuntos afeitos a essa temática (CONAMA e CONTRAN), elaborar pareceres e notas técnicas sobre os assuntos de sua competência.
Entre os programas da Gerência, destacam-se os programas para fontes específicas de poluição atmosférica, tais como o PRONAR, o PROCONVE, o PROMOT e o apoio aos Estados para a elaboração dos Planos de Controle da Poluição Veicular – PCPVs e dos Programas de Inspeção e Manutenção Veicular – I/M, conforme Resolução CONAMA nº 418/2009.
Questões:
A) Defina com suas palavras o que é poluição atmosférica?
B) Quais os maiores causadores da introdução de substâncias poluentes na atmosfera
C) Quais os efeitos da má qualidade do ar?
D) Quais prejuízos que a poluição atmosférica pode causar?
1D Em duplas realizem a leitura do texto 2 “Poluentes”. Responda em seu caderno as ques-tões norteadoras preencha a tabela considerando: umidade do ar e recomendações e cui-dados em relação a atividade física, conforme modelo de tabe. Posteriormente socialize com seus colegas:
Texto 2: Poluentes.
Disponível em: https://cetesb.sp.gov.br/ar/poluentes/
Poluentes
Considera-se poluente qualquer substância presente no ar e que, pela sua concentração, possa torná-lo impróprio, nocivo ou ofensivo à saúde, causando inconveniente ao bem estar público, danos aos materiais, à fauna e à flora ou prejudicial à segurança, ao uso e gozo da propriedade e às atividades normais da comunidade.
O nível de poluição atmosférica é medido pela quantidade de substâncias poluentes presentes no ar. A variedade das substâncias que podem ser encontradas na atmosfera é muito grande, o que torna difícil a tarefa de estabelecer uma classificação. Para facilitar esta classificação, os poluentes são divididos em duas categorias:
| Poluentes Primários | Poluentes Secundários |
| aqueles emitidos diretamente pelas fontes de emissão. | aqueles formados na atmosfera através da reação química entre poluentes primários e componentes naturais da atmosfera. |
As substâncias poluentes podem ser classificadas da seguinte forma:
| Compostos de Enxofre | Compostos de Nitrogênio | Compostos Orgânicos | Monóxido de Carbono | Compostos Halogenados | Metais Pesados | Material Particulado | Oxidantes Fotoquímicos |
| SO2 | NO | hidrocarbonetos álcoois | CO | HCl | Pb | mistura de compostos no estado sólido ou líquido | O3 |
| SO3 | NO2 | aldeídos | HF | Cd | formaldeído | ||
| Compostos de Enxofre Reduzido: | NH3 | cetonas | cloretos | As | acroleína | ||
| (H2S, Mercaptanas, Dissulfeto de carbono,etc) | HNO3 | ácidos orgânicos | fluoretos | Ni | PAN | ||
| sulfatos | nitratos | etc. | etc. |
A interação entre as fontes de poluição e a atmosfera vai definir o nível de qualidade do ar, que determina por sua vez o surgimento de efeitos adversos da poluição do ar sobre os receptores, que podem ser o homem, os animais, as plantas e os materiais.
A medição sistemática da qualidade do ar é restrita a um número de poluentes, definidos em função de sua importância e dos recursos disponíveis para seu acompanhamento.
O grupo de poluentes que servem como indicadores de qualidade do ar, adotados universalmente e que foram escolhidos em razão da freqüência de ocorrência e de seus efeitos adversos, são:
Material Particulado (MP)
Material Particulado (MP), Partículas Totais em Suspensão(PTS), Partículas Inaláveis (MP10),
Partículas Inaláveis Finas (MP2,5) e Fumaça (FMC). Sob a denominação geral de Material Particulado se encontra um conjunto de poluentes constituídos de poeiras, fumaças e todo tipo de material sólido e líquido que se mantém suspenso na atmosfera por causa de seu pequeno tamanho. As principais fontes de emissão de particulado para a atmosfera são: veículos automotores, processos industriais, queima de biomassa, ressuspensão de poeira do solo, entre outros.
O material particulado pode também se formar na atmosfera a partir de gases como dióxido de enxofre (SO2), óxidos de nitrogênio (NOx) e compostos orgânicos voláteis (COVs), que são emitidos principalmente em atividades de combustão, transformando-se em partículas como resultado de reações químicas no ar.
O tamanho das partículas está diretamente associado ao seu potencial para causar problemas à saúde, sendo que quanto menores maiores os efeitos provocados.
O particulado pode também reduzir a visibilidade na atmosfera.
O material particulado pode ser classificado como:
Partículas Totais em Suspensão (PTS)
Podem ser definidas de maneira simplificada como aquelas cujo diâmetro aerodinâmico é menor ou igual a 50 µm.
Uma parte destas partículas é inalável e pode causar problemas à saúde, outra parte pode afetar desfavoravelmente a qualidade de vida da população, interferindo nas condições estéticas do ambiente e prejudicando as atividades normais da comunidade.
Partículas Inaláveis (MP10)
Podem ser definidas de maneira simplificada como aquelas cujo diâmetro aerodinâmico é menor ou igual a 10 µm. Dependendo da distribuição de tamanho na faixa de 0 a 10 µm, podem ficar retidas na parte superior do sistema respiratório ou penetrar mais profundamente, alcançando os alvéolos pulmonares.
Partículas Inaláveis Finas (MP2,5)
Podem ser definidas de maneira simplificada como aquelas cujo diâmetro aerodinâmico é menor ou igual a 2,5 µm. Devido ao seu tamanho diminuto, penetram profundamente no sistema respiratório, podendo atingir os alvéolos pulmonares.
Fumaça (FMC)
Está associada ao material particulado suspenso na atmosfera proveniente dos processos de combustão. O método de determinação da fumaça é baseado na medida de refletância da luz que incide na poeira (coletada em um filtro), o que confere a este parâmetro a característica de estar diretamente relacionado ao teor de fuligem na atmosfera.
Dióxido de Enxofre (SO2)
Resulta principalmente da queima de combustíveis que contém enxofre, como óleo diesel, óleo combustível industrial e gasolina. É um dos principais formadores da chuva ácida. O dióxido de enxofre pode reagir com outras substâncias presentes no ar formando partículas de sulfato que são responsáveis pela redução da visibilidade na atmosfera.
Monóxido de Carbono (CO)
É um gás incolor e inodoro que resulta da queima incompleta de combustíveis de origem orgânica (combustíveis fósseis, biomassa, etc). Em geral é encontrado em maiores concentrações nas cidades, emitido principalmente por veículos automotores. Altas concentrações de CO são encontradas em áreas de intensa circulação de veículos.
Oxidantes Fotoquímicos, como o Ozônio (O3)
“Oxidantes fotoquímicos” é a denominação que se dá à mistura de poluentes secundários formados pelas reações entre os óxidos de nitrogênio e compostos orgânicos voláteis, na presença de luz solar, sendo estes últimos liberados na queima incompleta e evaporação de combustíveis e solventes. O principal produto desta reação é o ozônio, por isso mesmo utilizado como parâmetro indicador da presença de oxidantes fotoquímicos na atmosfera. Tais poluentes formam a chamada névoa fotoquímica ou “smog fotoquímico”, que possui este nome porque causa na atmosfera diminuição da visibilidade.Além de prejuízos à saúde, o ozônio pode causar danos à vegetação. É sempre bom ressaltar que o ozônio encontrado na faixa de ar próxima do solo, onde respiramos, chamado de “mau ozônio”, é tóxico. Entretanto, na estratosfera (a cerca de 25 km de altitude) o ozônio tem a importante função de proteger a Terra, como um filtro, dos raios ultravioletas emitidos pelo Sol.
Compostos Orgânicos Voláteis (COVs)
São gases e vapores resultantes da queima incompleta e evaporação de combustíveis e de outros produtos orgânicos, sendo emitidos pelos veículos, pelas indústrias, pelos processos de estocagem e transferência de combustível, etc. Muitos destes compostos, participam ativamente das reações de formação do ozônio.
Dentre os compostos orgânicos voláteis presentes nas atmosferas urbanas estão os compostos aromáticos monocíclicos, em particular: benzeno, tolueno, etil-benzeno e xilenos. Os aromáticos monocíclicos são precursores do ozônio e alguns destes compostos podem causar efeitos adversos à saúde.
Óxidos de Nitrogênio (NOx)
São formados durante processos de combustão. Em grandes cidades, os veículos geralmente são os principais responsáveis pela emissão dos óxidos de nitrogênio. O NO, sob a ação de luz solar se transforma em NO2 e tem papel importante na formação de oxidantes fotoquímicos como o ozônio. Dependendo das concentrações, o NO2 causa prejuízos à saúde
Além destes poluentes que servem como indicadores de qualidade do ar, a CETESB monitora outros parâmetros, como por exemplo, o chumbo, regulamentado conforme o Decreto Estadual nº 59.113 DE 23/04/2013.
Chumbo
No passado, os veículos eram o principal contribuinte de emissões de chumbo para o ar. O Brasil foi, em 1989, um dos primeiros países a retirar o chumbo de sua gasolina automotiva, sendo este totalmente eliminado em 1992. Essa conquista deu-se graças à substituição do chumbo pelo álcool como aditivo à gasolina. Como consequência, a concentração de chumbo na atmosfera das áreas urbanas diminuiu significativamente. Atualmente o chumbo é encontrado em maior quantidade em locais específicos como próximo a fundições de chumbo e indústrias de fabricação de baterias chumbo-ácido.
A CETESB monitora também os compostos de Enxofre Reduzido Total (ERT).
Enxofre Reduzido Total (ERT)
Sulfeto de hidrogênio, metil-mercaptana, dimetil-sulfeto, dimetil-dissulfeto, são, de maneira geral, os compostos de enxofre reduzido mais freqüentemente emitidos em operações de refinarias de petróleo, fábricas de celulose, plantas de tratamento de esgoto e produção de rayon-viscose, entre outras. As demais espécies de enxofre reduzido são encontradas em maior quantidade perto de locais específicos. O dissulfeto de carbono, por exemplo, é usado na fabricação de rayon-viscose e celofane.
Os compostos de enxofre reduzido também podem ocorrer naturalmente no ambiente como resultado da degradação microbiológica de matéria orgânica contendo sulfatos, sob condições anaeróbias, e como resultado da decomposição bacteriológica de proteínas.
Estes compostos produzem odor desagradável, semelhante ao de ovo podre ou repolho, mesmo em baixas concentrações.
Condições Meteorológicas
A concentração de poluentes está fortemente relacionada às condições meteorológicas. Alguns dos parâmetros que favorecem altos índices de poluição são: alta porcentagem de calmaria, ventos fracos e inversões térmicas a baixa altitude. Este fenômeno é particularmente comum no inverno paulista, quando as noites são frias e a temperatura tende a se elevar rapidamente durante o dia, provocando alteração no resfriamento natural do ar.
A inversão térmica se caracteriza por uma camada de ar quente que se forma sobre a cidade, “aprisionando” o ar e impedindo a dispersão dos poluentes.
Problemas decorrentes da baixa umidade do ar e da alta concentração de poluentes.
No inverno, freqüentemente ocorrem dias com baixa umidade do ar e alta concentração de poluentes. Nessas condições, é comum ocorrerem complicações respiratórias devido ao ressecamento das mucosas, provocando sangramento pelo nariz, ressecamento da pele e irritação dos olhos.
Quando a umidade relativa do ar estiver entre 20 e 30%, é melhor evitar exercícios físicos ao ar livre entre 11 e 15 horas; umidificar o ambiente através de vaporizadores, toalhas molhadas, recipientes com água, umidificação de jardins etc; sempre que possível permanecer em locais protegidos do sol ou em áreas arborizadas.
Se a umidade estiver entre 20 e 12%, é recomendável suspender exercícios físicos e trabalhos ao ar livre entre 10 e 16 horas; evitar aglomerações em ambientes fechados; e seguir as orientações anteriores.
Mas, se a umidade for menor do que 12% é preciso interromper qualquer atividade ao ar livre entre 10 e 16 horas; determinar a suspensão de atividades que exijam aglomerações de pessoas em recintos fechados; manter umidificados os ambientes internos, principalmente quartos de crianças, hospitais etc.
Além dessas medidas é recomendável usar colírio de soro fisiológico ou água boricada para os olhos e narinas e beber muita água.
a) O que é considerado poluente?
b) Como é realizado a medida o nível de poluição na atmosfera?
c) Qual a influência das condições meteorológicas na concentração de poluentes?
d) Descreva a relação entre a umidade do ar e os cuidados com a prática de atividades físicas.
| Umidade do ar (%) | Recomendações e cuidados em relação a atividade física. |
| 20% a 30% | Melhor evitar exercícios físicos ao ar livre entre 11 e 15 horas; umidificar o ambiente através de vaporizadores, toalhas molhadas, recipientes com água, umidificação de jardins etc. |
| 20% e 12% | É recomendável suspender exercícios físicos e trabalhos ao ar livre entre 10 e 16 horas; evitar aglomerações em ambientes fechados. |
| menor que 12% | É preciso interromper qualquer atividade ao ar livre entre 10 e 16 horas; determinar a suspensão de atividades que exijam aglomerações de pessoas em recintos fechados; manter umidificados os ambientes internos, principalmente quartos de crianças, hospitais etc. |
e) Faça uma análise da resposta do item “d” e descreva quais aspectos pode contribuir para uma melhor qualidade de vida.
1E Faça uma pesquisa sobre a composição do ar atmosférico (oxigênio, nitrogênio e gases nobres) e suas respectivas temperaturas de liquefação e fusão. Registre suas respostas e socialize com seus colegas.
https://brasilescola.uol.com.br/biologia/composicao-do-ar.htm
Composição do ar
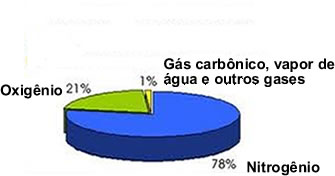
Os gases que fazem parte da composição do ar são em sua maioria o oxigênio e o nitrogênio. O ar é composto também por gás carbônico, gases nobres e vapor de água.
O ar atmosférico é constituído por uma mistura de diversos gases, como o nitrogênio, oxigênio, gás carbônico e gases nobres. O oxigênio e o nitrogênio são os gases mais abundantes, sendo que os outros gases são encontrados em quantidades menores. Além dos gases citados, o ar atmosférico também apresenta vapor de água (cuja quantidade depende de alguns fatores como clima, temperatura e local), que se apresenta na forma de neblina, nuvens e chuva. No ar também encontramos em suspensão poluentes, poeira, cinzas, microrganismos e pólen.
O oxigênio (O2) presente no ar atmosférico é de extrema importância para a manutenção da vida no planeta, pois ele é o gás utilizado na respiração de todos os seres vivos e também é necessário para que ocorra a combustão. Calcula-se que o ar atmosférico seja composto por aproximadamente 21 % de oxigênio.
O gás carbônico (CO2) é encontrado em proporções muito pequenas na atmosfera, contribuindo com apenas 0,03% da composição do ar. É um gás de extrema importância para a realização da fotossíntese pelos vegetais, e é liberado para a atmosfera através da combustão e também pela respiração dos animais.
Dentre os gases nobres que fazem parte da composição do ar podemos citar: argônio (Ar), neônio (Ne), radônio (Rn), hélio (He), criptônio (Kr) e xenônio (Xe), sendo que eles compõem cerca de 0,93% do ar atmosférico. Esses gases não produzem nenhum tipo de reação química com outras substâncias e por isso são considerados nobres.
O vapor de água que também participa da composição do ar provém da evaporação das águas de rios, mares e lagos, respiração dos seres vivos, transpiração das plantas, evaporação da água do solo e evaporação da água de dejetos (fezes e urina de animais).
O ar atmosférico é composto por uma mistura de gases, sendo eles: nitrogênio, oxigênio, gás carbônico e gases nobres.
1F Com a orientação de seu professor realize, em grupos, uma pesquisa sobre o uso industrial dos gases que compõe o ar atmosférico. Desenvolva os questionamentos abaixo e sociali-ze com os colegas:
a) Qual a utilização e aplicação dos gases que compõe o ar atmosférico (oxigênio, nitrogênio e xenônio)?
Oxigênio: é utilizado em todos campos da indústria e pesquisa, na fabricação de aço, solda, corte e produtos químicos, no tratamento de esgotos, em tratamentos médicos, fábricas de vidro, fábricas de papel e até como gás oxidante para combustível de foguetes.
b) Como os gases são separados para serem utilizados?
Nitrogênio: tem utilização garantida na fabricação de aço e semicondutores, na indústria química e de análise, na purga de linhas e tanques, entre outros.
Xenônio: o uso principal e mais famoso deste gás é na fabricação de dispositivos emissores de luz, tais como lâmpadas bactericidas, tubos eletrônicos, lâmpadas estroboscópicas e flashes fotográficos.
1G Assistir ao Vídeo 1 sobre o funcionamento da coluna de destilação. Individualmente res-ponder as questões da tabela e construa um esquema em seu caderno, cartolina ou ainda no computador para projeção, após a realização da atividade socialize com os colegas.
Vídeo 1: Criogenia – Como funcionam as colunas de destilação fracionada do ar. Disponível em: https://www.youtube.com/watch?v=S4W7ghsOGrQ
QUESTÕES NORTEADORAS
O que são líquidos criogênicos? E quais são eles?
Descrever o procedimento da separação fracionada dos gases.
Como se dá seu transporte e armazenamento dos líquidos criogênicos?
Construir o esquema da coluna de destilação, indicando a entrada dos gases e como os gases são dispostos nas bandejas.
1H Realizar a leitura sugerida no Texto 3 “Histórico da medição da qualidade do ar em São Paulo”. Disponível em: https://cetesb.sp.gov.br/ar/
Elabore um resumo destacando as ideias principais com foco nas questões da e socialize com seus colegas.
Histórico da medição da qualidade do ar em São Paulo
Poluente atmosférico é toda e qualquer forma de matéria ou energia com intensidade e em quantidade, concentração, tempo ou características em desacordo com os níveis estabelecidos em legislação, e que tornem ou possam tornar o ar impróprio, nocivo ou ofensivo à saúde, inconveniente ao bem-estar público, danoso aos materiais, à fauna e à flora ou prejudicial à segurança, ao uso e gozo da propriedade e às atividades normais da comunidade.
A relação entre efeitos à saúde e poluição atmosférica foi estabelecida a partir de episódios agudos de contaminação do ar e estudos sobre a ocorrência do excesso de milhares de mortes registradas em Londres, em 1948 e 1952. No caso da Região Metropolitana de São Paulo – RMSP, o crescimento desordenado verificado na Capital e nos municípios vizinhos, especialmente da região do ABC, a partir da 2ª Guerra Mundial, levou à instalação de indústrias de grande porte, sem a preocupação com o controle das emissão de poluentes atmosféricos, sendo possível a visualização de chaminés emitindo enormes quantidades de fumaça.
Há registros em jornais da década de 60 e especialmente de 70, de episódios agudos de poluição do ar que levaram a população ao pânico devido aos fortes odores, decorrentes do excesso de poluentes lançados pelas indústrias na atmosfera, causando mal-estar e lotando os serviços médicos de emergência. Esse crescimento rápido e desordenado levou, no início dos anos 60, à criação da Comissão Intermunicipal de Controle da Poluição das Águas e do Ar – CICPAA, envolvendo os municípios de Santo André, São Bernardo do Campo, São Caetano do Sul e Mauá. As medições de poluentes na atmosfera restringiam-se às taxas mensais de sulfatação, poeira sedimentável e corrosividade. As atividades da CICPAA, no início da década de 70, foram incorporadas pela Superintendência de Saneamento Ambiental – SUSAM, vinculada à Secretaria de Saúde do Estado de São Paulo e, em 1975, transferidas à CETESB.
O monitoramento da qualidade do ar, com a avaliação das concentrações de poluentes no Estado de São Paulo, foi iniciado na Região Metropolitana de São Paulo, em 1972, com a instalação de 14 estações para medição diária dos níveis de dióxido de enxofre (SO2) e fumaça preta. Nessa época, a qualidade do ar passou a ser divulgada diariamente à população por meio de boletins encaminhados à imprensa. Parte das estações, denominadas manuais, continuam sendo utilizadas pela CETESB no monitoramento da qualidade do ar.
Em 1981, foi dado um salto qualitativo, com o início do monitoramento automático e a instalação de novas estações, para a avaliação de SO2, material particulado inalável (MP10), ozônio (O3), óxidos de nitrogênio – (NO, NO2 e NOx), monóxido de carbono – (CO) e hidrocarbonetos não-metânicos – (NMHC),além dos parâmetros meteorológicos como direção e velocidade do vento, temperatura e umidade relativa do ar.
Os resultados dos monitoramento passaram a ser acompanhados de hora em hora, em uma central, que recebia as informações de todas as estações. Em 2000, o monitoramento automático foi ampliado para algumas cidades do interior do Estado e a partir de 2008 vem sofrendo expansão significativa.
Além da medição diária desses poluentes, atualmente, a CETESB realiza estudos sobre outros poluentes, dentre os quais se destacam o chumbo, aldeídos e compostos reduzidos de enxofre, além de estudos específicos, alguns dos quais, em parceria com a Universidade de São Paulo – USP.
Programas de Controle de Emissão dos Poluentes e Resultados
Entre 1975 e 1976, embora o Estado de São Paulo não possuísse uma legislação adequada para que a CETESB pudesse atuar de forma efetiva no controle das diversas fontes, desenvolveu-se uma intensa atividade para o levantamento das fontes de emissões atmosféricas industriais e outras ações em um programa denominado “Operação Branca”.
Após a consolidação dos dados de emissão e com a promulgação da Lei 997/76 e seu regulamento aprovado pelo Decreto 8.468/76, a CETESB aplicou, no final da década de 70, um programa para redução das emissões industriais de material particulado e, no início dos anos 80, um programa para redução das emissões de SO2.
Ainda na década de 80, foram registradas reduções significativas dos níveis de SO2 na atmosfera da RMSP. Concomitantemente, a CETESB, na década de 70, motivada pelas condições meteorológicas desfavoráveis à dispersão atmosférica durante o inverno, desenvolveu a chamada “Operação Inverno”, no período de maio a agosto, e estendida posteriormente até final de setembro. Para tanto, os maiores consumidores de óleo nas regiões críticas de poluição, RMSP (Região Metropolitana de São Paulo. Reúne 39 municípios do estado de São Paulo em intenso processo de conurbação) e Cubatão, foram obrigados a utilizar óleo com baixo teor de enxofre.
Nesse período, a CETESB intensificava a vigilância sobre as empresas envolvidas na operação e, quando a rede de monitoramento da qualidade do ar mostrava altas concentrações de poluentes, era solicitada às fontes situadas nas áreas em que o padrão de qualidade do ar foi ultrapassado, a melhora do desempenho de seus equipamentos e, se necessário, que reduzissem sua produção. Houve casos, como o ocorrido na atmosfera de Vila Parisi, em Cubatão, em que foram atingidos níveis altíssimos de concentração de material particulado no ar, que levaram à redução e mesmo à paralisação de atividades de várias indústrias. Também no inverno, as ações de controle sobre a emissão de fumaça preta por veículos a diesel foram intensificadas, visando a redução das emissões.
A partir da metade da década de 70, a CETESB detectou altos níveis de monóxido de carbono (CO) na região central da cidade de São Paulo provocada pelas altas emissões dos carros movidos a gasolina. Ainda na metade dessa década, a CETESB passou a desenvolver estudos para avaliar as emissões veiculares provenientes da adição de etanol à gasolina, verificando que essa mistura de combustíveis contribuía para a diminuição da emissão de CO.
Com a adição do etanol à gasolina, ocorrido no início dos anos 80, em substituição ao chumbo tetraetila, os veículos deixaram de emitir chumbo na atmosfera da RMSP e, consequentemente, os níveis desse poluente na atmosfera, segundo avaliação da CETESB, em 1983, mostravam uma diminuição acentuada em comparação com os níveis de 1978.
Durante os anos 80, a CETESB desenvolveu as bases técnicas que culminaram com a Resolução nº 18/86 do CONAMA – Conselho Nacional do Meio Ambiente, que estabeleceu o Programa de Controle da Poluição do Ar por Veículos Automotores – PROCONVE, posteriormente complementada por outras Resoluções CONAMA. Essas ações resultaram na redução significativa de emissão dos poluentes emitidos pelos veículos automotores. No final da década de 90, a CETESB, por meio de sua rede de monitoramento da qualidade do ar, registrava quedas dos níveis de CO na atmosfera da RMSP.
Complementando as ações do PROCONVE, iniciou-se o controle das emissões das motocicletas com a publicação da Resolução CONAMA nº 297/02, que estabeleceu o Programa de Controle da Poluição do Ar por Motociclos e Veículos Similares – PROMOT, posteriormente complementada pela Resolução CONAMA nº 342/03.
Outras informações e detalhes sobre os programas de controle da poluição gerada por veículos podem ser encontradas na guia Emissão Veicular.Qualidade do Ar – 2020Cetesb – Companhia Ambiental do Estado de São Paulo
Av. Prof. Frederico Hermann Jr., 345 – São Paulo – SP
PABX: + 55 11 3133.3000
QUESTÕES NORTEADORAS
Explique quais fatores de mudanças se deram em relação ao monitoramento da qualidade do ar nos anos de 1972 e 1981.
Qual o significado da sigla PROCONVE?
Explique como ocorreu a evolução do monitoramento por meio da CETESB?
Quais as consequências se não houvesse um monitoramento da qualidade do ar?
1I Assistir o vídeo 2 “Mudanças climáticas”. Escreva as ideias principais com referência nos questionamentos contidos na tabela e compartilhe com seus colegas. Vídeo 2: Mudanças climáticas. Disponível em: https://www.youtube.com/watch?v=ssvFqYSlMho
QUESTÕES NORTEADORAS RESPOSTAS
a) Por que devemos preocupar com as mudanças climáticas?
b) Há benefícios no efeito estufa? Explique.
c) As mudanças climáticas são causadas pelo homem, quais ações contribuem para estas mudanças?
d) Quais impactos o aquecimento global pode causar?
e) Descreva qual o possível cenário se houver a continuidade da emissão de gases poluentes?
f) Quais a ações importantes que você pode passar a diante?
1J Assistir o Vídeo 3 “Mudanças ambientais globais”. Escreva as ideias principais com referência nos questionamentos a seguir e compartilhe com seus colegas.
Disponível em: https://www.youtube.com/watch?v=QCwXuEBDcU0
1) O que são mudanças climáticas?
2) Onde estão associadas ao homem?
3) Observe a afirmação “O vídeo demonstra alguns aspectos significativos em relação aos cenários de aumento médio de temperatura e do nível do mar”, a que se atribui este fato. Justifique.
1L Retome as suas hipóteses construídas no item 1.B e verifique e/ou reelabore suas ideias para a construção das considerações finais.
Habilidades envolvidas na atividade 1:
- Reconhecer que o ar atmosférico é uma mistura de gases;
- Reconhecer que o ar atmosférico pode ser utilizado como matéria-prima para a indústria;
- Compreender que para o ar ser utilizado, deve passar pelo processo de destilação fracionada;
- Compreender o funcionamento de uma coluna de destilação.
ATIVIDADE 2: EQUILÍBRIO QUÍMICO
2A Reflita sobre as seguintes situações-problema:
- Por que o refrigerante gelado tem mais gás que o refrigerante em temperatura ambiente?
- Por que o refrigerante dá sensação de estufamento no estômago?
- Diminuição da pressão:
- Aumento da temperatura:
Por que quem tem gastrite não pode tomar refrigerante?
Saiba o que acontece dentro do corpo após tomar refrigerante
Michelle Achkar
É sabido que não faz bem à saúde tomar refrigerantes em excesso. A bebida não contém nenhum valor nutricional e está repleta de cafeína, corantes e conservantes, além de altas taxas de açúcar. As versões light, apesar de estarem livres da substância, contêm adoçantes artificiais, cujo consumo também não traz benefícios ao corpo.
Os refrigerantes produzem uma verdadeira revolução no organismo e, em apenas uma hora, conseguem alterar a pressão, levar embora nutrientes essenciais para o organismo e ainda ajudam o corpo a acumular gordura. Saiba o que acontece desde o momento que a bebida entra na boca, até 60 minutos depois, segundo a nutricionista Andrezza Botelho, de São Paulo.
Primeiros 10 minutos: quando se toma uma lata de refrigerante (350 ml), cerca de 10 colheres de chá de açúcar chegam ao estômago, quantidade que corresponde a 100% do que é recomendado diariamente. O doce seria extremo e poderia causar até vômitos, mas isso não acontece devido à presença do ácido fosfórico que reduz esse gosto.
20 minutos: o nível de açúcar no sangue está em excesso, forçando uma grande liberação de insulina pelo pâncreas, hormônio que facilita a entrada da energia em nossas células. Como há uma descarga grande de açúcar, ácido fosfórico e inúmeras toxinas, o fígado fica sobrecarregado, transformando o açúcar que recebe em gordura.
40 minutos: a absorção da cafeína presente na bebida está completa. As pupilas dilatam, a pressão sanguínea sobe, o fígado responde bombeando mais açúcar no sangue. Os receptores de adenosina, que controla a energia no organismo, no cérebro são bloqueados para evitar tonturas.
45 minutos: o corpo aumenta a produção do neurotransmissor dopamina, estimulando os centros de prazer do corpo. Fisicamente é a mesma reação provocada pela heroína.
50 minutos: o ácido fosfórico empurra cálcio, magnésio e zinco para o intestino grosso, acelerando o metabolismo. As altas doses de açúcar e outros adoçantes aumentam a excreção de cálcio na urina.
60 minutos: as propriedades diuréticas da cafeína entram em ação. Você urina. Agora é garantido que eliminará cálcio, magnésio e zinco, nutrientes essenciais para o funcionamento de vários órgãos, como coração, e ossos. Conforme vai reduzindo a satisfação proporcionada pelo açúcar e cafeína, inicia-se uma queda dos níveis de açúcar no sangue. Você começa a ficar irritadiço ou sonolento.
2B Após a discussão, registre as suas ideias e hipóteses com relação a cada situação-problema e socialize com os colegas.
2C Leia o Texto 1 “A Química do Refrigerante”. Elabore um resumo com as ideias principais com referência nas questões abaixo e socialize com os colegas.
http://qnesc.sbq.org.br/online/qnesc31_3/10-PEQ-0608.pdf
Questões:
A) Quais são os ingredientes que compõem a formulação do refrigerante?
B) Sintetize as etapas da fabricação do refrigerante.
C) O que difere o processo de fabricação do Xarope simples do composto?
D) Explique se há ou não interferência na qualidade do refrigerante se envasado em embalagem PET, alumínio ou vidro?
E)Por meio de quais sentidos a análise sensorial interpreta as reações às características dos alimentos?
Texto 1: Química Nova na Escola. A Química do Refrigerante. Disponível em:
Pesquisa no Ensino de Química
A Química do Refrigerante
Ana Carla da Silva Lima e Júlio Carlos Afonso
Este trabalho aborda a produção de refrigerantes, descrevendo a função de cada um de seus componentes. Sua fabricação exige um rigoroso controle a fim de assegurar a qualidade de um produto destinado ao consumo humano. O refrigerante também se presta para diversas experiências em sala de aula, envolvendo a análise sensorial, a solubilidade de gases em líquidos e as reações em meio ácido. refrigerante, gases, análise sensorial
Concentrados: Conferem o sabor característico à bebida. São compostos por extratos, óleos essenciais e destilados de frutas e vegetais (Palha, 2005). Sabor é a experiência mista de sensações olfativas, gustativas e táteis percebidas durante a degustação (Goretti, 2005).
Acidulante: Regula a doçura do açúcar, realça o paladar e baixa o pH da bebida, inibindo a proliferação de micro organismos. Todos os refrigerantes possuem pH ácido (2,7 a 3,5 de acordo com a bebida). Na escolha do acidulante (Tabela 1), o fator mais importante é a capacidade de realçar o sabor em questão (Palha, 2005).
O ácido cítrico (INS1 330) é obtido a partir do micro organismo Asper-gillus niger, que transforma diretamente a glicose em ácido cítrico. Os refrigerantes de limão já o contêm na sua composição normal.
O ácido fosfórico (INS 338) apresenta a maior acidez dentre todos aqueles utilizados em bebidas. É utilizado principalmente nos refrigerantes do tipo cola.
O ácido tartárico (INS 334) é usado nos refrigerantes de sabor uva
por ser um dos seus componentes naturais.
Antioxidante: Previne a influência negativa do oxigênio na bebida. Aldeídos, ésteres e outros componentes do sabor são susceptíveis a oxidações pelo oxigênio do ar durante a estocagem. Luz solar e calor aceleram as oxidações. Por isso, os refrigerantes nunca devem ser expostos ao sol. Os ácidos ascórbico e isoascórbico (INS são muito usados para essa finalidade. Quando o primeiro é utilizado não é com o objetivo de conferir vitamina C ao refrigerante, e sim servir unicamente como antioxidante.
Conservante: Os refrigerantes estão sujeitos à deterioração causa-da por leveduras, mofos e bactérias (micro organismos acidófilos ou ácido-tolerantes), provocando turvações e alterações no sabor e odor. O conservante (Tabela 2) visa inibir o desenvolvimento desses micro organismos (Palha, 2005).
O ácido benzoico (INS 211) atua praticamente contra todas as espécies de micro organismos. Sua ação máxima é em pH = 3. É barato e bem tolerado pelo organismo. Como esse ácido é pouco solúvel em água,
- utilizado na forma de benzoato de sódio. O teor máximo permitido no Brasil é de 500 mg/100 mL de refrigerante (expresso em ácido benzoico).
O ácido sórbico (INS 202) ocorre no fruto da Tramazeira (Sorbus aucuparia). É usado como sorbato de potássio e atua mais especificamente sobre bolores e leveduras. Sua ação máxima é em pH = 6. O teor máximo permitido é 30 mg/100 mL (expresso em ácido sórbico livre).
Edulcorante: É uma substância(Tabela 3) que confere sabor doce às bebidas em lugar da sacarose. As bebidas de baixa caloria (diet) seguem os padrões de identidade e qualidade bebidas correspondentes, com exceção do teor calórico.
Dióxido de carbono: A carbonatação dá “vida” ao produto, realça o paladar e a aparência da bebida. Sua ação refrescante está associada à solubilidade dos gases em líquidos, que diminui com o aumento da temperatura. Como o refrigerante é tomado gelado, sua temperatura aumenta do trajeto que vai da boca ao estômago. O aumento da temperatura e o meio ácido estomacal favorecem a eliminação do CO2, e a sensação de frescor resulta da expansão desse gás, que é um processo endotérmico (Palha, 2005).
Tabela 1: Acidulantes empregados na manufatura de refrigerantes.
| Acidulante | Estrutura | pKa | |
| Ácido cítrico (Ácido 2-hidroxi-1,2,3- | pKa1 = 3,09 | ||
| pKa2 | = 4,74 | ||
| propanotricarboxílico) (C6H8O7) | |||
| pKa3 | = 5,41 | ||
| Ácido fosfórico (H3PO4) | pKa1 | ||
| pKa2 | = 7,20 | ||
| pKa3 | |||
| Ácido tartárico (Ácido 2,3-diidroxi- | pKa1 | ||
| butanodioico) (C4H6O6) | pKa2 | ||
| Tabela 2: Conservantes encontrados em refrigerantes. | |||
| Conservante | Estrutura | pKa | |
| pK = 4,19 |
| Benzoato de sódio (C7H5O2Na) | (ácido benzoico) | |
| Sorbato de potássio (C6H7O2K) | pKa = 4,75 | |
| (ácido sórbico) |
Processo de fabricação
O processo de fabricação é feito sem qualquer contato manual e sob rigoroso controle de qualidade duran-te todas as etapas.
Elaboração do xarope simples: É o produto da dissolução do açúcar em água. A concentração varia entre 55 e 64% m/m (Rodrigues e cols., 2000). A dissolução do açúcar cristal em água quente reduz o risco de contaminação microbiana. O xarope é tratado com carvão ativado, que por adsorção remove compostos responsáveis
Tabela 3: Edulcorantes utilizados no processamento de refrigerantes diet e suas principais características.
| Nome | Poder adoçante (sacarose = 1) | Ingestão máxima diária (mg/kg peso corporal) | Estrutura |
| Sacarina | 300-400 | 5,0 | (C7H5NSO3) |
| Ciclamato de sódio | 50 | 11,0 | C6H12NSO3Na) |
| Aspartame* | 200 | 40,0 | (C14H18N2O5) |
| Acesulfame-K | 200 | 15,0 | (C4H4NSO4K) |
* Não resiste ao calor (alimentos com aspartame não devem ser aquecidos)
As embalagens PET tendem a ter menor validade devido à sua maior porosidade frente ao vidro e ao alumínio, levando à perda de CO2 em menos tempo.
Elaboração do xarope simples: É o produto da dissolução do açúcar em água. A concentração varia entre 55 e 64% m/m (Rodrigues e cols., 2000). A dissolução do açúcar cristal em água quente reduz o risco de contaminação microbiana. O xarope é tratado com carvão ativado, que por adsorção remove compostos responsáveis por paladares e odores estranhos e reduz a cor desse xarope. Ele é armazenado em tanques esterilizados a vapor, e um filtro microbiológico evita a entrada de ar.
Elaboração do xarope composto: É o xarope simples acrescido dos outros componentes do refrigerante. Essa etapa é feita em tanques de aço inoxidável, equipados com agitador, de forma a garantir a perfeita homogeneização dos componentes e evitar a admissão de ar. A adição dos ingredientes deve ocorrer de forma lenta e cuidadosa e de acordo com a sequência estabelecida na formulação. O conservante é o primeiro componente a ser adicionado. Em caso de adição após o acidulante, forma-se uma floculação irreversível (o benzoato de sódio precipita). A adição do antioxidante ocorre minutos antes da adição do concentrado. Concluídas as adições, mantém-se o agitador ligado por 15 minutos. Ao final, retira-se uma amostra para as análises microbiológicas e físico-químicas (como turbidez, acidez e dosagem de açúcar ou edulcorante). Somente após essas análises, o xarope pode ser liberado para o envasamento. A preparação do xarope composto para bebidas do tipo diet ocorre em tanques específicos para tal. Elas possuem baixa susceptibilidade à contaminação por micro organismos por não conter açúcares. Envasamento: Para as garrafas retornáveis, há uma inspeção prévia o xarope pode ser liberado para envasamento (Palha, 2005). A preparação do xarope composto para bebidas do tipo diet ocorre em tanques específicos para tal. Elas possuem baixa susceptibilidade à contaminação por micro organismos por não conter açúcares. Envasamento: Para as garrafas retornáveis, há uma inspeção prévia as garrafas são pré-lavadas com água. Elas depois são imersas em soda cáustica quente para retirada de impurezas e esterilização. Em seguida, passam pelo enxágue final com água. Uma nova inspeção e seleção são feitas nessa fase. No caso das embalagens descartáveis, não há necessidade da pré lavagem. A etapa final consiste no envio, por tubulações de aço inox, do xarope composto até a linha de envasamento (enchedora), na qual são adicionados água e CO2 em proporções adequadas a cada produto. O refrigerante é envasado em baixa temperatura (3 a 12 ºC) e sob pressão para assegurar uma elevada concentração de CO2 no produto. As linhas de CO2 têm um filtro microbiológico e são esterilizadas a vapor. Após o enchimento, a garrafa é imediatamente arrolhada e codificada com data de validade, hora e linha de envasamento. O lacre e o nível de enchimento das garrafas são inspecionados. O ar é uma contaminação nas bebidas carbonatadas. Ele deve ser eliminado ou mantido ao mínimo. Isso se consegue trabalhando com água desaerada e desclorada e mantendo o nível do líquido em níveis corretos na embalagem. Piso, paredes, superfícies externas dos equipamentos e esteiras devem ser periodicamente tratados com desinfetante ou água quente.
Refrigerante é uma bebida não alcoólica, carbonatada, com alto poder refrescante encontra da em diversos sabores. O vocábulo “tubaína”, empregado no interior do Brasil, é sinônimo de refrigerante regional e local. A indústria de refrigerante surgiu em 1871 nos Estados Unidos. No Brasil, os primeiros registros remontam a 1906, mas somente na década de 1920 é que o refrigerante entrou definitivamente no cotidiano dos brasileiros (ABIR, 2007). Em 1942, no Rio de Janeiro, foi instalada a primeira fábrica. O Brasil é o terceiro produtor mundial de refrigerantes, depois dos Estados Unidos e México. Contudo, o consumo per capita é da ordem de 69 L por habitante por ano, o que coloca o país em 28º lugar nesse aspecto. A Coca-Cola e a Pepsi detêm ¾ do mercado mundial, avaliado em cerca de US$ 66 bilhões anuais (Rosa e cols., 2006). Entre 1988 e 2004, o mercado nacional cresceu 165%, verificando-se também um aumento da participação de refrigerantes regionais (de 9% para 32%). A Coca-Cola e a Companhia de Bebidas das Américas (AmBev) detinham, em 2004, 68% do mercado (Rosa e cols., 2006).
Composição do refrigerante
Os ingredientes que compõem a formulação do refrigerante têm
finalidades específicas e devem se enquadrar nos padrões estabelecidos. São eles:
Água: Constitui cerca de 88% m/m do produto final.
Ela precisa preencher certos requisitos para ser empregada na manufatura de refrigerante (Palha, 2005):
– Baixa alcalinidade: Carbonatos e bicarbonatos interagem com ácidos orgânicos, como ascórbico e cítrico, presentes na formulação, alterando o sabor do refrigerante, pois reduzem sua acidez e provocam perda de aroma; também um aumento da participação de refrigerantes regionais (de 9% para 32%). A Coca-Cola e a Companhia de Bebidas das Américas (AmBev) detinham, em 2004, 68% do mercado (Rosa e cols., 2006).
– Sulfatos e cloretos: Auxiliam na definição do sabor, porém o excesso é prejudicial, pois o gosto ficará demasiado acentuado;
– Cloro e fenóis: O cloro dá um sabor característico de remédio e provoca reações de oxidação e despigmentação, alterando a cor original do refrigerante.
Os fenóis transferem seu sabor típico, principalmente quando combinado com o cloro (clorofenóis);
– Metais: Ferro, cobre e manganês aceleram reações de oxidação, as características desejadas: límpida, inodora e livre de micro organismos. Açúcar: É o segundo ingrediente em quantidade (cerca de 11% m/m). Ele confere o sabor adocicado, “encorpa” o produto, juntamente com o acidulante, fixa e realça o paladar e fornece energia. A sacarose (dissacarídeo de fórmula C12H22O11 – glicose + frutose) é o açúcar comumente usado (açúcar cristal).
– Padrões microbiológicos: É necessário um plano de higienização e controle criterioso na unidade industrial, que garantam à água todas as características desejadas: límpida, inodora e livre de micro organismos. Açúcar: É o segundo ingrediente em quantidade (cerca de 11% m/m).
Ele confere o sabor adocicado, “encorpa” o produto, juntamente com o acidulante, fixa e realça o paladar e fornece energia. A sacarose (dissacarídeo de fórmula C12H22O11 – glicose + frutose) é o açúcar comumente usado (açúcar cristal).
Concentrados: Conferem o sabor característico à bebida. São compostos por extratos, óleos essenciais e destilados de frutas e vegetais (Palha, 2005). Sabor é a experiência mista de sensações olfativas, gustativas e táteis percebidas durante a degustação (Goretti, 2005).
Acidulante: Regula a doçura do açúcar, realça o paladar e baixa o pH da bebida, inibindo a proliferação de micro organismos. Todos os refrigerantes possuem pH ácido (2,7 a 3,5 de acordo com a bebida). Na escolha do acidulante (Tabela 1), o fator mais importante é a capacidade de realçar o sabor em questão (Palha, 2005).
O ácido cítrico (INS1 330) é obtido a partir do micro organismo Aspergillus niger, que transforma direta-mente a glicose em ácido cítrico. Os refrigerantes de limão já o contêm na sua composição normal.
O ácido fosfórico (INS 338) apre-senta a maior acidez dentre todos aqueles utilizados em bebidas. É utilizado principalmente nos refrigerantes do tipo cola.
O ácido tartárico (INS 334) é usa-do nos refrigerantes de sabor uva
por ser um dos seus componentes naturais.
Antioxidante: Previne a influência negativa do oxigênio na bebida. Aldeídos, ésteres e outros componentes do sabor são susceptíveis a
oxidações pelo oxigênio do ar durante a estocagem. Luz solar e calor aceleram as oxidações. Por isso, os refrigerantes nunca devem ser expostos ao sol. Os ácidos ascórbico e isoascórbico (INS 300) são muito usados para essa finalidade. Quando o primeiro é utilizado não é com o objetivo de conferir vitamina C ao refrigerante, e sim servir unicamente como antioxidante.
Conservante: Os refrigerantes estão sujeitos à deterioração causa-da por leveduras, mofos e bactérias (micro organismos acidófilos ou ácido-tolerantes), provocando turvações e alterações no sabor e odor. O conservante (Tabela 2) visa inibir o desenvolvimento desses micro organismos (Palha, 2005).
O ácido benzoico (INS 211) atua praticamente contra todas as espécies de micro organismos. Sua ação máxima é em pH = 3. É barato e bem tolerado pelo organismo. Como esse ácido é pouco solúvel em água,é utilizado na forma de benzoato de sódio. O teor máximo permitido no Brasil é de 500 mg/100 mL de refrigerante (expresso em ácido benzoico).
O ácido sórbico (INS 202) ocorre no fruto da Tramazeira (Sorbus aucuparia). É usado como sorbato de potássio e atua mais especificamente sobre bolores e leveduras. Sua ação máxima é em pH = 6. O teor máximo permitido é 30 mg/100 mL (expresso em ácido sórbico livre).
Edulcorante: É uma substância(Tabela 3) que confere sabor doce às bebidas em lugar da sacarose. As bebidas de baixa caloria (diet) seguem os padrões de identidade e qualidade das bebidas correspondentes, com exceção do teor calórico.
Dióxido de carbono: A carbonatação dá “vida” ao produto, realça o paladar e a aparência da bebida. Sua ação refrescante está associada à solubilidade dos gases em líquidos, que diminui com o aumento da temperatura. Como o refrigerante é tomado gelado, sua temperatura aumenta do trajeto que vai da boca ao estômago. O aumento da temperatura e o meio ácido estomacal favorecem a eliminação do CO2, e a sensação de frescor resulta da expansão desse gás, que é um processo endotérmico (Palha, 2005).
A Tabela 4 mostra as embalagens usadas para refrigerantes. No passado, a embalagem universal para bebidas, de um modo geral, era o vidro. Basta recordar o conceito da embalagem (casco) retornável, que era devolvida na aquisição de um novo refrigerante. Hoje predomina a embalagem plástica descartável, pois o plástico passou a ter competitividade frente ao vidro em termos de custo, além de ser mais leve, reduzindo o risco de acidentes em caso de queda. Prazos de validade: Eles se diferenciam entre produtos e entre embalagens do mesmo produto (Tabela 5). Estes são determinados por meio de teste de estabilidade do produto quanto às análises físico-químicas, microbiológicas e sensoriais (Puglia, 2005). As embalagens PET tendem a ter menor validade devido à sua maior porosidade frente ao vidro e ao alumínio, levando à perda de CO2 em menos tempo (a propriedade de os gases escaparem por pequenos orifícios se chama efusão).
Tabela 4: Tipos de embalagem utilizadas no envase de refrigerantes em 2006 (valores expressos em %).
A Tabela 4 mostra as embalagens usadas para refrigerantes. No passado, a embalagem universal para bebidas, de um modo geral, era o vidro. Basta recordar o conceito da embalagem (casco) retornável, que era devolvida na aquisição de um novo refrigerante. Hoje predomina a embalagem plástica descartável, pois o plástico passou a ter competitividade frente ao vidro em termos de custo, além de ser mais leve, reduzindo o risco de acidentes em caso de queda.
Tabela 4: Tipos de embalagem utilizadas no envase de refrigerantes em 2006 (valores expressos em %).
| Vidro | Lata | PET [poli(tereftalato de etileno)] | Barris de aço/alumínio |
12,2 | 7,8 | 79.9 | 0,1 |
Prazos de validade: Eles se diferenciam entre produtos e entre embalagens do mesmo produto (Tabela 5). Estes são determinados por meio de teste de estabilidade do produto quanto às análises físico-químicas, microbiológicas e sensoriais (Puglia, 2005). As embalagens PET tendem a ter menor validade devido à sua maior porosidade frente ao vidro e ao alumínio, levando à perda de CO2 em menos tempo (a propriedade de os gases escaparem por pequenos orifícios se chama efusão).
| Sabor | Vidro 290 mL | Lata 350 mL | Pet 600 mL | Pet 2 L |
| Cola | 9 | 9 | 3 | 4 |
| Cola light | 6 | 4 | 3 | 4 |
| Guaraná | 9 | 9 | 6 | 6 |
| Guaraná diet | 9 | 6 | 6 | 6 |
| Laranja | 6 | 6 | 3 | 4 |
| Limão | 6 | 6 | 6 | 7 |
Experimentos com refrigerante
A análise sensorial é um fator-chave na indústria de alimentos para seleção, pesquisa e desenvolvimento de novos produtos, controle de qualidade e testes de mercado com consumidores (Goretti, 2005). Ela interpreta as reações às características dos alimentos e como são percebidas pelos sentidos humanos:
Visão: Por meio dela, obtemos a primeira impressão do produto quanto à aparência geral: cor, tamanho, formato, brilho e turbidez;
Olfato: Permite a percepção do aroma e odor;
Paladar: É a sensação percebida pelos órgãos gustativos (especial-mente a língua) quando estimulados por determinadas substâncias solúveis: doce, salgado, amargo e ácido.
A sensibilidade ao paladar varia entre as pessoas, e os fatores que influem na percepção do gosto são: – Temperatura: O máximo de sensibilidade e habilidade sensorial ocorre entre 10 e 35 ºC. Com o aumento da temperatura, há um aumento na sensibilidade para o doce e diminuição para o salgado
- o amargo. Por isso, testa-se um produto na temperatura em que ele é consumido;
– Meio de dispersão: O grau de diluição de uma substância com a saliva determina a sua velocidade de percepção. Uma solução de sacarose a 50% m/m pode ser percebida extremamente doce, mas balas com aproximadamente 100% m/m de açúcar não o são;
– Interação de gostos: Pode haver influência na percepção de um gosto devido a outro. Por exemplo, o ácido cítrico em pequena quantidade
aumenta a doçura da sacarose. No entanto, à medida que aumenta a quantidade do ácido, a intensidade do gosto doce diminui.
Tato e audição: Eles permitem a percepção da textura do produto. Textura é o conjunto de proprieda-des (volume, espessura, formato, densidade etc.) perceptíveis pelos sentidos. Como exemplo, tem-se a crocância de um biscoito; a firmeza de uma maçã; o som do morder, do quebrar e do borbulhar de vários produtos (incluindo bebidas).
Experimento 1. Análise sensorial: efeito do CO2
Material
- Refrigerantes de diversos sabores e marcas diferentes, devidamente numerados, em duplicata: um, fechado, em baixa temperatura (geladeira), e outro, aberto, em temperatura ambiente para escape do CO2 e posteriormente resfriado em geladeira, em mesma temperatura da embalagem fechada;
- Copos identificados de acordo com a numeração dos refrigerantes.
Procedimento
– Remover os rótulos originais dos produtos para não comprometer a análise sensorial;
– Vendar os olhos dos degustadores;
– Proceder à degustação. Anotar as observações em tabela previamente organizada;
– Retirar a venda dos degustadores e proceder à análise visual (cor, transparência etc.).
Tabela 4: Tipos de embalagem utilizadas no envase de refrigerantes em 2006 (valores expressos em %).
| Vidro | Lata | PET [poli(tereftalato de etileno)] | Barris de aço/alumínio |
| 12,2 | 7,8 | 79,9 | 0,1 |
Tabela 5: Prazos de validade (em meses) de refrigerantes segundo as embalagens.
| Sabor | Vidro 290 mL | Lata 350 mL | Pet 600 mL | Pet 2 L |
| Cola | 9 | 9 | 3 | 4 |
| Cola light | 6 | 4 | 3 | 4 |
| Guaraná | 9 | 9 | 6 | 6 |
| Guaraná diet | 6 | 6 | 6 | 6 |
| Laranja | 6 | 6 | 3 | 4 |
| Limão | 6 | 6 | 6 | 6 |
Discussão
- Discutir o efeito do CO2 em relação aos órgãos dos sentidos.
Experimento 2. Análise sensorial: sacarose ou edulcorante? Natural ou artificial?
Material
- Refrigerantes de sabores de frutas (normais e diet) e sucos de frutas, de diversas marcas, devidamente numerados, mantidos fechados, em baixa temperatura (geladeira);
- Copos identificados de acordo com a numeração das bebidas.
O refrigerante é uma ferramenta versátil e de baixo custo para aulas práticas ou demonstrativas, facilitando o aprendizado de diversos conceitos.
Procedimento
Executar conforme mostrado no Experimento 1.
Discussão
- Observar se os alunos conseguem distinguir o sabor dos refrigerantes contendo sacarose ou edulcorante;
- Descrever como os alunos per-cebem a diferença
entre o sabor de um refrigerante e o do suco de fruta corres-pondente.
Efeito da tempe-ratura e da pressão na solubilidade dos gases em líquidos:
De acordo com o princípio de Le Châtelier, a elevação na temperatura favorece uma transformação endo-térmica que, para um gás, ocorre quando ele deixa a solução. Por isso, os gases se tornam menos solúveis à medida que a temperatura do líquido no qual estão dissolvidos se eleva (Macedo, 1981; Canto e Peruzzo, 2006). A uma temperatura fixa, a solubilidade dos gases aumenta com a elevação da pressão (Macedo, 1981; Canto e Peruzzo, 2006).
Experimento 3. Efeito da temperatura e da pressão na solubilidade dos gases Material
- Refrigerantes de diversos sabores e de uma mesma marca, fechados, em triplicata: o primeiro, em baixa temperatura (geladeira); o segundo, exposto ao sol; o terceiro, inicialmente exposto ao sol e depois colocado por 10 minutos na geladeira.
Procedimento
– Abrir as tampas. Anotar o comporta-mento do produto em cada uma das condições acima listadas.
Discussão
importante notar que, uma vez aberta a embalagem, a bebida perderá parte do gás, mesmo quando em tempe-ratura igual àquela do envase, pelo fato de a pressão interna ser superior à atmosférica.
Medida de acidez dos refrigerantes e reações em meio ácido:
Os refrigerantes têm caráter ácido. O valor do pH, medido com instrumento ou papel indicador, pode ser comparável ao do pH do suco gástrico (pH ~ 2,0) e de outros sucos naturais. Podem-se mostrar aos alunos reações químicas que ocorrem em meio ácido. O emprego de refrigerantes sem corante facilita a visualização dos experimentos.
Experimento 4. Dissolução de bicarbonato de sódio no refrigerante (Figura 1)
Material
- Béquer de 250 mL;
- Refrigerante de sabor limão ou outro que não contenha corante;
- Bicarbonato de sódio sólido;
- Espátula;
- Tiras de papel indicador universal de pH.
Procedimento
- Medir o pH inicial do refrigerante por meio do papel indicador de pH;
- Adicionar, aos poucos, com a espátula, o bicarbonato de sódio. Esperar cessar o desprendimento de gás antes da nova adição;
- Quando a adição do bicarbonato não produzir mais gás, medir o pH do líquido.
Discussão
A dissolução de carbonatos e bi-carbonatos reduz a acidez do líquido (como acontece quando se toma um antiácido para combater a azia estomacal):
CO32-(aq) + 2 H+(aq) → CO2(g) + H2O(l)
HCO3–(aq) + H+(aq) → CO2(g) + H2O(l)
Os alunos devem entender porque em pH = 7 não ocorre mais liberação de CO2.
Experimento 5. Reação do ferro metálico com o ácido do refrigerante (Figura 2)
Material
- Béquer de 250 mL;
- Refrigerante de sabor limão ou outro que não contenha corante;
- Palha de aço;
- Solução de H2O2 a 3% m/m (10 volumes);
- Pipeta.
Procedimento
- Medir o pH inicial do refrigerante por meio do papel indicador de pH;
- Adicionar a palha de aço no refri-gerante; a partir daí, acompanhar a evolução visual do experimento, conforme descrição na Figura 2;
- Após 20 minutos, adicionar o peróxi-
- Avaliar o efeito combinado da temperatura e da pressão sobre a solubilidade de um gás em um lí-quido. O resultado dessa discussão deve explicar todos os fenômenos visuais (modo de liberação do gás) e auditivos (barulho decorrente da despressurização) observados. É
Figura 1: Dissolução de
bicarbonato de sódio em refrigerante de limão: (a) Início do processo (pH =
3,0); (b) Após 3 minutos (desprendimento de CO2); (c) Após 10 minutos (pH
= 7,0). Nesse pH, não há mais liberação de CO2.
Figura 2: Reação da palha de aço com o ácido do refrigerante de limão.
(a) Início do processo; após 3 minutos, observam-se bolhas de gás na malha de ferro;
(b) A palha de aço é levantada pelas bolhas que se acumulam na malha de seus fios;
(c) A palha de aço afunda depois que o gás se desprende da solução; (d) Após 10 minutos (pH = 4,0), nota-se a cor verde que indica a formação do íon Fe2+;
(e) Após 20 minutos (pH = 7,0), o ferro precipita como hidróxido de ferro(II), Fe(OH)2; a adição de peróxido de hidrogênio (H2O2), um agente oxidante, oxida o Fe2+ a Fe3+, formando o hidróxido Fe(OH)3.
de qualidade necessário para que seja consumido sem risco à saúde. A Química tem um papel essencial na análise de quaisquer produtos consumidos pelas pessoas.
O refrigerante é uma ferramenta versátil e de baixo custo para aulas práticas ou demonstrativas, facilitando o aprendizado de diversos conceitos, tais como solubilidade dos gases em água, interações químicas (dipolo permanente – dipolo induzido), pKa, pH e efeito da pressão e da temperatura no comportamento dos gases.
Nota
1. INS – International NumberingSystem ou Sistema Internacional de
Numeração de Aditivos Alimentares, do de hidrogênio, por meio da pipeta, no fundo do béquer.
Discussão
O ferro reage com ácidos, liberando gás hidrogênio. Essa reação agente redutor frente ao peróxido de hidrogênio, de acordo com a equação:
2 Fe(OH)2(s) + H2O2(aq) → 2 Fe(OH)3(s)
elaborado pelo Comitê do Codex sobre Aditivos Alimentares e Contaminantes de Alimentos (CCFAC) como um sistema numérico de identificação desses aditivos em alternativa à declaração de seus nomes.
ocorre em “câmera lenta”, mas à medida que ela avança, a concen-tração de H+ diminui no meio e, por consequência, o pH aumenta.
Fe(s) + 2 H+(aq) → Fe2+(aq) + H2(g)
Esse fato leva à precipitação do Fe2+ como hidróxido. O Fe(II) é um
A mudança de cor na Figura 2(e) é o resultado visual dessa reação redox.
Conclusão
O refrigerante é um exemplo de como a química está inserida em nosso cotidiano, não apenas no que diz respeito à preparação desse produto, mas também no controle
Ana Carla da Silva Lima, graduada em Licenciatura em Química pelo Instituto de Química da Universidade Federal do Rio de Janeiro (UFRJ), trabalha em laboratório de controle de qualidade de refrigerantes de uma unidade industrial. Júlio Carlos Afonso (julio@iq.ufrj.br), graduado em Química e Engenharia Química e doutor em Engenharia Química pelo IRC/CNRS (França); é professor associado do Departamento de Química Analítica do Instituto de Química da UFRJ. Referências ABIR - Associação Brasileira das Indús-trias de Refrigerantes e de Bebidas Não Alcoólicas. Histórico do setor. Disponível em: <http://www.abir.org.br/rubrique. php3?id_rubrique=178>. Acesso em dez. 2007. CANTO, E.L. e PERUZZO, T.M. Química na abordagem do cotidiano, vol. 2 – Físico-Química. 4. ed. São Paulo: Moderna,2006. GORETTI, M. Manual de treinamento – análise sensorial. São Paulo: AmBev,2005. MACEDO, H. Físico-Química I. Rio de Janeiro: Guanabara Dois, 1981. PALHA, P.G. Tecnologia de refrigerantes. Rio de Janeiro: AmBev, 2005. PUGLIA, J.E. Padrão de codificação da data de validade. São Paulo: AmBev,2005. ROSA, S.E.S.; COSENZA, J.P. e LEÃO, L.T.S. Panorama do setor de bebidas no Brasil. BNDES Setorial, v. 23, p. 101-149, 2006. RODRIGUES, M.V.N.; RODRIGUES, R.A.F. e SERRA, G.E. Produção de xarope de açúcar invertido obtido por hidrólise heterogênea, através de planejamento experimental. Ciência e Tecnologia de Alimentos, v. 20, p. 103-109, 2000. Para saber mais ANVISA – Agência Nacional de Vigilância Sanitária. Aditivos alimentares. Disponível em: <http://www.anvisa.gov.br/alimentos/ legis/especifica/aditivos.htm>. BAUR, J.E. e BAUR, M.B. The ultrasonic soda fountain: a dramatic demonstration of gas solubility in aqueous solutions. Journal of Chemical Education, v. 83, p.577-582, 2006. SNYDER, C.A. e SNYDER, D.C. Simple soda bottle solubility and equilibria (TD). Journal of Chemical Education, v. 69, p.577-581, 1992. FERREIRA, E.C. e MONTES, R. A química da produção de bebidas alcoólicas. Química Nova na Escola, v. 10, p. 50-51,1999. FERREIRA, L.H.; HARTWIG, D.H. e RO-CHA FILHO, R.C. Algumas experiências simples envolvendo o princípio de Le Chatelier. Química Nova na Escola, v. 5, p. 28-31, 1997.
2D Realize a atividade Experimental com apoio do Texto 1: Química Nova na Escola, confor-me o procedimento a seguir. Após a realização do experimento socialize as observações dos grupos.
Título: Teste Sensorial
Materiais:
2 copos descartáveis; 2 refrigerantes (200 mL) de uma mesma qualidade e sabor
1º Passo:
• Identificar os refrigerantes e os copos com os numerais 1 e 2;
• Abrir o refrigerante 1, adicionar 200 mL em um copo (1) e deixar em repouso por 30 minutos;
• O refrigerante 2 deverá permanecer fechado se possível em temperatura baixa.
2º Passo:
• Abrir o refrigerante 2, adicionar 200 mL em outro copo (2);
• Degustar o refrigerante 1 e 2.
• Registrar as impressões no quadro a seguir.
Refrigerante Sabor percebido Justifique suas percepções
Refrigerante 1
(com repouso de 30 min)
Refrigerante 2
(sem repouso)
A que você atribui esta diferença no sabor do refrigerante?
2E Assistir ao Vídeo 1: Dissolução de gás em água. Disponível em: https://www. youtube.com/watch?v=9u67GNYQ_JE.
Individualmente observe as informa-ções contidas no vídeo sobre as evidências visuais do experimento e preencha a Tabela abaixo. Após o preenchimento socialize com os colegas.
Amostras Água do mar filtrada Água de Cal filtrada Água da torneira
Evidência com adição de indicador
pH inicial da amostra depois da adição de indicador
Evidências com a adição de CO2, pH da amostra depois da adição de CO2
Evidências da amostra depois de 5 minutos de aquecimento.
Escreva as reações envolvidas na adição de CO2 com água do mar, água de cal filtrada e água da torneira.
2F Assistir ao Vídeo 2: Equilíbrio químico – Le Chatelier e a temperatura – Experimento, dispo-nível em: http://www.quimica.seed.pr.gov.br/modules/video/showVideo.php?video= 17561
Em duplas, responda no caderno:
A) O que acontece ao aquecer os tubos de ensaio com Nitrato de Chumbo?
B) Qual a necessidade de tampar os tubos de ensaio?
C) Quais percepções são visíveis quando os tubos de ensaio são colocados na água fria e quente?
2G O refrigerante é formado por uma solução aquosa de xarope e gás carbônico (CO2), que por sua vez é adicionado em um aparelho chamado carbonizador gerando o ácido carbô-nico (H2CO3), representado pela seguinte equação em equilíbrio:
2(g) + H2O(l) <=> H2CO3(g)
Reação Genérica: a A + b B c C + d D
Aplicação da fórmula: Kc = [C]c . [D]d
[A]a . [B]b
Conforme os dados na Tabela 7, calcule a constante de equilíbrio para a reação que formao ácido carbônico.| Substância Equilíbrio | Concentração (mol/L) | Resolução do cálculo do cálculo |
| CO2(g) | 2,0 | Kc = [C]c . [D]d [A]a . [B]b Kc = 2,5 mol/l 1,5 mol/l . 2,0 mol/L |
| H2O(l) | 1,5 | |
| H2CO3(g) | 2,5 |
2H Com a orientação de seu professor explore o simulador de Equilíbrio Químico, seguindo o passo a passo, mediante a reação de decomposição:
2H2O2 2H2O + O2 . Simulador: Equilíbrio Químico. Disponível em:
http://nautilus.fis.uc.pt/cec/teses/susanaf/simul/
- Abra o simulador e selecione os itens conforme indicações abaixo;
- Clicar no botão “iniciar”;
- Na reação indicada clicar em “OK”;
- No botão de seleção, clicar em temperatura e selecionar a temperatura 600 K;
- No botão de seleção, clicar em pressão/volume e selecionar volume mínimo;
- No botão de seleção, clicar em reagente/produto e selecionar reagente;
- No botão de seleção, clicar em gás inerte e selecionar o gás Xénon (Xenônio) à pressão de 1 bar;
- Clicar no botão “equilibrar”;
- Efetuar o cálculo da constante de equilíbrio e observar se a produção é alta ou baixa;
- Repita os procedimentos do item 3 ao 9, alterando as variáveis temperatura, pressão/volu-me, reagente/produto ) gás inerte;
- Faça os cálculos necessários, preencha a tabela e com o auxílio dos dados preenchidos, descreva quais as condições que contribuem para um melhor rendimento da reação. Socia-lize com seus colegas os resultados obtidos.
Temperatura Pressão/ Reagente/ Gás Inerte Cálculo da Resultados
(K) Volume Produto constante de (produção alta
equilíbrio ou baixa)
600
700
800
2I Retome as suas hipóteses construídas no item 2.B e verifique e/ou reelabore suas ideias para a construção das considerações finais.
ATIVIDADE 3: RAPIDEZ DAS TRANSFORMAÇÕES QUÍMICAS
3A Reflita e discuta com seus colegas sobre as situações-problema a seguir:
- O que você observa ao adicionarmos água oxigenada em um machucado?
- Por que precisamos da geladeira?
- Por que precisamos guardar alguns alimentos na geladeira?
- Por que carnes salgadas não necessitam de refrigeração?
3B Registre suas impressões, ideias e/ou hipóteses e socialize com seus colegas.
3C Leia o texto “Métodos Gerais de Conservação de Alimentos” da apostila Técnico em Alimentos, disponível em:
http://redeetec.mec.gov.br/images/stories/pdf/eixo_prod_alim/tec_alim/181012_con_alim.pdf e responda:
A) Qual a necessidade de conservar alimentos?
B) Quando surgiu esta necessidade e quais objetivos?
C) Cite e explique alguns métodos de conservação de alimentos.
3D Em grupo com quatro integrantes façam a leitura do texto “Cinética Química”, disponível em
https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm
Peencham a tabela com referência nos fatores que influenciam na rapidez das transformações: concentração dos reagentes, temperatura, superfície de contato, pressão e catalisadores. Após o preenchimento socialize com os colegas.
| Fatores | Respostas |
| Concentração dos reagentes | Quanto maior a concentração dos reagentes maior será a velocidade da reação. |
| Temperatura | Quando se aumenta a temperatura de um sistema, ocorre também um aumento na velocidade da reação. Aumentar a temperatura significa aumentar a energia cinética das moléculas. |
| Superfície de contato | Um aumento da superfície de contato aumenta a velocidade da reação. Um exemplo é quando dissolvemos um comprimido de antiácido estomacal triturado e ele se dissolve mais rapidamente do que se estivesse inteiro, isto acontece porque aumentamos a superfície de contato que reage com a água. |
| Pressão | Quando se aumenta a pressão de um sistema gasoso, aumenta-se a velocidade da reação pois reduzindo o volume, acelera-se a reação devido à aproximação das moléculas. |
| Catalisadores | Os catalisadores permitem que a reação tome um caminho alternativo, que exige menor energia de ativação, fazendo com que a reação se processe mais rapidamente. |
Cinética Química
Existe um ramo na ciência que estuda a velocidade das reações químicas e os fatores que a influenciam, é a chamada Cinética Química. Pode se definir reações químicas como sendo um conjunto de fenômenos nos quais duas ou mais substâncias reagem entre si, dando origem a diferentes compostos. Equação química é a representação gráfica de uma reação química, onde os reagentes aparecem no primeiro membro, e os produtos no segundo.
.jpg)
A + B C + D
Reagentes Produtos
O conhecimento e o estudo das reações, além de ser muito importante em termos industriais, também estão relacionados ao nosso dia a dia.
A velocidade de uma reação é a rapidez com que os reagentes são consumidos ou rapidez com que os produtos são formados. A combustão de uma vela e a formação de ferrugem são exemplos de reações lentas. Na dinamite, a decomposição da nitroglicerina é uma reação rápida.
As velocidades das reações químicas são determinadas através de leis empíricas, chamadas leis da velocidade, deduzidas a partir do efeito da concentração dos reagentes e produtos na velocidade da reação.
As reações químicas ocorrem com velocidades diferentes e estas podem ser alteradas, porque além da concentração de reagentes e produtos, as velocidades das reações dependem também de outros fatores como:
Concentração de reagentes: quanto maior a concentração dos reagentes maior será a velocidade da reação. Para que aconteça uma reação entre duas ou mais substâncias é necessário que as moléculas se choquem, de modo que haja quebra das ligações com consequente formação de outras novas. O número de colisões irá depender das concentrações de A e B. Veja a figura:
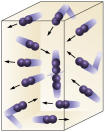
É fácil perceber que devido a uma maior concentração haverá aumento das colisões entre as moléculas.
Superfície de contato: um aumento da superfície de contato aumenta a velocidade da reação. Um exemplo é quando dissolvemos um comprimido de sonrisal triturado e ele se dissolve mais rapidamente do que se estivesse inteiro, isto acontece porque aumentamos a superfície de contato que reage com a água.
Pressão: quando se aumenta a pressão de um sistema gasoso, aumenta-se a velocidade da reação.
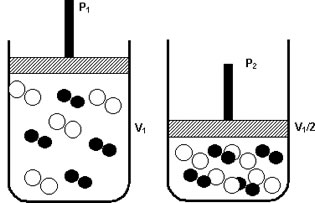
Um aumento na pressão de P1 para P 2 reduziu o volume de V1 para V1/2, acelerando a reação devido à aproximação das moléculas.
A figura acima exemplifica, pois com a diminuição do volume no segundo recipiente, haverá um aumento da pressão intensificando as colisões das moléculas e em consequência ocorrerá um aumento na velocidade da reação.
Temperatura: quando se aumenta a temperatura de um sistema, ocorre também um aumento na velocidade da reação. Aumentar a temperatura significa aumentar a energia cinética das moléculas. No nosso dia a dia podemos observar esse fator quando estamos cozinhando e aumentamos a chama do fogão para que o alimento atinja o grau de cozimento mais rápido.
Catalisadores: os catalisadores são substâncias que aceleram o mecanismo sem sofrerem alteração permanente, isto é, durante a reação eles não são consumidos. Os catalisadores permitem que a reação tome um caminho alternativo, que exige menor energia de ativação, fazendo com que a reação se processe mais rapidamente. É importante lembrar que um catalisador acelera a reação, mas não aumenta o rendimento, ou seja, ele produz a mesma quantidade de produto, mas num período de menor tempo.
Por Líria Alves
Graduada em Química

Gostaria de fazer a referência deste texto em um trabalho escolar ou acadêmico? Veja:
Lista de Exercícios Questão 1
(PUC-RS) Relacione os fenômenos descritos na coluna I com os fatores que influenciam sua velocidade mencionados na coluna II.
Coluna I
1 – Queimadas alastrando-se rapidamente quando está ventando;
2 – Conservação dos alimentos no refrigerador;
3 – Efervescência da água oxigenada na higiene de ferimentos;
4 – Lascas de madeiras queimando mais rapidamente que uma tora de madeira.
Coluna II
A – superfície de contato
B – catalisador
C – concentração
D – temperatura
A alternativa que contém a associação correta entre as duas colunas é
a) 1 – C; 2 – D; 3 – B; 4 – A.
b) 1 – D; 2 – C; 3 – B; 4 – A.
c) 1 – A; 2 – B; 3 – C; 4 – D.
d) 1 – B; 2 – C; 3 – D; 4 – A.
e) 1 – C; 2 – D; 3 – A; 4 – B.
Questão 2
(UnB-DF) Considere os estudos cinéticos de uma reação química e julgue os itens abaixo:
(1) Toda reação é produzida por colisões, mas nem toda colisão gera uma reação.
(2) Uma colisão altamente energética pode produzir uma reação.
(3) Toda colisão com orientação adequada produz uma reação.
(4) A energia mínima para uma colisão efetiva é denominada energia da reação.
(5) A diferença energética entre produtos e reagentes é denominada energia de ativação da reação.
QUESTÃO 3
Indique a afirmação incorreta:
a) Quanto menor for a temperatura, maior será a velocidade de uma reação.
b) O aumento da temperatura aumenta a velocidade tanto da reação endotérmica quanto da reação exotérmica.
c) A velocidade de um reagente no estado sólido é menor que no estado líquido.
d) A diferença energética entre os produtos e os reagentes é chamada de entalpia de reação.
e) A velocidade de uma reação depende da natureza do reagente.
QUESTÃO 4
Assinale a alternativa que apresenta agentes que tendem a aumentar a velocidade de uma reação:
a) calor, obscuridade, catalisador.
b) calor, maior superfície de contato entre reagentes, ausência de catalisador.
c) calor, maior superfície de contato entre reagentes, catalisador.
d) frio, obscuridade, ausência de catalisador.
e) catalisador e congelamento dos reagentes.
RESPOSTAS
Questão 1
Alternativa “a”.
1 – O vento aumenta a concentração de oxigênio, que atua como comburente da queimada;
2 – A diminuição da temperatura diminui a velocidade das reações, pois diminui o movimento das partículas reagentes e a probabilidade de choques efetivos que resultem em reação.
3 – A decomposição da água oxigenada é acelerada por uma enzima presente no sangue que atua como catalisadora dessa reação.
4 – A superfície de contato das lascas de madeira com o oxigênio do ar que causa a queima é maior que a de uma tora de madeira.
Questão 2
(1) Verdadeira.
(2) Verdadeira.
(3) Falsa. Para produzir uma reação, a colisão deve sim ter orientação adequada, mas também deve ter energia suficiente.
(4) Falsa. A energia mínima para uma colisão efetiva é denominada energia da ativação, e não energia de reação.
(5) Falsa. A diferença energética entre produtos e reagentes é denominada entalpia da reação.
Questão 3
Alternativa “a”.
Quanto maior for a temperatura, maior será a velocidade de uma reação.
Questão 4
Alternativa “c”.
3 E Em duplas, leia o texto:
A História sob o Olhar da Química.
Atividades Experimentais Simples para o Entendimento de Conceitos de Cinética Enzimática: Solanum tubero-sum – Uma Alternativa Versátil. Disponível em:
http://qnesc.sbq.org.br/online/qnesc35_1/05-RSA-104-11.pdf
Cite e explique quais fatores interferem na rapidez da reação. Socialize a resposta com os colegas.
Cite e explique quais fatores interferem na rapidez da reação?
Concentração: Quando aumentamos a concentração dos reagentes, aumentamos o número de moléculas ou partículas reagentes por unidade de volume e, consequentemente, o número de colisões entre elas aumenta, resultando em uma maio rvelocidade da reação.
Uso do catalisador: Os catalisadores conseguem aumentar a velocidade das reações porque eles atuam mudando o mecanismo da reação por diminuir a energia de ativação da reação. Assim, com uma quantidade de energia de ativação menor, fica mais fácil para as partículas reagentes atingirem essa energia e reagirem.
E a temperatura: Com o aumento da temperatura, a energia cinética das moléculas das substâncias reagentes aumenta, ou seja, elas movimentam-se em uma maior velocidade, o que aumenta a quantidade de choques efetivos que resultam em uma reação mais rápida.
3F Em grupos realizem a atividade Experimental: Rapidez da Reação – Superfície de Contato, conforme o procedimento a seguir. Durante a realização registre as evidências observadas para subsidiar a resposta do Quadro 2 , após a realização do experimento socialize as respostas com os demais grupos.
Título: Rapidez da Reação – Superfície de Contato Materiais e reagentes:
2 recipientes transparentes (copo);
Uma palha de aço;
Um prego de ferro;
100 mL de HCl (diluído);
Procedimento:
1) Numerar os recipientes 1 e 2;
2) Colocar aproximadamente 50 mL de HCl em cada um dos recipientes;
3) Colocar ao mesmo tempo no recipiente 1 a palha de aço e no recipiente 2 o prego de ferro, observe atentamente e faça registros;
O que pode ser observado nos recipientes 1 e 2, comparando-se a rapidez das reações? Justifique sua resposta.
3G Utilizar o Simulador. Cinética Química. Disponível em:
http://www.profpc.com.br/Simula%C3%A7%C3%A3o/Cin%C3%A9tica%20Qu%C3%ADmica/rxnRate01.html
O referido simulador apresenta a possibilidade de observar e com-preender que o uso de diferentes catalisadores e as quantidades utilizadas influenciam diretamente na rapidez da reação, neste caso de estudo a decomposição da água oxigenada:
2H2O2 -> 2H2O + O2 .
Em duplas explorem a ferramenta e registrem as informações solicitadas na tabela 5 e depois responda às questões.
| Adição de Catalisadores | |||||||||||
| Volumes Adicionados de Reagente H2O2 | 0,5M KI | 1M KCl | 0,1M FeCl3 | ||||||||
| Adição de 5 mL H2O2 | 0mL | 2mL | 4mL | 0mL | 2mL | 4mL | 0mL | 2mL | 4mL | ||
| Adição de 10 mL H2O2 | |||||||||||
a) O aumento do volume de H2O2 de 5 mL para 10 mL influencia na rapidez da decomposição? Justifique.
Sim. Quando aumentamos a concentração dos reagentes, aumentamos o número de moléculas ou partículas reagentes por unidade de volume e, consequentemente, o número de colisões entre elas aumenta, resultando em uma maior velocidade da reação
b) O aumento dos volumes dos 3 catalisadores interfere na rapidez da decomposição?
Sim, mas não na mesma proporção. Não existe um tipo ideal de catalisador. Para cada reação química existe um tipo diferente de catalisador
c) Qual catalisador é mais indicado para a reação de decomposição da H2O?
KI, pois foi o catalisador que proporcionou o menor tempo de reação
3H Retome as suas hipóteses construídas no item 3.B e verifique e/ou reelabore suas ideias para a construção das considerações finais.
http://qnesc.sbq.org.br/online/qnesc32_3/05-RSA-7309_novo.pdf
Influências na velocidade das reações
Os principais fatores que alteram a velocidade de uma reação são: superfície de contato, temperatura, presença de catalisadores e concentração dos reagentes. Vejamos cada um desses:
• Superfície de contato:

Isso pode ser visto por meio de dois exemplos simples:
1º) Se queimarmos ao mesmo tempo uma palha de aço e um prego, sabemos que com certeza a palha de aço reagirá mais rápido, embora ambos tenham como componente principal o ferro;

2º) Se colocarmos dois comprimidos efervescentes na água, sendo que um está pulverizado e o outro está inteiro, o que reagirá mais rápido será o pulverizado. Observe na ilustração abaixo que o comprimido triturado demora apenas 28 segundos para terminar de reagir, enquanto que o comprimido inteiro demora 1 minuto e 4 segundos.

Isso ocorre porque as colisões entre as partículas dos reagentes se realizam na superfície; assim, quanto mais superfície de contato tiver, ou seja, quanto mais fragmentado estiver o sólido, maior é o número de partículas da superfície que ficarão expostas, aumentando a quantidade de colisões e a velocidade da reação.
• Temperatura:
Segundo a regra de Van’t Hoff, um aumento de 10°C faz com que a velocidade da reação dobre. Isso significa que para a grande maioria das reações:

Vejamos alguns exemplos:
1º) A velocidade de decomposição dos alimentos diminui quando diminuímos sua temperatura, colocando-os em refrigeradores;
2º) Os alimentos cozinham mais rápido quando usamos a panela de pressão, pois a água ferve em temperaturas mais altas;
3º) Quando colocamos dois comprimidos efervescentes inteiros, um em água fria e outro em água quente, o que está na água quente reagirá muito mais rápido.
Isso ocorre porque o aumento da temperatura aumenta a energia cinética das moléculas, aumentando os números de colisões e, consequentemente, aumentando a velocidade da reação.
• Catalisador:

Isso é possível porque o catalisador gera um caminho alternativo para a reação ao se combinar com o reagente, criando um composto intermediário entre os reagentes e os produtos, que, posteriormente, transforma-se no produto da reação e regenera o catalisador inicial. Desse modo, a energia de ativação é menor, acelerando a velocidade da reação.
Um exemplo é a reação do açúcar com o oxigênio. Um pirulito exposto somente ao ar demora séculos para reagir, enquanto que ao entrar em contato com a saliva, as enzimas presentes agem como catalisadores, pois agem sobre o açúcar, criando moléculas que reagem mais facilmente com o oxigênio.
• Concentração dos reagentes:

Isso é explicado porque, quando aumentamos a concentração dos reagentes, a quantidade de partículas por unidade de volume aumenta e o número de choques efetivos entre as moléculas também; consequentemente, a velocidade da reação também aumentará.
Isso pode ser observado no caso do carvão queimando em presença do ar. Visto que o ar é composto de apenas 20% de moléculas de oxigênio (O2), a reação ocorre de forma lenta. Mas se colocarmos o carvão em um frasco com oxigênio puro, ele se inflama, pois todas as partículas que estarão colidindo com o carvão serão de oxigênio, que participa da reação.
Aproveite para conferir nossas videoaulas relacionadas ao assunto:
https://alunosonline.uol.com.br/quimica/influencias-na-velocidade-das-reacoes.html
DUVIDA PODE COMENTAR E PERGUNTAR QUE AJUDAMOS A RESOLVER SEU PROBLEMA NESSES ASSUNTOS. DEIXE UMA RESPOSTA NO COMENTÁRIO ABAIXO.


