http://https://www.youtube.com/watch?v=nCzY6BcE5Jk&list=PLs2rhqJP3MrSg-USRaCp4nTtMxDut6WnI&index=1
A Evolução do Átomo
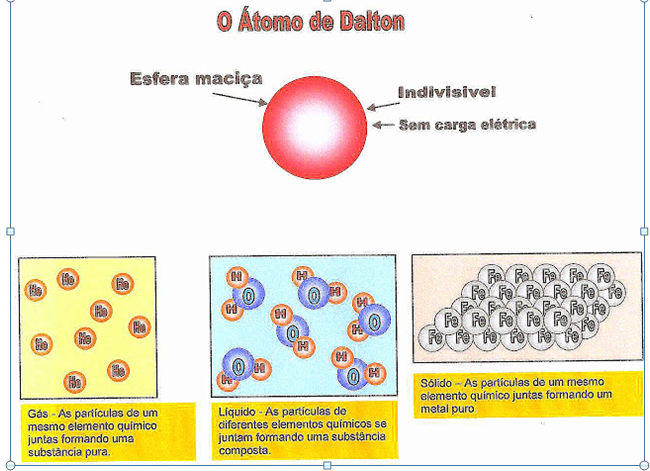
O Átomo Maciço de John Dalton
John Dalton foi Físico Inglês nascido na cidade de Eaglesfield, Cumberland no ano de 1766 e faleceu na cidade de Manchester no ano de 1844. Na sua teoria Dalton chegou à seguinte conclusão: toda a matéria existente é formada por átomos que são partículas extremamente pequenas, são esferas maciças, homogêneas, indivisíveis, indestrutíveis, e de carga eletricamente neutra. Cada átomo possui o seu próprio símbolo, e cada elemento possui propriedades características físicas e químicas diferentes. Um composto pode ser formado pela combinação de dois ou mais átomos.
Para maiores informações pesquisar:
pt.wikipedia.org/wiki/John_Dalton
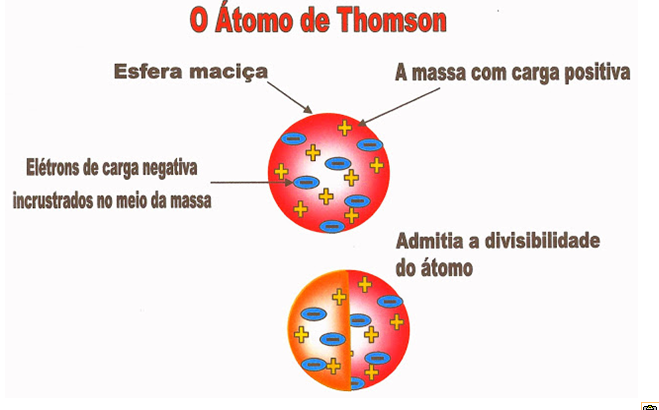
O Átomo Corpuscular de Thomson
O físico britânico Joseph John Thomson nasceu em Cheethan Hill perto de Manchester no ano de 1956 e faleceu no ano de 1940 na cidade de Cambridge. Foi o inventor de um aparelho chamado de espectrógrafo de massa que permitia medir a massa dos átomos. Nas suas pesquisas, em 1898 sugeriu que o átomo deveria ser uma pequena esfera de massa positiva com elétrons de carga negativa incrustados na massa dessa esfera. Foi o descobridor da partícula negativa do átomo o elétron, chegou a admitir a divisibilidade da partícula atômica.
Para maiores informações pesquisar:
pt.wikipedia.org/wiki/Joseph_John_Thomson
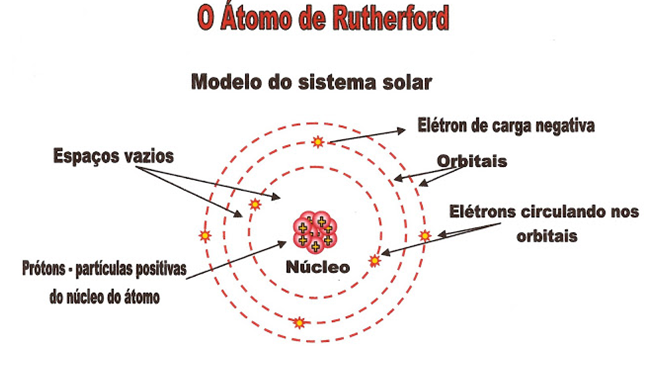
O Átomo de Rutherford – Modelo do Sistema Solar
O físico Ernest Rutherford nasceu em Spring Grove no ano de 1871, na Nova Zelândia e faleceu na cidade de Cambridge no ano de 1937. Suas experiências serviram para determinar o modelo do sistema solar para o átomo. O sol seria o núcleo atômico carregado positivamente (prótons) e os planetas em suas órbitas seriam os elétrons de carga negativa circulando nos seus orbitais distantes do núcleo.
Nas suas atividades científicas pesquisou a radiatividade e descobriu os raios alfa, beta e gama.
Para maiores informações pesquisar:
pt.wikipedia.org/wiki/Ernest_Rutherford
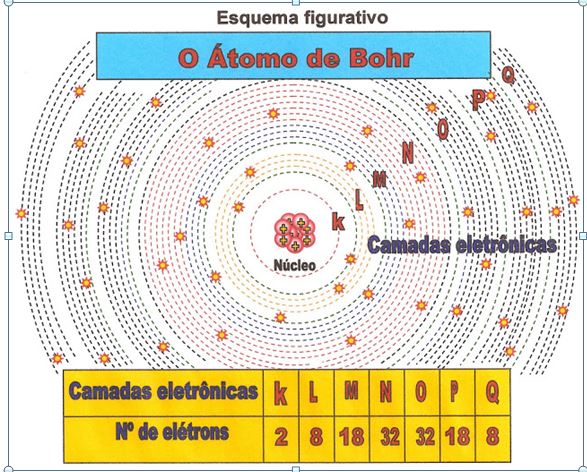
Bhor as Órbitas Circulares dos Elétrons e as Camadas Eletrônicas
Niels Bhor nasceu na Dinamarca, (kǿbenhanvn) Copenhague no ano de 1885, e faleceu no ano de 1962 em Copenhague. Postulou que o núcleo do átomo era positivo devido aos prótons e que os elétrons de carga negativa, circulavam nas suas mesmas órbitas circulares em torno de um núcleo pequeno. Ele organizou os orbitais em 7 níveis, ou a formação de até 7 camadas em torno do núcleo atômico que receberam as letras K; L; M; N; O; P; Q.
Para maiores informações pesquisar:
www.portalsaofrancisco.com.br/…bohr/modelo-atomico-de-bohr-1.php
| Adicionar legenda |
A Produção da Luz
A Luz é uma radiação eletromagnética em forma de onda com a faixa de freqüência de 7,5 x 10¹4 a 4,0 x 10¹4 hertz por segundo. Segunda lei de Bohr idealizou a produção da luz da seguinte forma O elétron em seu orbital em torno do núcleo recebe um quanta de energia., este salta de um orbital externo para um orbital interno absorve energia. Cessando o pulso de energia o elétron que está no orbital interno, volta para o seu orbital de origem emitindo um fóton (luz). Obs: o salto do elétron para a órbita interna pode ser de 1 ou mais orbitais, depende da energia aplicada sobre o elétron. Por exemplo: o elétron está no orbital 4, recebe energia vai para o orbital interno 2. Voltando para o seu orbital original 4, libera luz de cor correspondente a energia liberada (depende ainda do elemento químico usado para a cor da luz correspondente).
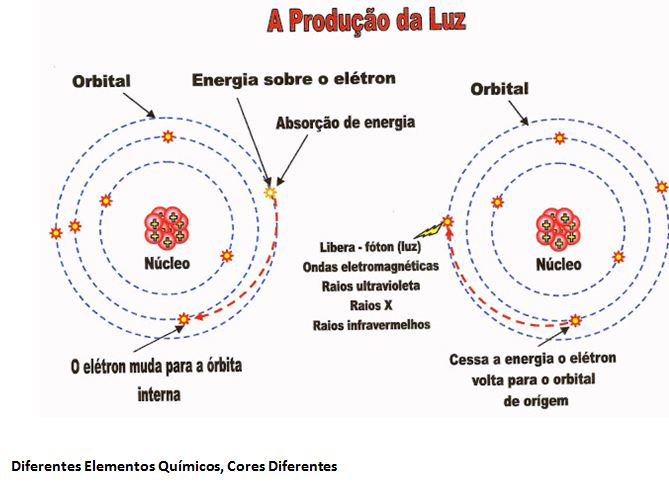
Diferentes Elementos Químicos, Cores Diferentes
O elemento químico argônio, pertencente ao grupo dos gases nobres, na forma de gás argônio, produz a luz azul esverdeada, é um exemplo de uma substância formado apenas por um elemento químico ou um único átomo individualmente, portanto esse gás não é formado por moléculas e sim por átomos individuais. O elemento químico neônio, pertencente aos gases nobres, se encontra naturalmente na forma de gás neônio, são átomos individuais que produzem a luz de neon de cor avermelhada.
O elemento químico sódio produz a cor amarela. Observa-se isso experimentalmente quando colocamos uma solução de cloreto de sódio para ser queimada numa chama, o que produz a cor respectiva.
O elemento químico potássio produz a luz de coloração violeta.
O elemento químico cálcio produz a luz de cor vermelho tijolo.
O elemento químico estrôncio, na forma de sal de estrôncio, ao ser queimado, produz a luz de cor vermelho-carmim. Está presente em fogos de artifício.
O elemento químico bário, quando queimado produz a luz de cor verde.
O elemento químico cobre na forma de sais de cobre ao ser queimado produz a luz de cor azul-esverdeada intensa.
o elemento químico césio produz a luz de cor azul-clara. Não esquecer que o césio é radioativo e emite partículas beta e principalmente a radiação gama é muito penetrante e contaminante nos tecidos biológicos.
O elemento químico Arsênio produz a cor da luz azul ao ser queimado.
O elemento químico magnésio ao ser queimado produz a cor da luz branco brilhante.
O elemento químico cálcio produz a cor laranja, é utilizado em fogos de artifício.
O elemento químico ferro utilizado em fogos de artifício produz a luz dourada.

Nos fogos de artifício as cores depende do elemento químico utilizado.
Para maiores informações pesquisar:
www.portalsaofrancisco.com.br/…bohr/modelo-atomico-de-bohr-1.php
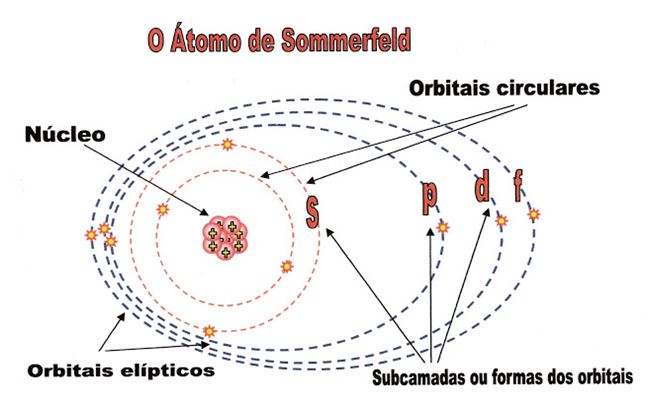
Sommerfeld e orbitais de trajetórias diferentes
Arnold Sommerfeld – físico nasceu em Konigsberg cidade da Prússia e faleceu em 1951. Em seus trabalhos científicos concluiu que os elétrons em um mesmo nível de camada podem fazer trajetórias diferentes nos seus orbitais, criando assim orbitais deferentes. Por exemplo: o orbital “s” tem a forma circular, o “p” tem a forma helicoidal e assim por diante.
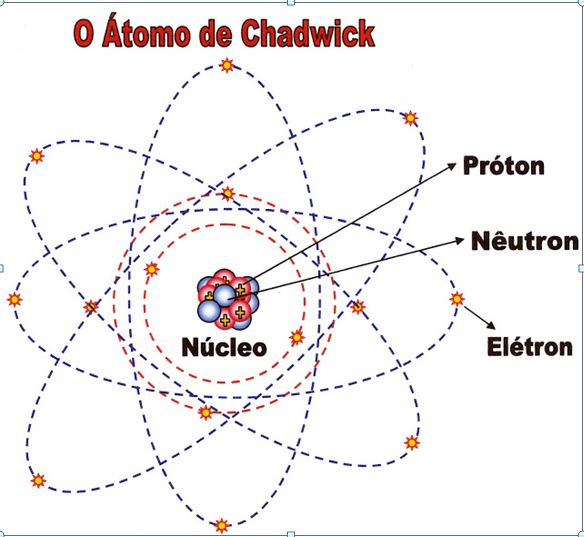
Chadwick – Um Núcleo Com Nêutrons
Chadwick – físico britânico nasceu no ano de 1891 em Cheshire e faleceu em Cambridge no ano de 1974. Descobriu a partícula neutra do núcleo do átomo o nêutron. Juntamente com Rutherford produziu a desintegração de vários elementos químicos com partículas alfa. A partir dessas experiências percebeu que partículas positivas eram atraídas para o lado negativo o cátodo e as partículas negativas para o lado positivo o ânodo e outras partículas não eram atraídas por nenhuma dessas forças atrativas. Concluiu então que havia uma partícula neutra.
Para maiores informações pesquisar:
en.wikipedia.org/wiki/James_Chadwick
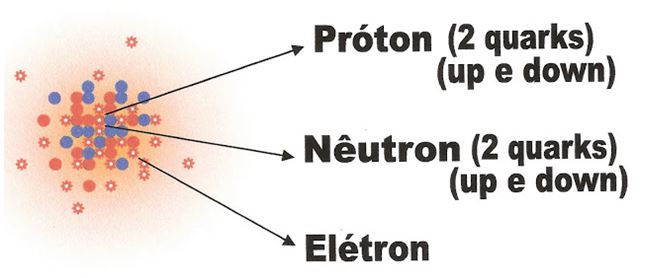
O Átomo Atual
O átomo atual é um intrincado de partículas e sub-partículas de cargas negativas e positivas em números iguais, ambas neutralizando a sua eletricidade. Igualmente aos modelos apresentados anteriormente, no seu núcleo estão os prótons formados pelas sub-partículas up e down e os nêutrons com suas duas sub-partículas up e down. Mais externamente encontram-se os elétrons.
Questionário
1) O formulador da teoria de que toda a matéria que existe é formada por átomos, que seriam partículas extremamente pequenas, esféricas, maciças, homogêneas, indivisíveis, indestrutíveis e sem carga elétrica, formando compostos a partir da combinação de dois ou mais átomos foi:
a) Arnold Sommerfeld por volta de 1919.
b) Joseph John Thomson por volta do ano de1898.
c) Ernest Rutherford por volta do ano de 1914.
d) Niels Bhor por volta do ano de 1915.
e) John Dalton por volta do ano de 1803.
2) Com suas experiências realizadas com o tubo de raios catódicos, foi o descobridor da partícula de carga negativa do átomo, também foi o inventor do espectrógrafo de massa que possibilitava medir as massas dos átomos, elaborou a teoria de que o átomo deveria ser uma pequena esfera de massa positiva, com elétrons de carga negativa incrustados ou dispersos na massa dessa esfera formando a partícula, que poderia também sofrer divisão foi:
a) Arnold Sommerfeld por volta do ano de 1919.
b) Joseph John Thomson por volta do ano de 1898.
c) Ernest Rutherford por volta do ano de 1914.
d) Niels Bhor por volta do ano de 1915.
e) John Dalton por volta do ano de 1803.
3) O pesquisador que determinou o átomo segundo o modelo do sistema solar, na qual o sol no centro seria a representação do núcleo do átomo carregado positivamente e o planetas em suas órbitas representariam os elétrons de carga negativa nos seus orbitais circulares distantes do núcleo separados por espaços vazios, foi:
- a) James Chadwick em 1932.
b) Hans Geiger em 1933.
c) Robert Oppenheimer em 1934.
d) Ernest Rutherford em 1919.
e) Frederick Soddy em 1914.
4) A produção da luz é o fenômeno que ocorre quando o átomo recebe energia elétrica, térmica, luminosa etc, e o seu elétron localizado no seu orbital sofre:
a) um desarranjo exterior e salta para uma camada mais próxima do núcleo. Cessando essa energia sobre o átomo, o elétron se fixa nesse orbital interno liberando o fóton ou luz.
b) um rearranjo em seu exterior e salta para um nível externo ou mais distante do núcleo. Cessando essa energia sobre o elétron do orbital externo, este volta para o interno liberando o fóton ou luz.
c) exterior salta para o nível interno ou mais próximo do núcleo. Cessando essa energia sobre o átomo, o elétron do orbital interno, volta para o externo liberando o fóton ou luz de diferentes comprimentos de ondas produzindo as cores.
d) transição eletrônica do elétron, que do nível exterior salta para o nível interno ou mais próximo do núcleo. Cessando essa energia sobre o elétron do orbital interno, este volta para o externo liberando os raios de luz infravermelha.
e) transição eletrônica, nesse caso, o elétron do nível exterior salta para um nível interno ou mais próximo do núcleo. Cessando esse energia sobre o átomo, o elétron do orbital interno volta para o externo liberando o fóton ou luz.
5) Nos seus experimentos Rutherford determinou a existência de uma região que contém carga elétrica positiva.
- a) Essa região está no centro do átomo onde forma o seu núcleo onde há grandes espaços vazios, aí estão localizadas as partículas de carga positiva do átomo.
b) Essa região está no centro do átomo onde forma o seu núcleo que é denso e pequeno, aí estão localizadas as partículas de carga positiva do átomo.
c) Essa região está na eletrosfera do átomo, onde forma o seu núcleo que é denso e pequeno, aí estão localizadas as partículas de carga positiva e negativa átomo.
d) Essa região está no centro do átomo onde forma o seu núcleo que é vazio e pequeno, aí estão localizadas as partículas de carga negativa do átomo.
e) Essa região está no centro do átomo onde forma ao sua eletrosfera que é densa e pequena, aí estão localizadas as partículas de carga positiva do átomo.


