Transformações químicas
CONCEITO
Constantemente a matéria que nos cerca sofre transformações. Em algumas transformações somente o estado ou a agregação do material são alterados, caracterizando uma transformação física da matéria. Em outros casos essas transformações resultam na produção de um novo material, com características diferentes do inicial.
As transformações químicas ocorrem quando há alteração na constituição do material, formando assim novas substâncias.
Ao aproximarmos um fósforo aceso de um recipiente com álcool, este começa a queimar. Essa queima é uma transformação química, pois há alteração na constituição do álcool, que ao entrar em contato com o ar oxigênio, se converte em gás carbônico e água, liberando energia.
Chamamos de sistema o conjunto de materiais isolados para estudo. Uma maneira de comprovar a existência de uma transformação química é através da comparação do estado inicial e final do sistema. Algumas evidências podem ser observadas, permitindo verificar a ocorrência dessas transformações, como modificação na cor, cheiro, estado físico e temperatura.
Confira a tabela com a descrição do sistema antes e depois da transformação:
| Processo | Estado Inicial | Estado Final |
| Queima da Gasolina |
|
Gases Incolores |
| Enferrujamento de um prego |
|
Pó vermelho castanho |
Em alguns casos, somente pela observação visual, não é possível identificar se houve uma transformação. Por exemplo, quando misturamos soluções de ácido clorídrico e hidróxido de sódio, ambas incolores. Após a mistura, o líquido resultante ainda é incolor, sem aparentar a formação de um novo material. No entanto uma reação química acontece quando essas substâncias são misturadas. Portanto é importante identificar e reconhecer os diferentes materiais que participam de uma transformação.
Toda transformação química constitui uma reação química. As substâncias presentes no início da reação recebe o nome de reagentes, e as que se formam recebem o nome de produto.
Exemplo: 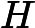
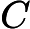
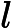

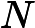
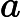
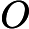
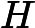
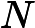
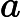
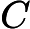
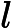

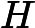
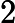
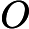
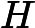
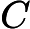
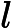 , o ácido clorídrico, e
, o ácido clorídrico, e 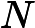
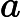
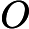
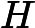 , o hidróxido de sódio, são as substâncias que reagem, ou seja os reagentes.
, o hidróxido de sódio, são as substâncias que reagem, ou seja os reagentes. 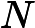
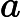
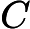
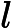 , o cloreto de sódio, e
, o cloreto de sódio, e 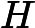
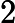
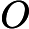 , a água, são as substâncias que se formam, ou seja, os produtos.
, a água, são as substâncias que se formam, ou seja, os produtos.
TRANSFORMAÇÕES
As transformações podem ocorrer das seguintes maneiras:
-Por ação do calor
Muitas substâncias são transformadas quando submetidas a uma fonte de calor. O cozimento de alimentos é um exemplo.
Quando há decomposição de um material devido ao calor, chamamos o processo de termólise. Ex: Termólise do magnésio
Magnésio + oxigênio → óxido de magnésio
-Por ação de uma corrente elétrica
Algumas substâncias necessitam de energia elétrica para que possam se transformar. A esse processo damos o nome de eletrólise.
Para a decomposição da água, em hidrogênio e oxigênio, por exemplo, utilizamos uma corrente elétrica para esta transformação.
-Por ação da luz
A fotossíntese é um exemplo de reação química que ocorre na presença da luz, onde a água e o dióxido de carbono do ar são transformados em oxigênio e glicose.
dióxido de carbono + água → oxigênio + matéria orgânica
A transformação do oxigênio em ozônio acontece através da luz ultravioleta. Essa reação por ação da luz também é de extrema importância, pois assim é formada a camada de ozônio que protege a Terra dos raios ultravioletas.
-Por ação mecânica
Uma ação mecânica (atrito ou choque) é capaz de desencadear transformações em certas substâncias.
Um exemplo é o palito de fósforo, que quando entra em atrito com a caixinha que o contém, produz uma faísca, que faz as substâncias inflamáveis do palito entrarem em combustão.
A explosão da dinamite e o acender de um isqueiro também são exemplos de transformações por ação mecânica.
-Pela junção de substâncias
Através da junção de duas substâncias podem ocorrer reações químicas. Isso frequentemente ocorre em laboratórios de química.
A adição do sódio metálico em água é um exemplo:
sódio + água → hidróxido de sódio + hidrogênio
QUESTÕES
(Unesp) A elevação da temperatura de um sistema produz, geralmente, alterações que podem ser interpretadas como sendo devidas a processos físicos ou químicos.
Medicamentos, em especial na forma de soluções, devem ser mantidos em recipientes fechados e protegidos do calor para que se evite:
(I) a evaporação de um ou mais de seus componentes;
(II) a decomposição e consequente diminuição da quantidade do composto que constitui o princípio ativo;
(III) a formação de compostos indesejáveis ou potencialmente prejudiciais à saúde.
A cada um desses processos – (I), (II) e (III) – corresponde um tipo de transformação classificada, respectivamente, como:
a) física, física e química.
b) física, química e química.
c) química, física e física.
d) química, física e química.
e) química, química e física.
Gabarito
(I) A evaporação é um processo de transformação física, onde apenas há mudança no estado físico do material, e sua constituição permanece alterada.
(II) A decomposição de substâncias caracteriza uma transformação química, pois a constituição do material é alterada
(III) A formação de novos compostos é produto de uma reação química.
Letra B.
(UFPE) Em quais das passagens a seguir está ocorrendo transformação química?
1) “ O reflexo da luz nas águas onduladas pelos ventos lembrava-lhe os cabelos de seu amado”.
2) “ A chama da vela confundia-se com o brilho nos seus olhos”.
3) “Desolado, observava o gelo derretendo em seu copo e ironicamente comparava-o ao seu coração.”
4) “Com o passar dos tempos começou a sentir-se como a velha tesoura enferrujando no fundo da gaveta.”
Estão corretas apenas:
a) 1 e 2
b) 2 e 3
c) 3 e 4
d) 2 e 4
e) 1 e 3
Gabarito
Nas citações 1 e 3 estão representadas transformações físicas, como refração da luz e mudanças de estado físico, respectivamente.
A citação 2 faz referência à chama de uma vela, onde há uma reação química chamada combustão.
Já na citação 4, a tesoura enferrujada, representa um processo de oxidação, uma transformação química.
Letra D.


