Aula 8
CONTEÚDOS E TEMAS: Relações quantitativas de massa e de quantidade de matéria (mol) nas transformações químicas que ocorrem em soluções.
COMPETÊNCIA E HABILIDADES. Utilizar a grandeza quantidade de matéria (mol); concentração em mol . L-1. Fazer usos da linguagem química; construir o conceito de concentração em quantidade de matéria/volume para ampliar a compreensão do significado da concentração e aplica-lo a novas situações que permitem melhor entendimento do mundo físico.Construir e aplicar conceitos relativos ás proporções de reagentes e produtos numa reação em solução, compreendendo a importância desses cálculos na sociedade; interpretar a equações químicas em termos quantitativos.
5. Concentração em mol/L Molaridade (M)
A molaridade de uma solução é a concentração em número de mols de soluto e o volume de 1L de solução.Onde:
M = molaridade (mol/L)
n1= número de mols do soluto (mol)
V = volume da solução (L)Concentração é o termo que utilizamos para fazer a relação entre a quantidade de soluto e a quantidade de solvente em uma solução.
As quantidades podem ser dadas em massa, volume, mol, etc.
Observe:
m1= 2g
n2 = 0,5mol
V = 14L
Exemplos:
massa de 2g do soluto NaCl: m1= 2g
número de mols de 0,5mol do solvente água: n2 = 0,5mol
volume da solução de 14L:
V = 14L
Em laboratório, é muito importante conhecer a concentração em mol/L das soluções químicas
A concentração em mol/L (M) é também muito conhecida como Concentração Molar, e também Molaridade. No entanto, esses nomes, apesar de bastante difundidos, não são recomendados pela SBQ (Sociedade Brasileira de Química).
Os nomes corretos são Concentração em mol/L ou Concentração em quantidade de matéria.Em laboratórios e indústrias químicas, essa é a concentração mais utilizada, pois é a recomendada pelo Sistema Internacional de Unidades (SI) e pela União Internacional da Química Pura e Aplicada (IUPAC).
É uma relação mais sofisticada que a concentração comum.Seu cálculo é feito dividindo-se a quantidade de matéria ou substância (mol) pelo volume da solução, conforme a expressão matemática abaixo:
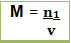
Onde M = concentração em mol/L
n1 = número de mols do soluto (mol), lembrando que o índice 1 indica grandezas relacionadas ao soluto
v = volume da solução (L)Desse modo, se for dito que uma solução tem concentração de 4,5 mol/L, quer dizer que em cada litro da solução (não do solvente) tem-se dissolvidos 4,5 mols do soluto.
Porém, em laboratório é mais fácil conseguir a massa em gramas do soluto e a sua massa molar, do que a sua quantidade de máteria em mols.
Assim, sabendo-se que: 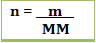 ou se referindo ao soluto:
ou se referindo ao soluto:
Podemos substituir o valor de n1 na fórmula da concentração em mol/L e teremos:

Considere o problema abaixo para ver como se usa essa fórmula a fim de determinar a concentração de uma solução:“Qual será a concentração em quantidade de matéria de uma solução que foi preparada dissolvendo-se 120 g de hidróxido de sódio em 2 L de água e obteve-se uma solução com 2 L?”Dados:
m1 = 120 g
v = 2 L
MM (NaOH) = 40 g/mol• Substituindo os valores dados na fórmula:
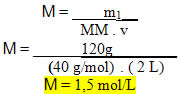
https://www.youtube.com/watch?v=D4fEHBYT7Kc


