Aula 7
Situação de Aprendizagem – Concentração de Soluções – – unidades de concentração; % em massa g.L-1; ppm.Compreender o conceito de concentração; compreender as unidades que expressam a composição das soluções e utiliza-las adequadamente; realizar cálculos envolvendo as diferentes unidades de concentração e aplica-los no reconhecimento de problemas relacionados a quantidade da água para o consumo.
CONCENTRAÇÃO DE SOLUÇÕES
Concentração é o termo que utilizamos para fazer a relação entre a quantidade de soluto e a quantidade de solvente em uma solução. As quantidades podem ser dadas em massa, volume, mol, etc. A concentração de uma solução deve ser expressa em unidades quantitativas. São usadas as chamadas unidades de concentração que são medidas quantitativas da afinidade de soluto que se dissolve. A quantidade relativa de uma substância é conhecida como concentração e é expressa em diferentes unidades.
TIPOS DE CONCENTRAÇÃO1.Concentração Comum (C)
Também chamada concentração em g/L (grama por litro), relaciona a massa do soluto em gramas com o volume da solução em litros.Onde:
C = concentração comum (g/L)
m1= massa do soluto(g)
V = volume da solução (L)Exemplo:
Qual a concentração comum em g/L de uma solução de 3L com 60g de NaCl?
OBS: Concentração comum é diferente de densidade, apesar da fórmula ser parecida. Veja a diferença:A densidade é sempre da solução, m2 então:
Na concentração comum, calcula-se apenas a m soluto, ou seja, m1Cada grandeza tem um índice. Utilizamos índice:
1 = para quantidades relativas ao soluto
2 = para quantidades relativas ao solvente
nenhum índice = para quantidades relativas à soluçãom=m1+m2
2. Densidade
Densidade é a massa por unidade de volume de uma substância. O cálculo da densidade é feito pela divisão da massa do objeto por seu volume.(UFU-MG) Em condições ambientes, a densidade do mercúrio é de aproximadamente 13 g/cm3. A massa desse metal, da qual um garimpeiro de Poconé (MT) necessita para encher completamente um frasco de meio litro de capacidade, é de?”
Resolução:
Dados:
dmercúrio = 13 g/cm3
V = 0,5 L = 500 mL = 500 cm3
m = ?
Da fórmula da densidade, temos:
d = m/V
m = d . V
m = (13 g/cm3) . (500 cm3)
m = 6500 g
Por exemplo, digamos que você quer descobrir a densidade de um pedaço de ferro de forma irregular. Depois de determinar a massa desse objeto, você determinará o volume dele fazendo o seguinte:
- Coloque determinado volume de água em uma proveta;
- Depois pegue o pedaço de ferro e coloque-o totalmente submerso nessa proveta;
- Observe qual foi a diferença no volume da água. Pronto! Esse é o volume do sólido!
Por exemplo, digamos que a massa “pesada” deu igual a 39,5 g e que o volume de água na proveta aumentou de 50 mL para 55 mL, então a diferença do volume, isto é, 5 mL, corresponde ao volume do pedaço de ferro. Calculando a densidade dele, temos:d = m
Vd = 39,5 g
5 mL
d = 7,9 g/mL
Essa é exatamente a densidade do ferro a 20ºC.Pode-se dizer também que quanto menos o volume de água for deslocado, menos denso é o objeto.
3. Título ou Porcentagem em massa de uma solução
É a relação (razão) entre a massa do soluto e a massa da solução. Ele não tem unidades e pode ser expresso também em porcentagem. Nesse caso é só multiplicar o resultado por 100%. Além disso, existe a porcentagem em volume da solução

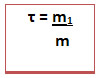
A massa da solução pode ser obtida somando-se a massa do soluto com a massa do solvente (m = m1 + m2).
O título é adimensional, isto é, um número puro e sem unidades. No entanto, se você quiser expressar essa relação dizemos que determinada solução possui título igual a 0,35, isso significa que para cada unidade de massa da solução há 0,35 unidade de massa de soluto e 0,65 unidade de massa de solvente.Um exemplo bastante comum do uso da porcentagem no cotidiano ocorre em soluções aquosas, como é o caso do soro fisiológico.
O soro fisiológico é uma solução de NaCl (cloreto de sódio – sal de cozinha), que apresenta uma porcentagem em massa de 0,9 %. Isso significa que existem 0,9 grama de NaCl para cada 100 gramas de solução. Assim, podemos concluir que seu título é 0,009 em porcentagem em massa (τ%), basta multiplicar o resultado por 100%. Assim, quando

O exemplo é uma solução líquida, mas o título é usado para exprimir a concentração em qualquer estado de agregação (sólido, líquido ou gasoso).No caso de soluções em que todos os componentes são gasosos ou são líquidos é possível também calcular o título em volume (τv), por relacionar o volume do soluto com o volume da solução (v),
.
segundo a fórmula:
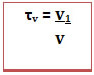
O título em volume também pode ser expresso em porcentagem:
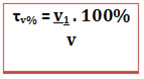
A diferença que existe quando se trabalha com o título em volume é que no título em massa, conforme dito anteriormente, a massa da solução pode ser obtida somando-se a massa do soluto com a massa do solvente. Já aqui isso não é possível, isto é, não podemos somar o volume do soluto com o volume do solvente para obter o volume da solução. Isso ocorre porque as forças intermoleculares existentes entre esses líquidos alteram os seus volumes quando se misturam. Portanto, o volume da solução deve ser medido experimentalmente ou fornecido no exercício.Por exemplo, a seguir temos a imagem de um frasco de álcool etílico que indica a porcentagem em volume de 96%. Isso quer dizer que em cada 100 unidades de volume da solução, 96 unidades são do álcool e apenas 4 sãode água.
.jpg)
4. Partes por Milhão (ppm)
Concentração PPM Partes por milhão ou abreviadamente ppm é a medida de concentração que se utiliza quando as soluções são muito diluídas. Concentrações ainda menores podem ser expressas em partes por bilhão (ppb), partes por trilhão, etc, no que se chama partes por notação, da qual a ppm é a mais usual.

A concentração em ppm é muito usada para medir gases poluentes no ar e metais pesados na água
Quando a concentração de uma solução (principalmente líquidas e gasosas) é dada em valores extremamente pequenos, costuma-se utilizar a unidade parte por milhão (ppm).A concentração de soluções químicas refere-se à quantidade de soluto que existe em uma quantidade padrão de solução ou em uma quantidade padrão de solvente. Assim, a concentração em partes por milhão pode ser definida da seguinte maneira:
* Partes por milhão (ppm): Indica quantas partes de soluto (em massa ou em volume) existem em um milhão (1 000 000 ou 106) de partes da solução (também em massa ou em volume).
Isso significa que podemos descobrir o ppm pela seguinte expressão matemática:
x ppm = __x parte do soluto__
106 partes de solvente (solução)
Visto que a quantidade de soluto é extremamente pequena, nos cálculos que utilizam a fórmula acima, o volume ou a massa da solução serão considerados exatamente os mesmos do solvente, ou seja, se soubermos que uma solução aquosa de permanganato de potássio (KmnO4(aq)) tem concentração de 70 ppm, isso significa que existem 70 g de permanganato em 1 milhão de gramas da solução ou de água, conforme mostra a fórmula:
70 ppm = _70 g do permanganato_
106 g de água
Tendo em vista que:106 g = 1 t;
10-3 g = 1 mg;
103 g = 1 kg;
10-6 g = 1 μg.
Podemos fazer então o cálculo usando também as seguintes relações:
* 1 ppm = 1 g do soluto__
1 t de solvente (solução)* 1 ppm = 1 mg do soluto__
1 kg de solvente (solução)* 1 ppm = 1 μg do soluto__
1 g de solvente (solução)
Relações similares podem ser feitas com as unidades de volume:*
1 ppm = 1 L do soluto__
1000 m3 de solvente (solução)* 1 ppm = 1 mL do soluto__
1 m3 de solvente (solução)* 1 ppm = 1 μL do soluto__
1 L de solvente (solução)* 1 ppm = 1 mL do soluto__
1000 L de solvente (solução)
Também podemos relacionar massa e volume em soluções, por exemplo, que são formadas por um soluto sólido dissolvido em um solvente líquido:
* 1 ppm = 1 g do soluto__
1000 L de solvente (solução)* 1 ppm = 1 mg do soluto__
* 1 ppm = 1 μL do soluto__
1 mL de solvente (solução)
Assim como ppm significa “partes por milhão”, ppb significa “partes por bilhão”, e ppt é “partes por trilhão”:
x ppb = __x parte do soluto__
109 partes de solvente (solução)x ppt = __x parte do soluto__
1012 partes de solvente (solução)
Essas concentrações tão pequenas são aplicadas principalmente quando se trabalha com dados referentes à poluição do ar e da água. Veja abaixo uma tabela que mostra os principais gases-estufa presentes na atmosfera terrestre e a sua abundância (dados de 1998):
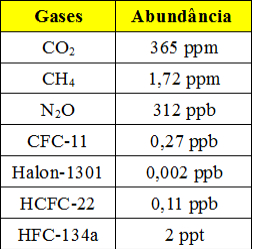
Tabela com abundância de gases-estufa na atmosfera
Esse é um exemplo que mostra que o uso desse tipo de concentração é importante tanto para estabelecer um limite máximo para esse e outros poluentes quanto para monitorá-los. Também pode ser usado em cosméticos e produtos de limpeza e higiene pessoal para mostrar a quantidade de seus constituintes.Veja agora dois exemplos de exercícios envolvendo o cálculo da concentração de soluções em ppm e ppb:
Exemplo 1: (Fatec-SP) No rótulo de uma garrafa de água mineral lê-se, entre outras informações:Conteúdo: 1,5 litro;
Nitrato de sódio: 6,0 ppm.Considere que 1 ppm equivale a 1 mg de soluto por litro de solução aquosa. A massa de nitrato de sódio ingerida por uma pessoa que bebe um copo 300 mL dessa água é?
a) 0,003 g
b) 0,0018 g
c) 9,0 g
d) 6,0 mg e) 1,2 mg
Resolução:
1 mg de nitrato de sódio (1 ppm) ——- 1 L6 mg de nitrato de sódio (6 ppm) ——- 1000 mLx————————– 300 mLx = 300 . 6
1000
x = 1,8 mg de nitrato de sódio
1 g —– 1000 mg
y——– 1,8 mg
y = 1,8 . 1
1000
y = 0,0018 g de nitrato de sódioA alternativa correta é a letra “b”.
Exemplo 2: (Fatec-SP) Uma das formas de medir o grau de intoxicação por mercúrio em seres humanos é a determinação de sua presença nos cabelos. A Organização Mundial de Saúde (OMS) estabeleceu que o nível máximo permissível, sem risco para a saúde, é de 50 ppm, ou seja, 50. 10-6 g de mercúrio por grama de cabelo. Forneça a expressão dessa concentração em ppb.
Resolução:
1 bilhão = 109.50 partes de mercúrio —- 106 partes de cabelox——————————109 partes de cabelox = 109 . 50
106
x = 5 . 104 ppb


