Aula 1
1ª semana
Acordo Pedagógico.
Seu ingresso no CURSO deve lhe representar uma nova fase de vida em relação a atitudes cada vez mais maduras, tanto nos estudos como em respeito ao próximo, solidariedade humana e cidadania.
“Amarás ao teu próximo como a ti mesmo”. Respeito Mútuo é o principal compromisso ético que todo ser humano deve assumir é o de tratar as pessoas como pessoas, procurando entender o ponto de vista do outro mesmo que não esteja de acordo com seu princípios e teorias.
O intuito é ajudar crianças e adolescentes a aprenderem a aprender, a buscarem o desenvolvimento a serem protagonistas da própria aprendizagem como ser integral e vislumbrarem suas potencialidades de ação social.
Não seja vítima da sua própria história! Não espere que alguém faça por você aquilo que só você pode fazer; escrever a sua história. Não seja manipulado por discursos políticos que promovem o coitadíssimo e por isso merecem uma recompensado Estado. Nossa recompensa é o fruto que colhemos. A colheita é consequência do que plantamos. Nada funciona de forma diferente, se você plantar e perseverar, você vai colher.
O QUE PRECISO FAZER?
Trazer o caderno do aluno em todas as aulas. Ler o texto em casa. Tentar responder às Questões durante a semana, Assistir vídeo aulas. Na sala de aula faremos discussão do texto e responder as questões do texto, se necessário tirar as dúvidas.
ESTRATÉGIAS
Desenvolve aulas a partir de um levantamento prévio do conhecimento dos alunos, solicita pesquisas sobre o tema para introduzir o conteúdo utilizando debates e discussões e interligando com questões do cotidiano, finalizando com exercícios de fixação. Interesse por mostrar ao aluno a utilização do conteúdo com o mercado de trabalho, ética e cidadania. Apoia suas aulas com textos, recursos áudio visuais, filmes, notícias, experimentos entre outros.
RECURSOS
Conteúdos retirados de livros didáticos, apostilas, pesquisas, vídeos, exemplos e experimentos.Análise de situações do cotidiano e suas relações com os conteúdos trabalhados.Livro Didático (Química na abordagem do cotidiano), Caderno do aluno.
AVALIAÇÃO
• Todas as atividades desenvolvidas pelos estudantes serão avaliadas no processo de aprendizagem:
• 5,0 pontos (Avaliação atitudinal): responsabilidade, pontualidade, participação em aula, tarefas de casa, comprometimento, empenho em aprender, respeito e tolerância às limitações dos colegas, disciplina, cooperação, frequência, caderno, apostila, participação em projetos. Sugestão de avaliação: respostas dadas às questões propostas;
• 3,0 pontos (Avaliação conceitual): exercícios de fixação e prova.
• 2,0 pontos (Pesquisas ou trabalhos):serão avaliadas considerando os seguintes critérios: Capa; Resumo; Conclusão; Organização; Bibliografia; Apresentação.
RECUPERAÇÕES DA APRENDIZAGEM O processo de recuperação da aprendizagem é realizado de maneira continua e imediata, explorando suas habilidades sobre os conteúdos ministrados no bimestre. Assim, findada a avaliação do processo ensino-aprendizagem, referente a cada situação didática, é efetuada a retomada dos processos dos conteúdos estudados para esclarecimento de eventuais e/ou pendentes dúvidas e, em seguida realizada uma nova avaliação do processo, utilizando-se desta vez, de distintos instrumentos nos quais são sempre considerados os avanços no aprendizado e o comprometimento por parte de discente, respeitando sua individualidade e seu tempo de aprendizagem por isso os alunos não são avaliados da mesma forma
Aula 2
2ª semana
Situação de Aprendizagem 1 – A atmosfera pode ser considerada uma fonte de materiais úteis para o ser humano?
Conteúdos e temas: composição média do ar atmosférico; obtenção do oxigênio, do nitrogênio e dos gases nobres por destilação fracionada do ar atmosférico; diversos usos do oxigênio, do nitrogênio e dos gases nobres.
Competências e habilidades: desenvolver a leitura e a interpretação de textos, de tabelas, de esquemas e de linguagens próprios da Química; desenvolver as habilidades de síntese e de argumentação consistentes exigidas em algumas questões que acompanham os textos; compreender o processo da destilação fracionada no nível macroscópico para poder explicá-lo no nível microscópico; buscar, selecionar, organizar e relacionar dados e informações apresentados em diferentes mídias e representados em diferentes formas para resolver problemas.
Sugestão de estratégias de ensino: discussões desencadeadas por perguntas e por análises de informações; leitura de textos seguida de discussões; pesquisas em material escrito e na internet. Sugestão de recursos: material escrito; cópias de textos acompanhados de perguntas abertas; livros didáticos e paradidáticos. Sugestão de avaliação: respostas dadas às questões propostas; realização das tarefas requisitadas
Composição do ar atmosférico
– parte 1
PSIU!!! BOM DIA…BOA TARDE…BOA NOITE…
Quando você se levantou pela manhã, eu já estava do seu lado, enquanto dormia, eu vigiava e guardava o seu sono. Eu lhe acompanhei durante o dia e você nem percebeu que eu estava do seu lado. Você trabalhou,viajou,realizou negócios, alcançou vitórias, mas…você não percebeu que eu estava cooperando com você. Não lhe culpo por não me notar, pois estou tão perto, que me tornei invisível, mas sem mim você não vive.
O ar atmosférico, o ar que nos rodeia, por ser transparente e muitas vezes inodoro, é tido como um nada, como um espaço vazio. Mesmo quando o vento sopra, quando ouvimos notícias sobre furacões, quando as previsões do tempo apresentam falas como “Uma massa de ar frio vinda do litoral deverá atingir a costa…”, não pensamos no ar como matéria, como uma mistura de gases. Em hospitais, pacientes com dificuldades respiratórias utilizam máscaras de oxigênio. Em algumas dessas máscaras, o ar atmosférico pode ser enriquecido com diferentes quantidades de gás oxigênio. A escolha da composição do ar oferecido é indicada para que haja uma oxigenação adequada às necessidades de cada paciente. O gás oxigênio é comercializado em cilindros. Nas aulas de Ciências, aprendemos que o ar atmosférico é composto principalmente pelos gases nitrogênio e oxigênio. A tabela a seguir apresenta dados sobre a composição média do ar seco, assim como as temperaturas de ebulição dos componentes do ar à pressão de 1 atmosfera.
Neste volume, o foco do estudo recairá sobre a biosfera como fonte de materiais úteis para a sobrevivência do ser humano.
A biosfera compreende as partes da hidrosfera, da litosfera e da atmosfera habitadas pelos seres vivos. Desse modo, a biosfera não é simplesmente um lugar, e sim um sistema de relações entre os seres vivos e entre a matéria e a energia que os circundam e das quais são constituídos.
A COMPOSIÇÃO DA ATMOSFERA
Nossa atmosfera não é homogênea – cerca de 80% dos gases que a formam ficam na troposfera, região mais baixa, que vai do nível do mar até cerca de 15 km de altura. À medida que você se afasta da superfície da Terra, a atmosfera fica cada vez mais rarefeita, isto é, a concentração dos gases e a pressão atmosférica diminuem.
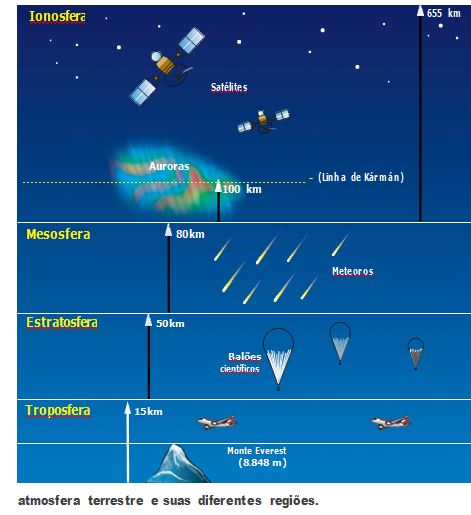
há a estratosfera, que se estende da troposfera até, aproximadamente, 50 km de altura. Ela concentra cerca de 19% dos gases existentes na atmosfera e é onde se encontra o gás ozônio, formado da interação entre a radiação ultravioleta do Sol e o gás oxigênio (O2). O gás ozônio, formado pela radiação ultravioleta, protege a Terra, sendo o responsável pela absorção da maior parte dessa radiação, que é nociva a todas as formas de vida do planeta.
A mesosfera é a região seguinte e se estende até cerca de 80 km acima da estratosfera. Nela, os corpos celestes começam a sofrer a ação do atrito, que aumenta à medida que penetram a atmosfera terrestre. Se o corpo celeste for pequeno, a ação do atrito consegue até vaporizá-lo, impedindo-o de colidir com a superfície da Terra.
Acima da mesosfera tem-se a ionosfera, que vai até cerca de 800 km da superfície da Terra. É formada por plasma, um conjunto de átomos, elétrons e íons positivos, que é considerado o quarto estado da matéria, semelhante ao material utilizado na fabricação das TVs de plasma. É uma região muito importante para as comunicações, já que lá se propagam a sondas de rádio a grandes distâncias.
A atmosfera em que você está mergulhado já foi considerada um dos quatro elementos, responsáveis por formar tudo o que existia: ar, água, terra e fogo. Hoje, sabe-se que a atmosfera é uma mistura de gases que podem ser separados e utilizados em diferentes áreas de atividades humanas, como na Medicina, na indústria e em muitas outras.
RECURSOS OBTIDOS DA ATMOSFERA
Nossa atmosfera é formada por 78% de nitrogênio, 21% de oxigênio e 1% de diversos outros gases, sendo o argônio o que tem maior participação nessa pequena fração. Do ar atmosférico obtêm-se o gás oxigênio, o gás nitrogênio e o gás nobre argônio por meio de destilação fracionada. O processo ocorre por meio das seguintes etapas:
- O ar é purificado pela filtração, que retira assim purezas sólidas. Depois, é levado a um compressor, onde é comprimido e borbulhado em uma solução de hidróxido de sódio para se retirar o CO2 existente, segundo a reação:
2 NaOH(aq) + CO2(g) → Na2CO3(aq) + H2O(l)
Então, o ar é comprimido novamente, e a água nele existente, separada.
- Esse ar comprimido passa por trocadores de calor, é resfriado por expansão a – 185 °C e liquefeito, indo à coluna de fracionamento para a destilação fracionada.
- Na torre de destilação, o nitrogênio, que apresenta temperatura de ebulição mais baixa, vaporiza e sobe pela coluna, deixando o ar líquido enriquecido de oxigênio. O processo continua até a separação total.
- Os gases, assim separados, são engarrafados sob pressão no estado líquido e comercializado.
O gás oxigênio é utilizado em diferentes indústrias, no enriquecimento do ar dos fornos em siderúrgicas, na fusão e na redução metalúrgicas, na produção de papel e celulose (como branqueador), nos processos de corte e solda, na Medicina (no enriquecimento do ar de incubadoras de recém-nascidos, em tratamentos intensivos, cirurgias, respiradores de UTIs etc.).
O gás nitrogênio é usado na fabricação do gás amônia, matéria-prima fundamental para a obtenção de fertilizantes e de ácido nítrico. Por ser pouco reativo, é utilizado: em tanques que armazenam líquidos explosivos; no transporte de alimentos, para evitar a oxidação, o desenvolvimento de bolor e o aparecimento de insetos;durante a produção de circuitos integrados existentes em todos os equipamentos eletrônicos; na fabricação de borracha e plásticos, para evitar reações indesejáveis; e na conservação das células reprodutivas tanto de seres humanos quanto de outros animais.
O argônio, também obtido das instalações de fracionamento do ar, é utilizado como gás protetor nos processos de solda e na indústria de lâmpadas e de tubos luminosos. Com exceção do hélio, que é obtido do gás natural, no qual se apresenta em maior concentração, os outros gases nobres, como o argônio, o criptônio e o xenônio, também são obtidos do fracionamento do ar atmosférico para serem utilizados em lâmpadas e na produção de atmosfera inerte(que não reage).
Além de o ar atmosférico ser fonte de substâncias, ele é também fonte de energia, sendo utilizado desde o século X nos moinhos e, hoje, nos parques eólicos na obtenção de energia elétrica.
Aula 3
Questões
1. O que é temperatura de ebulição?
2. Para uma mesma substância a uma dada pressão, o valor da temperatura de ebulição
é igual ao valor da temperatura de liquefação, ou seja, TE = TL. Explique a razão de, às vezes, usarmos a expressão “temperatura de ebulição” e, às vezes, usarmos “temperatura de liquefação”.
3. A temperatura de ebulição do nitrogênio, de acordo com a tabela, é de – 196 °C a temperatura de a –200 °C, o nitrogênio encontra-se no estado líquido.
4. A -190 ºC e à pressão de 1 atm, quais componentes do ar estão no estado sólido,
quais estão no estado líquido e quais estão no estado gasoso?
5. Embora o gás hélio esteja presente no ar atmosférico e em uma quantidade maior que a dos gases criptônio e xenônio, comercialmente é obtido de jazidas subterrâneas de gás natural. Procure dar uma explicação para esse fato.
6. Em uma torre de destilação fracionada do ar, o nitrogênio deve ser obtido em um prato situado acima do prato de onde sai o oxigênio. Procure dar uma explicação para essas posições.
7. Explique: “as moléculas de nitrogênio, oxigênio e de hidrogênio são apolares”.
8. Como explicar que, a uma mesma pressão, o gás oxigênio se liquefaça a uma temperatura mais alta que o gás hidrogênio?
PRESSÃO
A pressão é a força aplicada por unidade de área. Suponha que você vai mar- telar dois pregos em uma madeira, um com a ponta perfeita e o outro sem ponta. Uma boa martelada enterra o primeiro prego com facilidade, mas o segundo prego, com a mesma martelada, provavelmente vai entortar e não penetrará na madeira. Se a força aplicada é a mesma, qual a razão para um prego entrar com facilidade na madeira e o outro não? Isso se explica pelo fato de, no primeiro caso, a força ter sido aplicada sobre uma área da madeira menor que a do segundo caso.
A relação entre a força aplicada e a área que foi submetida a tal força é a pressão, representada pela equação em que P é a pressão, F, a força e A, a área em que a força foi aplicada: P = F , mostrando que a pressão é diretamente proporcional à
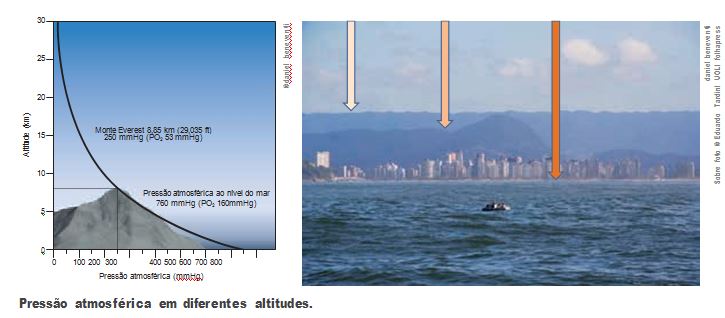 A força e inversamente proporcional à área Você já ouviu falar que a pressão atmosférica diminui com a altitude? A razão disso está na coluna de ar sobre a superfície da Terra. No nível do mar, a pressão é maior porque há uma coluna de ar maior; em uma montanha, a coluna de ar é menor, e também a pressão atmosférica. O gráfico da figura a seguir relaciona a pressão atmosférica com a altitude.
A força e inversamente proporcional à área Você já ouviu falar que a pressão atmosférica diminui com a altitude? A razão disso está na coluna de ar sobre a superfície da Terra. No nível do mar, a pressão é maior porque há uma coluna de ar maior; em uma montanha, a coluna de ar é menor, e também a pressão atmosférica. O gráfico da figura a seguir relaciona a pressão atmosférica com a altitude.
| Monte Everest 8,85km (29,035ft)250 mmHg (P O2 53 mmHg) |
| Pressão atmosférica ao nível domar 760 mmHg (PO2 160 mmHg) |
Aula 4
SITUAÇÃO DE APRENDIZAGEM 2 COMPOSIÇÃO, PROCESSAMENTO E USOS DO PETRÓLEO, DO GÁS NATURAL E DO CARVÃO MINERAL
Atividade 1 – Petróleo e gás natural como fontes de materiais Você já deve ter ouvido nos meios de comunicação ou mesmo lido em revistas e jornais alguma notícia sobre a presença de petróleo na camada pré-sal das bacias do Sul e do Sudeste do Brasil. O petróleo tem importância econômica nos dias de hoje? Você já pensou que tipo de material é o petróleo? Será uma substância composta? Será uma solução? Será uma mistura? Nesta atividade, você buscará respostas para essas questões.
Leitura e análise de texto Processos envolvidos na obtenção dos derivados do petróleo
O gás natural e sua purificação O gás natural é um combustível fóssil e, assim como o petróleo, foi formado pela decomposição de matéria orgânica durante milhões de anos. Ele é encontrado em rochas porosas no subsolo e, em geral, em uma camada acima da reserva de petróleo. No entanto, as rochas porosas que armazenam o gás também podem estar em locais onde não se encontra reserva de petróleo.
Competência e habilidades. Desenvolver a leitura e a interpretação de textos, compreender e refletir em linguagem discursiva. Tomar consciência dos conteúdos avaliações e forma de trabalho
Questões
1. “O petróleo continua sendo um recurso básico para a moderna sociedade industrial, apesar de ter sofrido um relativo declínio nas últimas décadas. Em 1971, representava cerca de 68% da energia consumida no mundo, mas em 2007 essa proporção tinha baixado para cerca de 34%, uma porcentagem ainda significativa e maior que a de qualquer outra fonte de energia isoladamente. Se somarmos o petróleo ao gás natural, geralmente associado a ele e que sozinho representa cerca de 20% do consumo energético mundial, teremos um total de 54% da energia produzida pela humanidade, com essas suas fontes fósseis em conjunto”.
(VESENTINI, J. W. Geografia: o mundo em transição. São Paulo: Editora Ática, 2012. p.75.)
Em função de suas importâncias, podemos concluir que o petróleo e o gás natural são fontes de energia utilizadas em diversos setores de atividades, dentre os quais podemos assinalar:
a) residencial, energético, transportes e industrial.
b) transportes, agrícola, industrial e extrativista
c) industrial, residencial, energético e construção civil
d) comercial, residencial, transportes e ambiental.
2. A comercialização do petróleo em nível internacional está, em grande parte, associada à atividade da OPEP – Organização dos Países Exportadores de Petróleo –, cuja principal função é:
a) diversificar o preço do produto em todo o planeta, a fim de dinamizar a livre concorrência entre os países petrolíferos.
b) cartelizar e controlar o valor do barril de petróleo entre os seus países-membros.
c) incentivar e financiar pesquisas científicas sobre a extração e o refino de petróleo.
d) organizar os produtores de petróleo em cooperativas a fim de livrar os produtores das ações do Estado.
3. O petróleo é um importante hidrocarboneto, utilizado como fonte de energia e como matéria-prima para a produção de plástico, tintas, solventes e outras mercadorias. Sua formação é resultante da decomposição de matéria orgânica animal e vegetal retida nos subsolos. Dessa forma, as regiões geográficas onde é mais provável encontrar poços de petróleo são:
a) regiões costeiras, situadas nas zonas de encontro entre duas placas tectônicas.
b) em zonas oceânicas e locais que já estiveram cobertos pelos oceanos.
c) em regiões continentais, em pontos de profundas depressões absolutas.
d) em zonas próximas à Linha do Equador, a exemplo do Oriente Médio
4. (PUC-Rio – adaptada) Petróleo mais caro preocupa EUA, União Europeia e Japão. Em 2004, os preços do petróleo no mercado internacional tiveram sucessivas altas, lançando dúvidas sobre o crescimento econômico mundial. A elevação do preço do petróleo é consequência de uma série de fatores e tem graves repercussões em alguns países.
A alternativa que NÃO apresenta corretamente uma dessas situações é:
a) a alta do preço do petróleo interfere na economia japonesa que depende do petróleo importado.
b) o preço do petróleo depende das cotas de petróleo estabelecidas pelos países da OPEP.
c) o preço do petróleo aumenta devido aos estoques acumulados pelos Estados Unidos.
d) o preço do petróleo oscila devido à situação de insegurança existente no Oriente Médio.
Aula 5
Situação de Aprendizagem 2
Estudo da síntese e da produção industrial da amônia a partir dos gases nitrogênio e hidrogênio
Conteúdos e temas: síntese da amônia pelo processo Haber; influência da pressão e da temperatura no
controle da rapidez e do rendimento de transformações químicas; transformações químicas reversíveis
que não se completam e entram em equilíbrio dinâmico.
Competências e habilidades: compreender como os contextos histórico, econômico e cultural se inter-
-relacionam e influenciam o desenvolvimento de um novo processo químico, no caso, o da síntese da
amônia; analisar dados para compreender que existem transformações químicas que “não se completam”
segundo as previsões estequiométricas; entender o que acontece em sistemas e processos químicos
a partir de dados apresentados em tabelas e em descrições de procedimentos experimentais (experimentos
teóricos); valorizar o controle de variáveis em um processo de investigação.
Sugestão de estratégias de ensino: discussões desencadeadas por perguntas e por análises de informações;
leituras de textos seguidas de discussões.
Sugestão de recursos: material escrito, textos acompanhados de perguntas abertas.
Sugestão de avaliação: respostas dadas às questões propostas; realização das tarefas.
Quando Haber começou o seu trabalho, já se sabia que a síntese da amônia aparentemente não se completava, pois, colocando-se quantidades estequiométricas de hidrogênio e de nitrogênio, chegava um momento em que a quantidade de amônia formada atingia um limite máximo que não mais se modificava com o passar do tempo.
N2(g) + 3H2(g) –> 2NH3 (g)
Questões
1. Observe o que ocorreu na realidade: formou-se toda a amônia que se esperava de acordo com a previsão teórica?
2. Que gases estão presentes no sistema depois da transformação química ter atingido seu limite máximo, sua extensão máxima?
3. Na reação de combustão de certa quantidade de álcool etílico (etanol), a previsão teórica da quantidade de produtos formados é confirmada na prática. Pode-se dizer que essa é uma transformação química que entra em equilíbrio químico? Explique
4. A síntese da amônia a partir dos gases hidrogênio e nitrogênio era um dos grandes desafios da humanidade entre o final do século XIX e o início do século XX. O maior problema envolvido nessa reação era a baixa conversão em amônia, que inviabilizava a produção em escala industrial. O estudo do equilíbrio químico dessa reação envolveu diversos cientistas, sendo Fritz Haber o nome mais celebrado, por obter as condições reacionais como temperatura, pressão e catalisadores, que permitiram a produção de amônia em grande escala. Considere que, em um sistema fechado, tal processo atingiu o equilíbrio com pressão de 1,0 atm e temperatura de 450 K. Sabendo-se que essa é uma reação exotérmica, analise as afirmativas a seguir.
I É possível formar mais amônia com a pressão de 1,0 atm se a temperatura for menor que 450 K.
II Na temperatura de 450 K e pressão de 1,0 atm, não há formação de amônia, porque o processo está em equilíbrio.
III Com a pressão em 1,0 atm e a temperatura de 450 K, é possível formar mais amônia, utilizando um catalisador.
IV Para formar mais amônia na temperatura de 450 K, é preciso que a pressão seja maior que 1,0 atm.
São corretas APENAS as afirmativas
Aula 6
6ª/7ª semanas 12/03/2018 a 16/03/2018
Situação de Aprendizagem 3 –É POSSÍVEL ALTERAR A RAPIDEZ COM QUE UMA TRANSFORMAÇÃO QUÍMICA OCORRE?
Competência e habilidades.Organizar, relacionar e interpretar dados para chegar a conclusões sobre as variáveis que podem alterar a rapidez que uma transformação química ocorre? Recorrer aos conhecimentos desenvolvidos sobre as variáveis que podem afetar a rapidez do processo de deterioração dos alimentos para a elaboração de propostas de intervenção solidária na sociedade; reconhecer o papel da Química no sistema produtivo, analisando a importância dos estudos relacionados aos catalisadores.– Fatores que alteram a velocidade das reações
Aula 7
6ª/7ª semanas 12/03/2018 a 16/03/2018
Situação de Aprendizagem 4 Como utilizar modelos microscópicos para explicar as diferenças na RAPIDEZ das transformações QUÍMICAS?
Como utilizar modelos microscópicos para explicar as diferenças na rapidez das transformações químicas?
Conteúdos e temas: modelos explicativos para compreender a rapidez das transformações químicas.
Competências e habilidades: aplicar modelos microscópicos para explicar os fatores que podem afetar a
rapidez das transformações químicas; desenvolver conexões hipotético-lógicas utilizando modelos microscópicos
que possibilitem previsões acerca das diferenças na rapidez das transformações químicas.
Sugestão de estratégias de ensino: leitura e discussão de textos.
Sugestão de recursos: texto e questões.
Sugestão de avaliação: questões referentes às atividades desenvolvidas e problemas que exigem a aplicação
dos conceitos aprendidos
É importante frisar que os modelos são representações limitadas e que utilizam recursos como esferas de cores diferentes apenas para diferenciar os átomos. Portanto, não se pode concluir, por exemplo, que o átomo de hidrogênio é azul ou que o átomo de oxigênio é cinza.
Existem quatro principais fatores que alteram a velocidade das reações, veja quais são:Os principais fatores que alteram a velocidade das reações são a superfície de contato, a temperatura, a concentração dos reagentes e o uso de catalisadores.
 O sangue possui uma enzima que atua como catalisadora da decomposição da água oxigenada, ou seja, que aumenta a velocidade dessa reação Existem quatro principais fatores que alteram a velocidade das reações, veja quais são:
O sangue possui uma enzima que atua como catalisadora da decomposição da água oxigenada, ou seja, que aumenta a velocidade dessa reação Existem quatro principais fatores que alteram a velocidade das reações, veja quais são:
1- Superfície de contato: Quanto maior a superfície de contato, maior é a velocidade da reação.
Isso ocorre porque as reações acontecem entre as moléculas que ficam nas superfícies dos reagentes. Elas realizam colisões que, se forem efetivas (com orientação correta e com a quantidade de energia necessária), resultarão na quebra das antigas ligações e formação de novas ligações, ou seja, a reação química ocorrerá. Portanto, quanto maior for a superfície de contato, mais moléculas estarão em contato umas com as outras, maior será a probabilidade de ocorrerem choques efetivos e mais rápida será a reação. Um exemplo que confirma isso é se você colocar para reagir com a mesma quantidade de água um comprimido efervescente inteiro e um triturado. Qual terminará de reagir mais rápido? A resposta é o comprimido triturado, pois a sua superfície de contato é bem maior que a do comprimido compacto.

Reação entre antiácido efervescente e água em duas situações diferentes: no primeiro copo, o antiácido está em pó; no segundo, está em comprimido.
2- Temperatura: Quanto maior a temperatura, maior será a velocidade da reação.
Isso acontece porque, com o aumento da temperatura, a energia cinética das moléculas das substâncias reagentes aumenta, ou seja, elas movimentam-se em uma maior velocidade, o que aumenta a quantidade de choques efetivos que resultam em uma reação mais rápida. Além disso, como a energia das moléculas aumenta, isso propicia que elas tenham a energia suficiente para reagir, que é chamada de energia de ativação.
Por exemplo, quando ocorre um incêndio em uma floresta, que é um meio onde a perda de calor é pequena, a reação libera calor para o meio. Com isso, a temperatura do ambiente aumenta e isso faz com que a reação de combustão ocorra ainda mais rapidamente.

O aumento da temperatura aumenta ainda mais a velocidade dos incêndios florestais.
A panela de pressão também é usada com essa finalidade, pois o aumento da pressão aumenta a temperatura que o líquido entra em ebulição e, consequentemente, mais rápido é o cozimento do alimento. A panela de pressão é um exemplo da influência da temperatura sobre a velocidade da reação Por outro lado, se queremos que uma reação ocorra mais lentamente, podemos diminuir a temperatura. É o caso de colocarmos, por exemplo, carnes no freezer, pois a baixa temperatura faz com que esse alimento decomponha-se mais devagar.
A panela de pressão é um exemplo da influência da temperatura sobre a velocidade da reação Por outro lado, se queremos que uma reação ocorra mais lentamente, podemos diminuir a temperatura. É o caso de colocarmos, por exemplo, carnes no freezer, pois a baixa temperatura faz com que esse alimento decomponha-se mais devagar.
3- Concentração: Quanto maior a concentração dos reagentes, maior é a velocidade da reação.
Quando aumentamos a concentração dos reagentes, aumentamos o número de moléculas ou partículas reagentes por unidade de volume e, consequentemente, o número de colisões entre elas aumenta, resultando em uma maior velocidade da reação.Um exemplo é a combustão do carvão. Se colocarmos um pedaço de carvão em brasa dentro de um frasco com oxigênio puro, a reação ocorrerá com uma velocidade muito maior. Isso porque a concentração de um dos reagentes da combustão (o oxigênio) aumentou. Antes, o oxigênio era o presente no ar, que está em uma proporção de cerca de 20%. Dentro do frasco, porém, essa proporção vai para 100%.
4- Catalisadores: São substâncias que aumentam a velocidade de determinadas reações sem participar delas, ou seja, sem serem consumidas durante a reação.
Por exemplo, a água oxigenada decompõe-se com o tempo, mas quando ela é colocada em contato com o sangue de um machucado, essa reação ocorre com uma velocidade muito maior, o que é visto por meio da formação de bolhas.Isso acontece porque o sangue possui uma enzima denominada catalase que funciona como catalisadora da reação de decomposição da água oxigenada, ou seja, aumenta sua velocidade.Os catalisadores conseguem aumentar a velocidade das reações porque eles atuam mudando o mecanismo da reação por diminuir a energia de ativação da reação. Assim, com uma quantidade de energia de ativação menor, fica mais fácil para as partículas reagentes atingirem essa energia e reagirem.
Existem outros fatores que podem interferir em reações específicas. Alguns exemplos são: luz,eletricidade, pressão (no caso de sistemas gasosos) e natureza dos reagentes (quanto maior o número de ligações dos reagentes que precisam ser rompidas e quanto mais fortes elas forem, mais demorada será a reação).
1. Considerando o que foi estudado em sala de aula sobre os fatores que podem alterar a rapidez das transformações
químicas, responda às questões:
a) Por que alimentos armazenados na geladeira demoram mais para estragar do que fora dela?
b) Qual item vai estragar mais rapidamente à temperatura ambiente: uma peça inteira de 500 g de carne ou 500 g de
carne moída? Justifique sua resposta.
2. (Fuvest – 1993) Para remover uma mancha de um prato de porcelana, fez-se o seguinte: cobriu-se a mancha com meio copo de água fria, adicionaram-se algumas gotas de vinagre e deixou-se por uma noite. No dia seguinte, a mancha havia clareado levemente. Usando apenas água e vinagre, sugira duas alterações no procedimento, de modo que a remoção da mancha possa ocorrer em menor tempo. Justifique cada
uma das alterações propostas.
Você costuma observar as datas de validade quando compra um alimento?
( ) nunca ( ) sempre ( ) às vezes
Por quê? ________________________________
Você consumiria( ) nunca ( ) não olho as datas de validade ( ) às vezes
Por quê? ________________________________
Você costuma observar as condições em que os alimentos estão estocados nos supermercados/feiras quando faz compras (temperatura da geladeira ou do freezer, alimentos cobertos ou descobertos, condições das embalagens)?
( ) nunca ( ) sempre ( ) às vezes
Por quê? ________________________________.
É possível relacionar prazos de validade e condições de armazenamento de alimentos com seus conhecimentos sobre rapidez das reações químicas?
Aula 8
Cinética Química
Teoria das Colisões

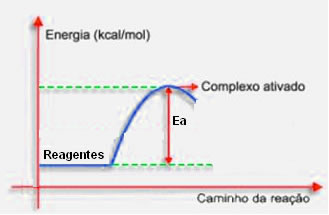
A Teoria das Colisões diz que para que uma reação ocorra, a colisão entre as partículas das substâncias reagentes deve acontecer através de uma orientação adequada e com uma energia maior que a energia mínima necessária para a ocorrência da reação.Essa energia mínima que deve ser fornecida aos reagentes é denominada Energia de Ativação (Ea). Sem atingi-la, a reação não ocorre.Quando colocamos duas substâncias em contato, suas partículas começam a colidir umas com as outras. Nem todas as colisões são eficazes, isto é, nem todas dão origem a novos produtos. No entanto, as colisões que rompem as ligações formadas e formam novas ligações, são denominadas colisões eficazes ou efetivas.
Essas colisões ocorrem de forma adequada: seu choque é frontal geometricamente e bem orientado. Observe abaixo como isso ocorre: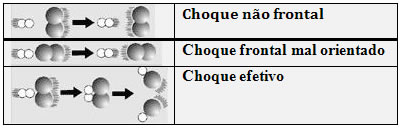
No choque efetivo as moléculas absorvem a quantidade de energia mínima necessária (energia de ativação) para a formação do complexo ativado, ou seja, um estado intermediário (estado de transição) entre os reagentes e os produtos. Nessa estrutura, as ligações dos reagentes estão enfraquecidas e as dos produtos estão sendo formadas.Observe uma reação genérica que mostra essa formação do complexo ativado abaixo:AB + XY → AX + YB
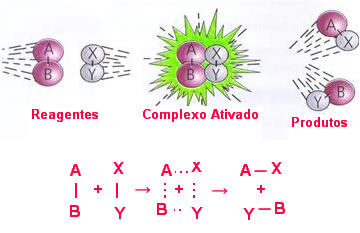
Note que quando ocorre o choque efetivo, forma-se momentaneamente o complexo ativado, no qual as ligações entre os átomos AB e XY estão se rompendo e as ligações que unirão os átomos nas moléculas AX e YB estão se formando.Observe no diagrama que se não for atingida a energia de ativação, não é possível formar o complexo ativado, pois ela serve como uma barreira energética a ser ultrapassada para que a reação química ocorra.
Para reações exotérmicas (reações que liberam energia – ?H < 0) e endotérmicas (reações que absorvem energia – ?
H > 0), temos os diagramas: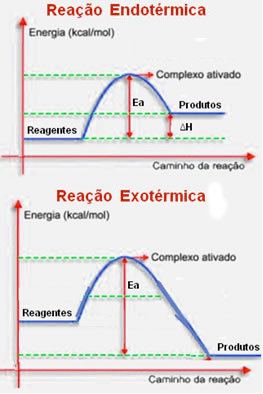 Assim, a teoria das colisões explica satisfatoriamente a rapidez com que ocorrem as reações, pois:
Assim, a teoria das colisões explica satisfatoriamente a rapidez com que ocorrem as reações, pois:
Aula 9
10ª/11ª semana 02/04/2018 a 13/04/2018
Fechamento e avaliação, recuperação do 1° bimestre. Pesquisa Funções Inorgânicas.
Aula 10
Semana 16/04 a 20/04/2018
Situação de Aprendizagem 5 – Composição das águas naturais e usos da água doce?
CONTEÚDOS E TEMAS: Distribuição de água no planeta; características da água doce para diferentes formas de consumo.
COMPETÊNCIA E HABILIDADES: Interpretar dados apresentados em tabelas relativos á disponibilidade de água no planeta, á qualidade e aos usos das águas.
O planeta Terra possui cerca de 71% de sua superfície recoberta por água. Desse total, cerca de 97,5% da água é salgada e apenas 2,5% são de água doce, que é a utilizada para consumo humano. Entretanto, nem toda água doce está disponível para uso, uma vez que grande parte está no estado sólido em geleiras e calotas polares. Do total de 2,5%, apenas 0,77% está disponível, porém nem sempre atende às especificações para ser considerada potável.
Água potável
A água potável é aquela que pode ser consumida pelo homem sem que haja nenhum prejuízo à saúde.
A água potável pode ser definida como a água própria para consumo, ou seja, livre de substâncias e organismos que possam trazer doenças, além de não possuir cor, gosto, ou cheiro. Para que uma água seja considerada potável, devemos, portanto, analisar suas características físicas, químicas, biológicas e até mesmo radioativas.
Muitas pessoas pensam que a água cristalina é potável e que, portanto, não necessita de tratamento. Entretanto, apenas cor e odor não são suficientes para garantir que a água seja própria para o consumo, haja vista que organismos patogênicos microscópicos podem estar presentes e causar sérios danos à saúde. Sendo assim, a água potável não pode ser avaliada apenas visualmente, sendo fundamentais os testes de potabilidade.
Normalmente águas de rios e lagos não são próprias para consumo humano, sendo fundamental que passem por processos específicos em estações de tratamento de água. Após o tratamento, é importante que sejam realizados testes para confirmar se a água tratada corresponde ao padrão de potabilidade exigido pelo Ministério da Saúde. Caso esteja de acordo, a água poderá ser enviada para a população.
Dentre os padrões exigidos pelo Ministério da Saúde, destacam-se a análise dos coliformes fecais, monitoramento de Escherichia coli, análise da turbidez e das substâncias químicas presentes, incluindo-se as cianotoxinas e verificação de ph, gosto, odor e radioatividade.
A Organização Mundial de Saúde estima que cerca de 748 milhões de pessoas não possuam acesso de forma sustentada à água potável no mundo e aproximadamente 1,8 bilhão de pessoas utilizem água contaminada. Isso significa que uma grande parcela da população está sujeita a contrair doenças que podem, inclusive, levá-las à morte.
A falta de água potável no Brasil e no mundo apresenta diversas causas, destacando-se a poluição e a falta de planejamento na distribuição desse recurso. Sendo assim, é importante que políticas sejam criadas urgentemente para garantir a conservação dos corpos hídricos, a despoluição de rios e que a distribuição ocorra de maneira adequada. Também é fundamental o investimento constante em saneamento, pois este garante um destino adequado ao esgoto e que água de qualidade chegue à população.
É importante destacar que a água potável é um bem valioso que merece atenção não só por parte dos governantes. Cada pessoa, ao desperdiçar água em sua casa ou poluir um rio, por exemplo, está contribuindo para que a quantidade de água potável seja reduzida.
Fazer a nossa parte é garantir qualidade de vida para a nossa geração e para as gerações futuras.
Água contaminada
A água contaminada pode ser definida como uma água poluída que provoca danos à saúde.

A água poluída pode causar doenças, sendo, nesse caso, chamada de água contaminada
É comum ouvirmos pessoas dizerem que a água de determinado local pode trazer doenças em virtude da quantidade de poluição nela presente. Entretanto, uma água poluída é aquela que apresenta alterações na cor, no sabor e no cheiro, todavia, nem sempre ela provoca doenças.
Denominamos de água contaminada aquela que é capaz de colocar em risco a saúde da população graças à presença de agentes patogênicos, tais como bactérias e protozoários, e substâncias tóxicas, como metais pesados. Essa água, diferentemente da potável, não deve ser utilizada para consumo humano e nem mesmo para fins recreativos.
A contaminação da água pode ocorrer de várias maneiras, destacando-se a poluição por esgoto, metais pesados, agrotóxicos e fertilizantes. Todos esses tipos de contaminação ocorrem principalmente como consequência do descarte inadequado dessas substâncias e por acidentes que poderiam ser evitados se fossem seguidas as regras básicas de segurança.
Dentre as principais doenças desencadeadas pela água contaminada, destaca-se a diarreia. Todos os anos, milhões de pessoas, principalmente crianças, morrem em consequência dessa doença provocada pelo consumo de água imprópria para consumo. O maior número de mortes encontra-se entre pessoas de baixa renda, em virtude, muitas vezes, de saneamento básico precário. Além da diarreia, outras doenças que podem ser transmitidas pela água contaminada são a giardíase, leptospirose, cólera e febre tifoide.
Além dos problemas causados por organismos patogênicos, a água contaminada por substâncias químicas, como metais pesados e agrotóxicos, pode desencadear sérios danos à saúde. Esses contaminantes provocam envenenamento, desencadeiam danos ao sistema nervoso, fígado e rins e podem provocar até mesmo câncer.O grande número de mortes como resultado de água contaminada poderia ser evitado com projetos eficientes de saneamento básico.
É importante que ocorra uma maior fiscalização no que diz respeito ao descarte de substâncias químicas, uso de fertilizantes e tratamento de esgoto antes de seu lançamento nos rios. Também é essencial que a água seja tratada e testada antes de seu envio para a população.
Ao criar políticas que evitem a contaminação de água, estamos ajudando no abastecimento da cidade, pois mais água de qualidade estará disponível para a população. Além disso, contribuímos para manter a cidade limpa, prevenimos e controlamos doenças e promovemos melhores hábitos de higiene.
Classificação da água
Dentre as formas de classificação da água, destaca-se a que considera o grau de salinidade, sendo reconhecidos três tipos distintos: água doce, salgada e salobra.

A água própria para o consumo é doce e potável
Ao pensarmos em água, é comum nos lembrarmos apenas daquela usada no nosso dia a dia. Entretanto, a água apresenta características que permitem classificá-la em diferentes tipos.
Uma das principais classificações é baseada na salinidade da água, ou seja, na quantidade de sal dissolvida. Segundo essa classificação, possuímos três tipos de água: doce, salobra e salgada.
A água salgada é aquela que apresenta alta concentração de sal, principalmente cloreto de sódio, e salinidade igual ou superior a 30%. Ela é o principal tipo de água encontrado no planeta, representando cerca de 97,5% do total.
A água salobra é aquela que não apresenta uma quantidade de sal elevada como a água salgada, mas não possui a mesma quantidade de sal da água doce. Essa água, que possui salinidade entre 0,5% e 30,5%, poderia ser considerada um meio-termo entre a água salgada e a doce. Esse tipo é encontrado principalmente em mangues.
Por fim, temos a água doce, que possui salinidade inferior ou igual a 0,5%. Apesar do termo fazer alusão ao açúcar, na realidade, ele refere-se apenas a uma presença pequena de sal. É o tipo de água que usamos para beber e realizar nossas atividades diárias, como lavar roupas e tomar banho.A água doce pode ainda receber outras classificações, destacando-se a de água potável. Essa água não possui cor, cheiro e nenhuma substância ou organismo que pode trazer risco à saúde humana. É a água própria para consumo humano.
Existem ainda as águas chamadas de minerais, que, como o próprio nome indica, apresentam uma quantidade superior de sais minerais dissolvidos. Essas águas apresentam um sabor diferente das outras e possuem propriedades terapêuticas.
Geralmente elas são classificadas de acordo com sua composição química.Quando uma água, seja ela doce, salgada ou salobra, apresenta produtos que alteram as suas características físicas e químicas, dizemos que ela está poluída. Quando, além dessas alterações, ela apresenta organismos patogênicos ou substâncias tóxicas que provocam doenças no homem, dizemos que a água está contaminada.
Além das águas encontradas naturalmente, alguns tipos são produzidos em laboratório para que haja a pureza necessária para a realização de alguns estudos, produção de medicamentos e limpeza de alguns materiais, por exemplo. Esse é o caso da água destilada, que sofre o processo de destilação para a retirada de todas as substâncias e sais minerais nela presentes.
A água deionizada também é um tipo produzido em laboratório, entretanto, diferentemente da água destilada, ela não pode ser considerada pura. Ela caracteriza-se por não possuir apenas substâncias iônicas, não sendo livre de substâncias moleculares. Os processos para chegar à água deionizada são a troca iônica ou a osmose reversa.
A água nossa de cada dia
A água nos parece ser simples demais. Nada mais falso! Com mais de 70 comportamentos fora de série, é um material com inúmeras aplicações.

A água é um líquido estranho. Quando olhamos um copo de água gelada, não percebemos os grandes mistérios que este material guarda. Em um mundo altamente tecnológico, ficamos maravilhados com o silício, que possui a propriedade extraordinária de aumentar a sua condutividade ao ser dopado por pequenas quantidades de outro material. Esta propriedade interessante possibilitou a criação dos chips de computador mais de cem anos depois de ter sido observada pela primeira vez. Por outro lado, a água nos parece ser simples demais. Nada mais falso!
Notem: o silício tem somente uma propriedade diferente do que a maioria dos materiais apresenta, por ser um semicondutor, e já é um sucesso; a água tem mais de 70 comportamentos fora de série, e é, portanto, um material com inúmeras aplicações. Ilustremos um destes comportamentos.
Se você pegar um cubo de gelo e colocar na água líquida, ele flutua, porque gelo é menos denso do que água. Isto é anormal, pois a fase sólida dos demais materiais é mais densa que sua fase líquida. Uma barra de metal, por exemplo, afunda no metal líquido. Ainda mais espetacular do que gelo flutuar em água, é água a 0º C flutuar em água a 4º C. Assim, no inverno, em locais que alcançam temperaturas negativas, os rios e lagos congelam somente na superfície, permitindo que peixes e plantas sobrevivam no fundo, que está a uma temperatura de 4º C. Isto, inclusive, permitiu que algumas plantas, insetos e pequenos animais tenham sobrevivido a uma das últimas eras glaciais, quando a Terra ficou coberta de gelo.
Outra propriedade fundamental para a vida é o calor específico, Cp, que é quanto calor tem que ser dado para um material aumentar em 1º C a sua temperatura. No caso da água, o Cp tem um valor alto, o que significa que é necessário dar muito calor para a água aumentar em 1º C a sua temperatura. Observamos isso quando vamos a uma piscina para nadar. A água durante um dia quente estará mais fria do que o concreto do piso que contorna a piscina, pois, para aumentar a temperatura da água em 1º C, é necessário fornecer mais calor do que para aumentar a temperatura do concreto. Esta propriedade extraordinária permite que os oceanos não tenham uma variabilidade de temperatura muito elevada, o que igualmente ajuda na manutenção da vida. Mas há coisas bem quotidianas nas quais podemos usar esta propriedade. Se queremos esfriar uma panela de pressão bem quente rapidamente, a colocamos em contato com a água, ao invés de a deixarmos em contato com o ar, pois a capacidade de absorver calor da água é maior do que a do ar. A indústria usa esta anomalia da água – absorver mais calor do que outros materiais – para controle de temperatura.
Além disso, água é um solvente fantástico. Água dissolve bem o sal do nosso sangue e da nossa comida, e o açúcar do nosso café. A água, no entanto, tem seus desafetos. Água detesta compostos apolares (moléculas que, diferentemente da água, são mais democráticas na sua distribuição de elétrons, e não têm acúmulo de cargas em uma dada direção), particularmente óleos. Para resolver este conflito entre água e óleo, é possível usar moléculas surfactantes, como o detergente de cozinha, que une estes dois grandes inimigos. Este jogo de amor e ódio que certos materiais têm com a água tem sua utilidade. Cobrimos o sofá da sala com um polímero que odeia água para que o mesmo não molhe e usamos materiais que amam água para absorver água do ar como, por exemplo, o sal de cozinha – se o deixamos exposto em um dia úmido, ele transforma o vapor de água em água. Isto ocorre porque o sal é polar (tem uma distribuição de carga). Em regiões áridas, se usam polímeros com grupos com cargas para fabricar redes que capturam água do ar .
Mas o que faz com que a água seja assim tão especial? A molécula de H2O em seu formato simples guarda um segredo. O oxigênio, com seus oito elétrons, para se equilibrar eletronicamente precisa de mais dois elétrons, enquanto cada hidrogênio, com somente um elétron, precisa de um elétron a mais para se equilibrar. Para resolver este problema, a natureza criou uma solução socialista, através da negociação perfeita chamada de ligação covalente. O oxigênio empresta um elétron para cada hidrogênio e cada hidrogênio empresta o seu único elétron para o oxigênio. Em média, cada hidrogênio fica com dois elétrons e cada oxigênio com dez elétrons. A ligação covalente, no entanto, não é igualitária. O oxigênio por ter mais prótons, puxa todos os elétrons para a sua vizinhança. Os hidrogênios ficam com os elétrons, mas estes não ficam próximos ao H e sim ao O, ficando a molécula polarizada. Surge assim a “ligação de hidrogênio”.
Enquanto a ligação covalente é entre átomos, a de hidrogênio é entre moléculas, sendo esta última bem mais fraca do que a primeira. Se a ligação covalente é um casamento entre o oxigênio e o hidrogênio, a ligação de hidrogênio é um flerte fortuito entre o hidrogênio de uma molécula e o oxigênio da molécula vizinha. Devido ao formato em V das ligações covalentes, como ilustra a figura 1.
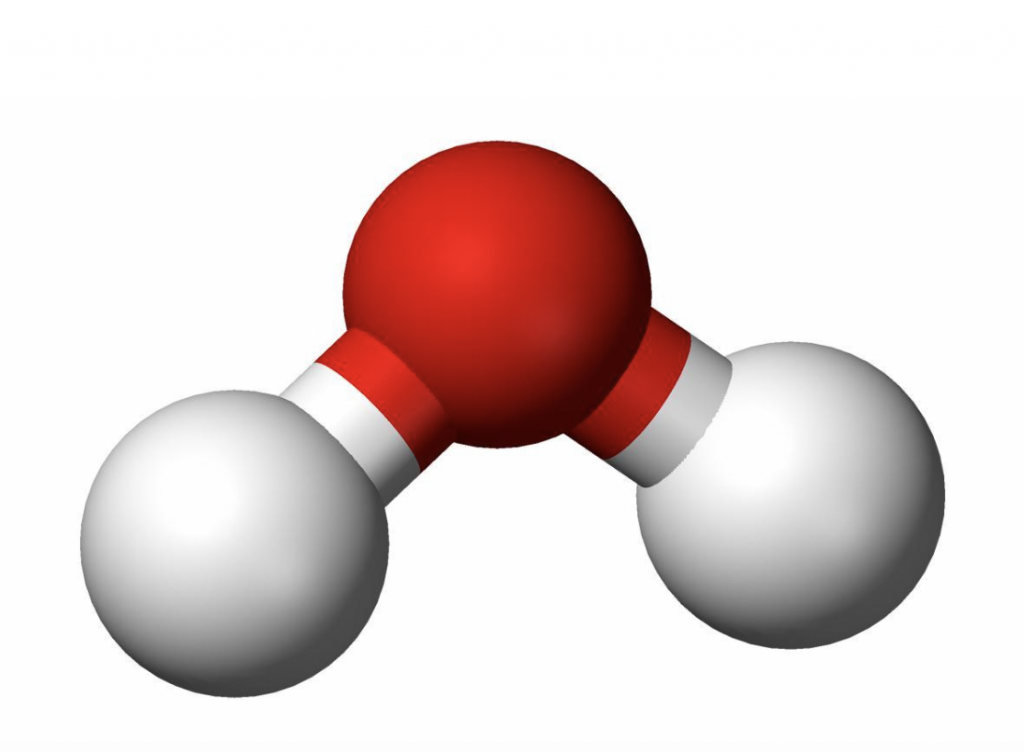
Figura 1 – O oxigênio é representado pela esfera vermelha, e os hidrogênios pelas brancas. (Imagem: Creative Commons)
cada molécula de água pode formar até quatro ligações de hidrogênio. Imagine você estar no centro de um cubo, com os dois braços apontando para dois vértices em diagonais opostas da face superior do cubo e os dois pés apontando para dois vértices em diagonais opostas na face inferior do cubo, alternadas em relação às superiores, como ilustra a figura 2.
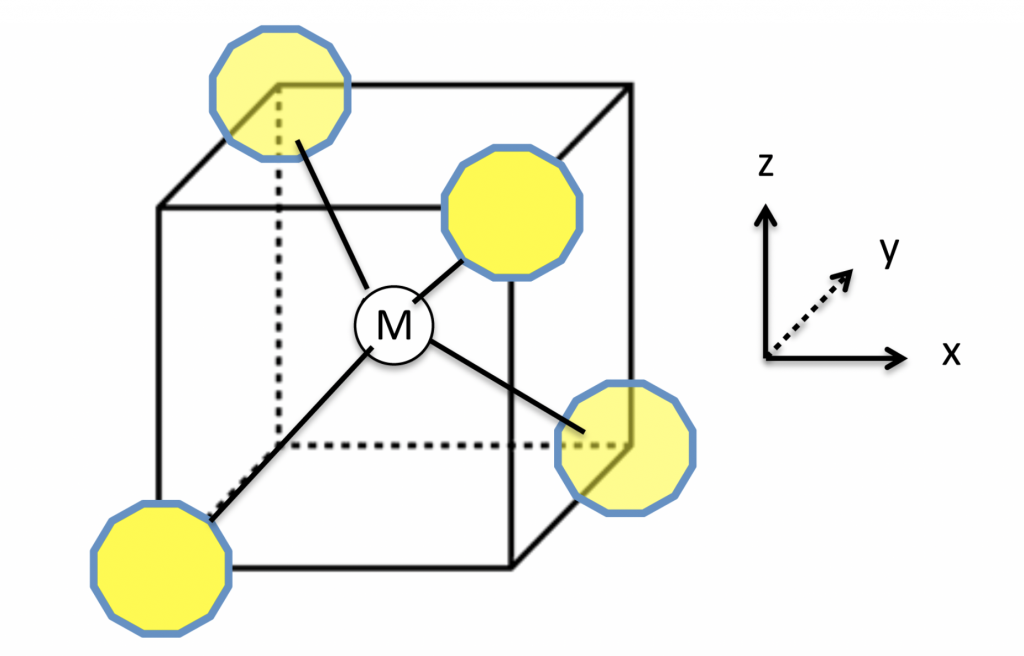
Figura 2 – M representa uma molécula central de água que se liga com outras quatro (em amarelo) através de ligações de hidrogênio com direções e distâncias específicas. (Imagem: Creative Commons)
As quatro ligações de hidrogênio são exatamente assim. Note que elas têm uma distância e ângulo bem precisos. Assim, a baixas temperaturas, o gelo forma todas as ligações possíveis, mas ao aumentar a temperatura algumas ligações são rompidas, o que permite que as moléculas se aproximem, aumentando a densidade e, por isso, o gelo é menos denso que a água a 4º C. A presença das ligações também explica o calor específico elevado, pois é necessário dar calor para romper a ligação e, somente depois de rompida, aumentar a temperatura. Materiais que têm cargas livres, como o sal de cozinha, ou que formam ligações de hidrogênio com a água, como os álcoois, amam a água e se dissolvem bem na água; materiais sem cargas, como os polímeros que usamos para cobrir o sofá da nossa casa, odeiam água e não se solubilizam em água e, por isso, são ótimos para impedir que algo se molhe.
Além de propriedades termodinâmicas, a água se move de maneira peculiar. Na grande maioria dos materiais, a mobilidade das moléculas aumenta com a diminuição da densidade do sistema, pois o espaço para se mover aumenta. Se queremos fazer o óleo fluir mais, aumentamos a temperatura para diminuir a densidade.
Na água, no entanto, a baixas temperaturas a mobilidade aumenta com o aumento da densidade. As moléculas de água a altas densidades têm ligações de hidrogênio muito promíscuas que se formam e se desfazem rapidamente, permitindo à água se mover de uma molécula vizinha à outra. A água se comporta como um bando de foliões no carnaval, onde a densidade de pessoas é enorme: as pessoas se movem rapidamente, largando o braço de um companheiro de bloco e passando ao braço de outro. Uma consequência interessante desta alta mobilidade é que se colocarmos a água confinada em tubos muito fininhos (10.000 vezes mais finos do que um fio de cabelo), a água flui através do tubo a uma velocidade que pode ser até 1.000 vezes maior do que se espera para a maioria dos materiais. O que ocorre é que a água confinada em volumes pequenos se move usando a rede de ligações de hidrogênio. Para um tubo bem fininho, as moléculas formam uma linha compacta, que se move como se fosse um tubo dentro de outro tubo como mostra a figura 3. Este fenômeno tem uma aplicação muito importante.
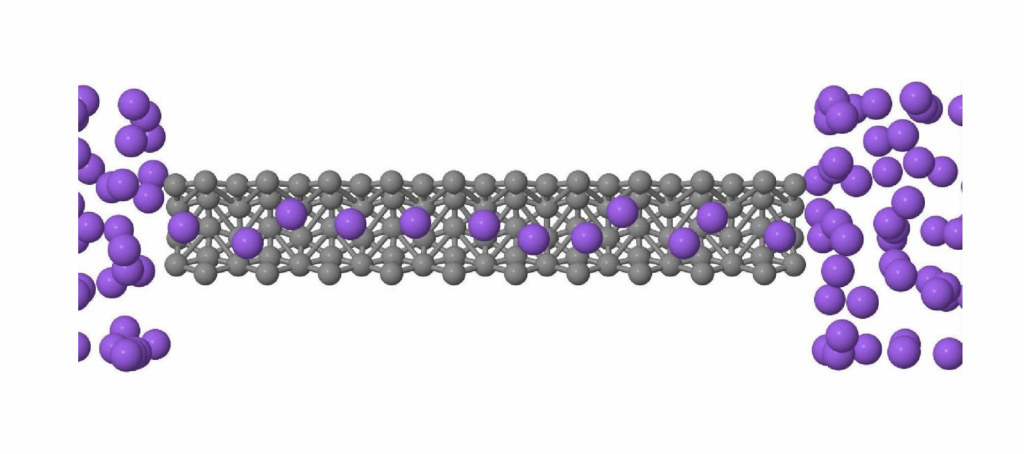
Figura 3 – Nanotubo em cinza e água em roxo. As moléculas fazem uma fila no superfluxo. (Imagem da autora)
Qual a utilidade deste superfluxo? Hoje uma em cada seis pessoas no mundo vive em regiões onde há stress hídrico, ou seja, vivem em regiões que não têm água suficiente para produzir a sua subsistência, e este número em 2030 irá chegar a 50% da população. No Brasil, temos regiões que não têm água suficiente para a sobrevivência, e o crescimento não planejado da agricultura adicionado ao uso indiscriminado de agrotóxicos tem levado a situações de falta de água em regiões como São Paulo. Este quadro, com o crescimento da população, mudança do clima e contaminação da água potável, irá se agravar mundialmente nos próximos anos.
Uma solução que se usa para isso é a dessalinização de água do mar ou salobra. Hoje na Califórnia, em algumas ilhas do Caribe, em diversos países do Oriente Médio e na ilha de Fernando de Noronha, a dessalinização é uma realidade. Uma alternativa é o processo de osmose reversa, usado na Califórnia, que consiste em empurrar a água através de um filtro que permite a passagem de água, mas não a de sal. Este processo é caro e ineficiente, pois as plantas de dessalinização são instalações enormes e se justificam somente para abastecer grandes cidades, pois o processo não tem um equivalente em pequena escala. O defeito deste processo é que não usa nenhuma das propriedades mágicas da água.
Com a descoberta recente do superfluxo da água confinada, alguns pesquisadores têm proposto o uso de nano estruturas para separar a água do sal. A água atravessa os nanotubos de carbono com um superfluxo e o sal, devido à barreira dielétrica da membrana nanométrica, fica fora da membrana. Para que o processo ocorra, os poros devem ter 2 nanômetros de diâmetro, o que por si só é um desafio para a produção em série. A boa nova é que testes laboratoriais realizados na Universidade da Califórnia e testes computacionais realizados por diversos grupos, inclusive o do Instituto de Física da Universidade Federal do Rio Grande do Sul que coordeno, mostraram que este processo seria em ordens de grandeza mais eficiente do que aquele usado atualmente, tornando as plantas de dessalinização mais eficientes, exigindo um consumo menor de energia e filtros menores, ou seja, factíveis para pequenas cidades ou mesmo para bairros. Esperamos que com o desenvolvimento de tecnologias de larga escala para a produção de nanotubos, grafeno ou do MoS2 em quantidade suficiente para construir membranas como a ilustrada na figura 4, em dez anos esta tecnologia esteja implementada no mundo ou, quem sabe se voltarmos a ter um financiamento regular e ininterrupto em ciência e tecnologia, mesmo no Brasil.
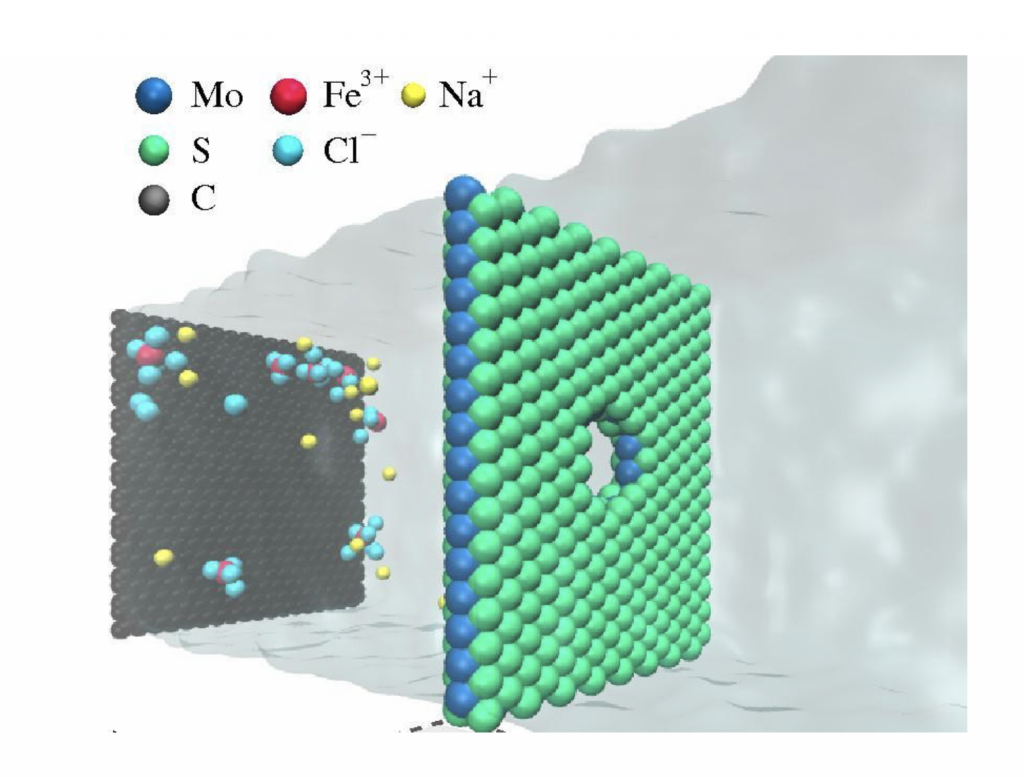
Figura 4 – Sal e água (região sombreada) passando através de uma membrana nanométrica de Dissulfeto de Molibdênio. (Imagem da autora)
Questões
1. A água usada para os diversos fins mencionados precisa ter a mesma qualidade?
2. A água é um elemento de fundamental importância para a vida de todas as espécies da natureza. Quais as principais contribuições da água para o ser humano?
resposta. A água é um elemento essencial para a manutenção da vida: cerca de 80% do nosso organismo é composto por água; ela é responsável pelo transporte de nutrientes em nosso organismo; é um regulador de temperatura corporal; auxilia na eliminação de substâncias tóxicas durante o metabolismo; participa de todas as reações químicas no organismo humano; ela participa de todos os processos fisiológicos de digestão, absorção assimilação e de excreção; auxilia na prevenção de doenças (cálculo renal, infecção urinária, etc.), ou seja, a água é vida.
3. Você acha que, em nossas residências, usamos a água de maneira responsável? Dê exemplos de situações em que a água é usada responsavelmente e de situações em que há desperdício.
4. Você acha que seria possível reutilizar uma parte da água que consumimos em nossas residências? Para que fins? Teria de ser tratada?
5. A recomendação do Ministério da Saúde é de que o pH da água distribuída deve estar na faixa de 6,0 a 9,5. Você já ouviu falar de pH? O que esses valores indicam?
6. Levando em conta essas informações sobre a disponibilidade de água doce na Terra, sobre o consumo e a quantidade de água restituída sem qualidade ao ambiente, você diria que a água é um bem escasso no planeta?
Justifique.
7. (Enem) Segundo uma organização mundial de estudos ambientais, em 2025, duas de cada três pessoas viverão situações de carência de água, caso não haja mudanças no padrão atual de consumo do produto.
Uma alternativa adequada e viável para prevenir a escassez, considerando-se a disponibilidade global, seria:
a) desenvolver processos de reutilização da água.
b) explorar leitos de água subterrânea.
c) ampliar a oferta de água, captando-a em outros rios.
d) captar águas pluviais.
e) importar água doce de outros estados.
8. (Enem) Segundo uma organização mundial de estudos ambientais, em 2025, duas de cada três pessoas viverão situações de carência de água, caso não haja mudanças no padrão atual de consumo do produto.
Uma alternativa adequada e viável para prevenir a escassez, considerando-se a disponibilidade global, seria:
a) desenvolver processos de reutilização da água.
b) explorar leitos de água subterrânea.
c) ampliar a oferta de água, captando-a em outros rios.
d) captar águas pluviais.
e) importar água doce de outros estados.
9 (Enem) Considerando a riqueza dos recursos hídricos brasileiros, uma grave crise de água em nosso país poderia ser motivada por:
a) reduzida área de solos agricultáveis.
b) ausência de reservas de águas subterrâneas.
c) escassez de rios e de grandes bacias hidrográficas.
d) falta de tecnologia para retirar o sal da água do mar.
e) degradação dos mananciais e desperdício no consumo.
10. Enem) A falta de água doce no planeta será, possivelmente, um dos mais graves problemas deste século. Prevê-se que, nos próximos vinte anos, a quantidade de água doce disponível para cada habitante será drasticamente reduzida.
Por meio de seus diferentes usos e consumos, as atividades humanas interferem no ciclo da água, alterando:
a) a quantidade total, mas não a qualidade da água disponível no planeta.
b) a qualidade da água e sua quantidade disponível para o consumo das populações.
c) a qualidade da água disponível, apenas no subsolo terrestre.
d) apenas a disponibilidade de água superficial existente nos rios e lagos.
e) o regime de chuvas, mas não a quantidade de água disponível no Planeta.
Aula 11
Semana
Tema 3 – A hidrosfera e o equilíbrio iônico da água e o pH
Em uma solução aquosa, a água sofre uma autoionização formando sempre dois íons (H3O+ e OH–).
2 H2O ↔ H3O+ e OH–
Segundo a teoria de Arrhenius, os ácidos são compostos que reagem com água e sofrem ionização, originando como único cátion o hidrônio (H3O+(aq)).
Já as bases são compostos que, em meio aquoso, sofrem dissociação iônica, liberando como único ânion a hidroxila (OH–(aq)).
Assim, para ser ácida, uma solução deve ter uma concentração maior de cátions H3O+do que de OH– livres em seu meio, e o contrário ocorre com as soluções básicas.
Ácidas: [H3O+] > [OH–]
Básicas: [H3O+] < [OH–]
No caso da água, a quantidade desses íons no meio é igual ([H3O+] = [OH–]), por isso, ela é neutra.Isso nos ajuda a entender melhor a escala de pH, que costuma ser usada entre os valores de 0 a 14, em temperatura de 25ºC.
A temperatura precisa ser especificada porque ela altera a quantidade de íons no meio. Se aumentarmos a temperatura, por exemplo, a energia das partículas também aumentará. Por isso, elas se movimentarão mais rápido, o que resultará em um maior número de choques entre elas e, portanto, em uma maior quantidade de íons produzidos.
Mas existem várias substâncias diferentes no cotidiano, além de soluções químicas usadas em laboratórios e indústrias que apresentam diferentes níveis de acidez e basicidade. Só para citar um exemplo, o café é ácido, mas quase todos sabem que o ácido sulfúrico é um ácido bem mais forte que o café.
Assim, para medir o grau de acidez e de basicidade das soluções, foram criadas as escalas de pH e pOH, respectivamente.
A sigla pH significa potencial (ou potência) hidrogeniônico e indica o teor de íons hidrônio (H3O+(aq)) livres por unidade de volume da solução. Quanto mais hidrônios houver no meio, mais ácida será a solução. Por consequência, podemos dizer que quanto mais íons OH–(aq) houver no meio, mais básica ou alcalina será a solução.
Entendendo a Escala de pH Importância do controle da acidez de soluções (pH)Saúde humana:
O pH do sangue humano precisa estar em seu limite ideal de 7,4 para absorver os minerais necessários à saúde daquele indivíduo. Qualquer alimento sólido, ou líquido, que prejudique o equilíbrio do pH ideal estará comprometendo a saúde.
Assim, o pH do sangue humano está inteiramente relacionado à saúde. Uma pequena variação do pH dá oportunidade a uma redução do seu sistema imunológico, dando oportunidade para que seres vivos prejudiciais à nossa saúde, como vírus, bactérias, fungos, que vivem em meios ácidos, com pH abaixo de 7,0 proliferem e encontrem ambiente propício para sobreviver.
A maior parte das pessoas acometidas de câncer apresentam um pH no tecido de 4,5. Em resumo, estando o pH do nosso sangue abaixo da normalidade 7,4 estamos propensos a todos os tipos de doenças: Câncer, artrite, diabetes, doenças do coração, fadiga crônica, alergias, além de doenças causadas por vírus, bactérias e fungos.Uma maneira de manter o seu pH é evitar alimentos com pH baixo, como café (em torno de 4,0), refrigerante (em torno de 2,0), cerveja (varia de 2,5 a 4,2 dependendo da marca).Açúcar é um grande rebaixador de pH. Uma água mineral de boa qualidade pode suprir todas essas carências, no entanto precisa ter as seguintes qualidades: ter pH entre 7,0 e 7,5, e ser rica em minerais.
Solo
O solo vem sofrendo várias agressões e por isso fica desequilibrado, doente. Um desequilíbrio frequentemente encontrado é a acidez do solo, responsável por grandes prejuízos para o agricultor e em consequência, ao homem que está no final da cadeia alimentar.A acidez do solo, ou o pH baixo do solo faz com que a planta deixe de absorver determinados minerais e por isso, aparecem doenças nas plantas.
Numa piscina o controle de pH inibe o aparecimento de micro-organismos que podem causar micoses e outras doenças.Num laboratório o controle de pH é usado para controle de titulações e outras dosagens.
Medir ou alterar um pH é uma tarefa elementar para indústrias, na indústria de alimentos é usado para que os produtos tenham maior durabilidade.Numa estação de tratamento de água, há controle de pH para que a água servida à população esteja dentro dos padrões desejados.
Conceito de pH e pOH
Para medir os níveis de acidez e alcalinidade das soluções, utilizam-se as escalas de pH e pOH, que medem os teores dos íons H+ e OH- livres por unidade de volume da solução.

Medição de pH de solução em laboratório com o uso de uma tira de indicador universal
Veja a escala de pH a seguir e algumas soluções do cotidiano com o seu pH aproximado:
.jpg) Escala de pH com exemplos de soluções com pH próximo ao indicado.
Escala de pH com exemplos de soluções com pH próximo ao indicado.
Quanto menor o valor do pH, mais ácida é a solução, pois a escala de pH é definida como o logaritmo negativo da concentração de íons H3O+, ou H+, na base 10. Veja como ele pode ser determinado a seguir:
colog [H+] = – log [H+]
pH = – log [H+]
[H+] = 10-pH, em mol/L
Se temos uma solução de concentração igual a 0,01 mol . L1-, por exemplo, isso quer dizer que seu pH é igual a 2. Veja:0,01 mol . L1-= 10-2 mol . L1-
10-2 mol de H3O1+ ———- 1000 mL
pH = – log [H3O1+]
pH = – log [10-2]
pH = – (-2)
pH = 2
Os cálculos acima também nos levam à conclusão de que, a cada unidade de pH diminuída, a solução fica com 10 vezes menos íons H3O+. Se temos uma solução com pH igual a 2 e outra com pH igual a 3, por exemplo, a primeira possui dez vezes mais íons hidrônio do que a segunda.
Agora vamos falar sobre o pOH ou potencial hidroxiliônico.
Essa escala refere-se à concentração dos íons OH– na solução. Analogamente ao cálculo que mostramos para o pH, temos para o pOH:
pOH = – log [OH–]
[OH–] = 10-pOH, em mol/L
Voltando à autoionização da água, temos que a água destilada (totalmente pura) possui pH igual a 7, por isso, é neutra. Dessa forma, o seu pOH também é igual a 7, pois, conforme dito, a concentração desses dois íons na água é igual. À temperatura ambiente de 25ºC, o Kw (produto iônico da água) é igual a 1,0 . 10-14 (mol/L)2. Sendo assim, chegamos à seguinte conclusão para a água:
Kw = [H+] . [OH–] = 1,0 . 10-14 mol/L
[H+] = [OH–] = 1,0 . 10-7 mol/L
pH = – log [H+] pOH = – log [OH–]
pH = – log 1,0 . 10-7 pOH = – log 1,0 . 10-7
pH = 7 pOH = 7
Visto que, como mostrado acima, [H+] . [OH–] = 1,0 . 10-14 mol/L, então,em todos os casos, sejam as soluções ácidas, básicas ou neutras, a soma do pH com o pOH sempre resulta em um total de 14.
Veja como isso é verdadeiro quando aplicamos o fator (-log) nos dois lados da equação:
– log ([H+] . [OH–]) = – log 1,0 . 10-14
– log [H+] – log[OH–] = 14
pH + pOH = 14
Se temos uma solução ácida, por exemplo, com pH igual a 4, sabemos que o seu pOH é igual a 10. Os valores de 0 a 14 da escala de pH podem ser medidos precisamente por meio de um equipamento chamado pHmetro (também chamado de peagômetro)
 PHmetro usado em laboratório para medir o pH de uma solução básica.
PHmetro usado em laboratório para medir o pH de uma solução básica.
Porém, em muitos casos, são utilizados também indicadores ácido-base, ou seja, substâncias que mudam de cor de acordo com o pH da solução. Um indicador ácido-base sintético, por exemplo, é a fenolftaleína, que apresenta cor rosa quando está em contato com um meio básico, mas fica incolor se o meio é ácido.Outros dois indicadores são o papel de tornassol, que fica vermelho na presença de ácidos e azul na presença de bases, e o indicador universal, que apresenta cores diferentes para cada valor de pH.
.jpg)
EXERCÍCIOS
- A chuva apresenta normalmente pH=5,6. Isso indica que ela é ligeiramente ácida, o que é explicado pela presença de ácido carbônico, resultante da reação entre o dióxido de carbono do ar e da água. Em grandes centros urbanos, contudo, a presença de poluentes promove o aparecimento de ácidos fortes na chuva, como o sulfúrico e o nítrico, originando o fenômeno da chuva ácida. Um técnico analisou duas amostras de chuva ácida.A amostra A apresentou pH=3,6 e a amostra B, pH=2,6.
- a) Qual das amostras é mais ácida?
- b) Quantas vezes a [H+] da amostra A é maior que na chuva “normal”?
02 . A análise de uma determinada marca de água mineral gaseificada revelou que apresenta pH=4.
Qual o valor da concentração hidrogeniônica, [H+], e da concentração hidroxiliônica, [OH-], nesse produto?
03 . Os efluentes de uma certa indústria apresentavam pH=3,7, sendo muito ácidos para serem despejados no rio. Após tratamento adequado, esses efluentes passaram a pH=6,7. O tratamento provocou que alteração numérica em [H+]?.04 . Considere amostras dos seguintes materiais:
- Água totalmente pura.
- Solução de ácido de bateria de automóvel.
- Leite de magnésia.
Coloque esses materiais em ordem crescente de:a) Acidez.b) Alcalinidade (basicidade).c) pH.d) pOH.05 . Qual meio é mais alcalino (básico): um detergente de pH=9,5 ou um limpador com amoníaco de pH=12?
Aula 12
Semana
Situação de aprendizagem 7 Como saber as quantidades de produtos e de reagentes que coexistem em equilíbrio QUÍMICO?
EQUILÍBRIO QUÍMICO
O equilíbrio químico é atingido quando, na mistura reacional, as velocidades das reações direta (reagentes formando produtos) e inversa (produtos formando regenerando os reagentes) ficam iguais.
Mas, em primeiro lugar, é importante entender que reação química é um processo onde reagentes se combinam e formam novas substâncias com propriedades diferentes. Algumas reações se processam totalmente, enquanto outras parecem parar antes de estarem completas. Isso tem a ver com a reversibilidade da reação. Em uma reação reversível os reagentes formam os produtos, mas os produtos reagem entre si e regeneram os reagentes.
Por exemplo, a produção da amônia ocorrendo em recipiente fechado, sob pressão e temperatura constantes:
N2 + 3H2 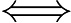 2NH3
2NH3
O processo é dinâmico, ou seja, a reação ocorre nos dois sentidos. Consideremos a reação hipotética entre a mols de A e b mols de B, formando c mols de C e d mols de D:
aA + bB 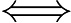 cC + dD
cC + dD
Inicialmente, observando uma determinada quantidade de A e B e concentrações de C e D nulas. No decorrer da reação, as concentrações de A e B diminuem e de C e D aumentam. A velocidade da reação inversa, que é nula a princípio, cresce continuamente com o tempo. A velocidade da reação direta diminui e da inversa aumenta, até que atinjam a igualdade. Nesse momento as substâncias A e B se formam na mesma velocidade em que são consumidas. As concentrações de reagentes e produtos não mais se alteram. Este é o instante no qual a mistura reacional atingiu o equilíbrio.
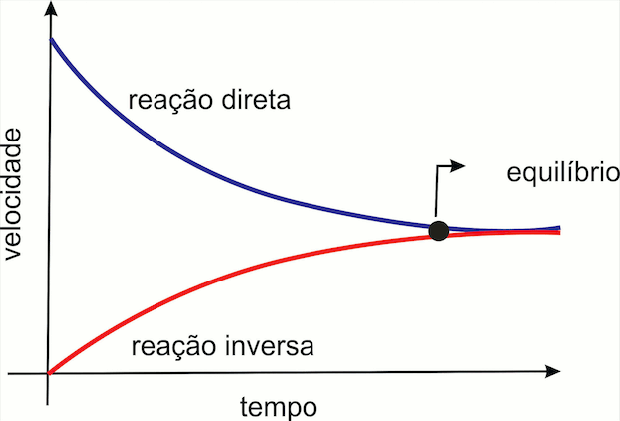
No estado de equilíbrio, mesmo com o sistema aparentando estar parado, as reações diretas e inversas continuam a ocorrer, com velocidades iguais. Por isso as concentrações das substâncias permanecem constantes. Por exemplo, na reação de produção de amônia:
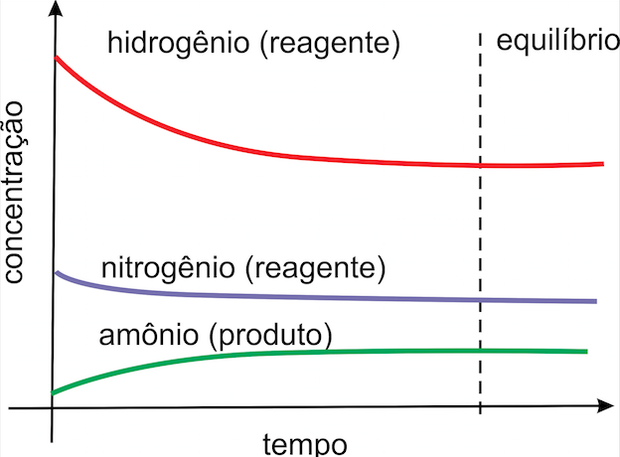
CONSTANTES DE EQUILÍBRIO
Cálculo da constante de equilíbrio Kc
QUÍMICA
O cálculo da constante de equilíbrio Kc é realizado a partir da quantidade de reagentes que restou em equilíbrio e da quantidade de produtos formados.
As reações reversíveis geralmente iniciam com uma quantidade determinada de reagentes. Como a reação direta se inicia, com o passar do tempo, esses reagentes vão sendo consumidos para a formação dos produtos, consequentemente a concentração dos reagentes diminui enquanto a concentração dos produtos aumenta. Então, a reação inversa também começa, produzindo também os reagentes, até que a taxa de desenvolvimento (velocidade) das reações direta e inversa permanece a mesma, atingindo o chamado equilíbrio químico.
No equilíbrio, há a constante de equilíbrio Kc, que é expressa basicamente por:
| Kc = [produtos]coeficiente na equação química balanceada [reagentes]coeficiente na equação química balanceada |
Ou seja, considerando a seguinte reação genérica em equilíbrio:
a A + b B ↔ c C + d D
Tendo que as letras minúsculas são os coeficientes, e as letras maiúsculas são as substâncias, a constante de equilíbrio dessa reação será:
Kc = [C]c . [D]d
[A]a . [B]b
Mais detalhes sobre isso podem ser vistos no texto Constantes de equilíbrio Kc e Kp. Esse texto mostra-nos também algo importante: que os valores de Kc podem nos mostrar se a concentração dos reagentes e a dos produtos são iguais ou se uma é maior que a outra e, como consequência, se o equilíbrio químico está deslocado para algum sentido da reação.
Então, precisamos determinar o valor de Kc. Para tal, lembre-se de que esses cálculos são experimentais e, por isso, vamos analisar alguns exemplos de reações e os dados obtidos nelas.
Algo que serve muito de ajuda para realizar esses cálculos é escrever uma tabela semelhante à mostrada abaixo e seguir os passos mencionados nela:
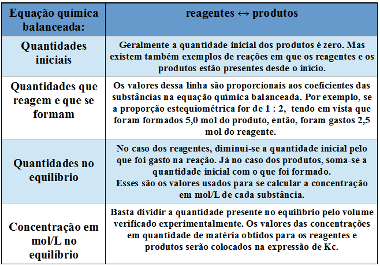
Tabela para organizar os dados usados no cálculo da constante de equilíbrio
Agora, vamos para a prática:
Exemplo 1:
Em um recipiente fechado, com capacidade de 2 L, em temperatura de 100ºC, há 20 mol de N2O4. Começa a ocorrer a seguinte reação reversível:
N2O4 ↔ NO2.
Após certo tempo, verificou-se que a reação atingiu o equilíbrio químico e que 8 mol de NO2 haviam se formado. Qual é o valor da constante de equilíbrio Kc em temperatura de 100ºC?
Vamos usar a tabela:
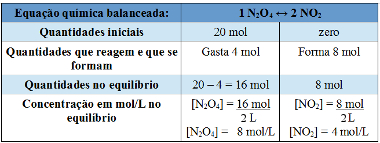
Tabela usada para resolver exemplo de cálculo da constante de equilíbrio
Observe que na linha em que foram escritas as quantidades que reagem e que se formam, sabemos que foram gastos 4 mol de N2O4, porque a proporção é de 1 : 2, e que foram formados 8 mol de NO2.
Agora basta substituir os valores encontrados na expressão da constante de equilíbrio Kc dessa reação:
Kc = [NO2]2
[N2O4]
Kc = (4 mol/L) 2
(8 mol/L)
Kc = 2 mol/L
O valor de Kc é adimensional, não possui unidade relacionada à alguma grandeza.
Agora, vejamos um exemplo, que contém também produtos desde o início:
Exemplo 2:
Em um recipiente fechado, com capacidade de 5 L, em temperatura T, há 2 mol de gás hidrogênio, 3 mol de gás iodo e 4 mol de iodeto de hidrogênio . A reação entra em equilíbrio químico, em temperatura T, e verifica-se que há 1 mol de gás hidrogênio no recipiente. Qual é o gráfico que representa esse equilíbrio e qual o valor da constante de equilíbrio Kc em temperatura de T?
Resolução:
Usando tabela:
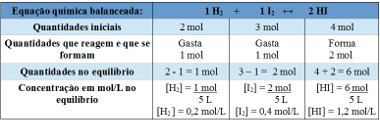
Tabela usada para determinação da constante de equilíbrio
O gráfico que mostra as variações das concentrações em mol/L dos reagentes e dos produtos até atingirem o equilíbrio pode ser dado por:
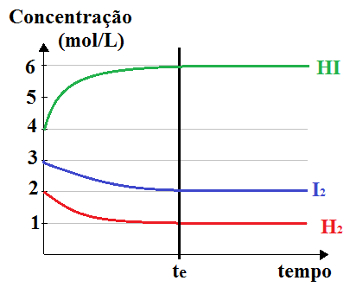
Gráfico do equilíbrio químico que mostra as variações das concentrações dos reagentes e dos produtos
Agora descobrimos o valor da constante de equilíbrio:
Kc =__[HI]2__
[H2 ] . [I2]
Kc = (1,2)2
0,2 . 0,4
Kc = 18
(UFPB) Se 1 mol de H2(g) e 1 mol de I2(g), em um recipiente de 1 litro, atingirem a condição de equilíbrio a 500 ºC, a concentração de HI no equilíbrio será:
Dado: Kc = 49.
a) 2,31.
b) 5,42.
c) 1,56.
d) 3,29.
e) 4,32.
(PUC-RS) Um equilíbrio envolvido na formação da chuva ácida está representado pela equação:
2SO2(g) + O2(g) ↔ 2SO3(g)
Em um recipiente de 1 litro, foram misturados 6 mols de dióxido de enxofre e 5 mols de oxigênio. Depois de algum tempo, o sistema atingiu o equilíbrio; o número de mols de trióxido de enxofre medido foi 4. O valor aproximado da constante de equilíbrio é:
a) 0,53
b) 0,66
c) 0,75
d) 1,33
e) 2,33
EXERCÍCIO
(PUC-RJ 2008) Reações químicas dependem de energia e colisões eficazes que ocorrem entre as moléculas dos reagentes. Em sistema fechado, é de se esperar que o mesmo ocorra entre as moléculas dos produtos em menor ou maior grau até que se atinja o chamado “equilíbrio químico”.
O valor da constante de equilíbrio em função das concentrações das espécies no equilíbrio, em quantidade de matéria, é um dado importante para se avaliar a extensão (rendimento) da reação quando as concentrações não se alteram mais.
Considere a tabela com as quantidades de reagentes e produtos no início e no equilíbrio, na temperatura de 100°C, para a seguinte reação:
 Tabela com quantidade de reagentes e produto (Foto: Reprodução)
Tabela com quantidade de reagentes e produto (Foto: Reprodução)A constante de equilíbrio tem o seguinte valor:
a) 0,13
b) 0,27
c) 0,50
d) 1,8
e) 3,0
Gabarito
Letra B. A constante de equilíbrio em função das concentrações (K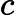 ) não depende das concentrações iniciais, logo:
) não depende das concentrações iniciais, logo:
K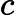 =
= 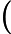
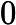
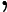
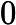
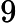
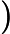
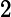
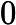
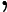
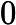
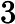
K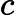 = 0,27
= 0,27
Aula 13
Semana
DISCIPLINA: QUÍMICA – 3° SÉRIE CRONOGRAMA DE ATIVIDADES DO 2° SEMESTRE
SITUAÇÃO DE APRENDIZAGEM 1º – A BIOSFERA COMO FONTE DE MATERIAIS ÚTEIS AO SER HUMANO
Conteúdos e temas: materiais extraídos de recursos animais ou vegetais e de animais e vegetais fossilizados. Competências e habilidades: reconhecer e valorizar a biosfera como fonte de materiais úteis para o ser humano; conhecer alguns usos cotidianos e algumas aplicações industriais desses materiais.
Sugestão de estratégias de ensino: discussão em grupos desencadeada por associação de palavras.
Sugestão de recursos: artigos de jornais ou revistas.
Sugestão de avaliação: participação e envolvimento nas atividades desenvolvidas.
A biosfera compreende a hidrosfera, litosfera e atmosfera, ou seja, todos os elementos que existem na natureza.
Desta forma, existem diversos recursos que são extraídos pelo homem para o desenvolvimento de suas atividades, como a extração de alimentos pela atividade agrícola, extração de combustíveis fósseis, os quais podem ser utilizados para movimentar a industria alimentícia e automobilística, respectivamente.
Biosfera
- Litosfera: camada superficial sólida da Terra;
- Hidrosfera: representa o ambiente líquido;
- Atmosfera: camada gasosa que circula a Terra e que envolve as outras duas regiões.
A Biosfera começou a surgir juntamente com os primeiros seres vivos da Terra, que desde então, começaram a evoluir e se diversificar, passando a ocupar todos os diversos ambientes do planeta. E para satisfazer as necessidades de todos esses seres vivos, é necessário que existam fatores abióticos (fatores não vivos, mas que influenciam a vida dos seres vivos, como luz, água, temperatura, pressão e salinidade, dentre outros) e escassez de fatores maléficos para a vida (radiações prejudiciais, substâncias tóxicas e grandes variações de temperatura), e que ambos estejam em níveis adequados para poder sustentar e satisfazer as condições de vida dos seres vivos.
Como pode ser observado, a Biosfera não é uma estrutura simples. Ela é extremamente complexa e delicada, pois a composição da mesma é decorrente dos vários fenômenos físicos e químicos correlacionados às atividades biológicas dos seres vivos, que realizam atividades como alimentação e respiração, consumindo e produzindo gases que transformam a composição do ar, por exemplo, além de outros produtos metabólicos.
Há também diversas outras formas de interação dos seres vivos com a Biosfera. Por exemplo, eles remodelam a estrutura do solo, seja naturalmente, como uma minhoca furando túneis, ou artificialmente, como um homem desmatando uma floresta. Estas ações modificam a biosfera constantemente, o que pode ser benéfico ou maléfico. E o homem está transformando o ambiente em que vive extremante rápido, não dando tempo do ambiente se recuperar e isso modifica em grande parte a Biosfera de forma prejudicial.
É necessário ter conhecimento da biosfera para se compreender como acontece a dinâmica da evolução do clima e da sustentabilidade do ecossistema como um todo e com isso serem desenvolvidas políticas para minimizar os impactos prejudiciais ao meio ambiente. Com base nesta premissa foi criada pela Unesco – Organização das Nações Unidas para a Educação, a Ciência e a Cultura – em 1972, a Reserva da Biosfera, que é uma área destinada para conciliar a conservação ambiental e o avanço sustentável do ser humano, melhorando a convivência entre homem e natureza, sempre visando a proteção e o uso sustentável dos recursos do meio ambiente. É uma área expressiva do ecossistema da região, seja ele marinho ou terrestre, funcionando como zonas de controle e área de estudo do meio ambiente.
| Região UNESCO | Número de Reservas da Biosfera | Número de Países |
| África | 52 | 22 |
| Estados Árabes | 26 | 13 |
| Ásia e Pacífico | 130 | 23 |
| Europa e América do Norte | 289 | 34 |
| América Latina e Caribe | 117 | 21 |
Existem 7 Reservas da Biosfera no Brasil:
- Os remanescentes da Mata Atlântica (1992);
- Cinturão Verde de São Paulo (1993);
- Pantanal (2000);
- Cerrado (2001);
- Caatinga (2001);
- Amazônia Central (2001);
- Serra do Espinhaço (2005).
Referencias Bibliográficas:
O que é uma Reserva da Biosfera. Dicionário Ambiental. ((o))eco, Rio de Janeiro, jun. 2014. Disponível em: <http://www.oeco.org.br/dicionario-ambiental/28448-o-que-e-uma-reserva-da-biosfera/>.
STRONG, D. R. Harmonious coexistence of hispine beetles on Heliconia in experimental and natural communities. Ecology, 63:1039-1049. 1982.
TOWNSEND, C. R.; BEGON, M.; HARPER, J. L. Fundamentos em ecologia. Porto Alegre: Artmed, 2006.
Exercícios – Biosfera
Aula 14
Semana
Situação de Aprendizagem 2 – SITUAÇÃO DE APRENDIZAGEM 2 COMPOSIÇÃO, PROCESSAMENTO E USOS DO PETRÓLEO, DO GÁS NATURAL E DO CARVÃO
Conteúdos e temas: processos de obtenção e purificação do petróleo, do gás natural e do carvão mineral e seus derivados; utilização e importância econômica desses materiais; estrutura e nomenclatura de hidrocarbonetos; isomeria em cadeias abertas e fechadas.
Competências e habilidades: interpretar e analisar textos referentes à descoberta e à exploração de jazida de petróleo e gás natural; compreender os processos de transformação do petróleo, do carvão mineral e do gás natural em materiais e substâncias utilizados no sistema produtivo – refino do petróleo, destilação seca do carvão mineral e purificação do gás natural; estabelecer relações entre a temperatura de ebulição, a estrutura e a nomenclatura de hidrocarbonetos por meio de dados apresentados em tabelas; construir estruturas de hidrocarbonetos com base na fórmula molecular para compreender o conceito de isomeria; analisar fluxograma dos produtos obtidos do carvão mineral e reconhecer suas diversas aplicações.
Sugestão de estratégias de ensino: leitura e interpretação de textos, aulas expositivo-dialogadas e pesquisas. Sugestão de recursos: textos, artigos e livros.
Sugestão de avaliação: participação, consistência das informações pesquisadas e respostas aos questionários.
Combustíveis Fósseis
Os combustíveis fósseis incluem o petróleo e seus derivados, o carvão mineral e o gás natural, todos formados pela decomposição de organismos vivos.

Refinaria de petróleo onde são obtidos os derivados deste que é o combustível fóssil mais usado atualmente
Atualmente a maior parte da demanda mundial de energia (cerca de 75%) é suprida por meio da utilização de combustíveis fósseis, que são aqueles originados da decomposição de organismos animais e vegetais durante milhares de anos em camadas profundas do solo ou do fundo do mar. Os principais combustíveis fósseis são o petróleo, o gás natural e o carvão.
O uso dos combustíveis fósseis começou principalmente em meados do século XVIII com o advento da Revolução Industrial. O primeiro combustível fóssil que se tornou a fonte de energia mundial mais importante foi o carvão mineral, também chamado de carvão natural. Nessa época, o calor gerado na sua queima era utilizado na produção de vapor que movimentava máquinas, locomotivas e navios.
O carvão mineral é formado pela fossilização da madeira, que vai perdendo água, dióxido de carbono e metano com o passar do tempo, o que produz uma mistura de substâncias complexas ricas em carbono.
No entanto, havia vários inconvenientes, como a dificuldade no transporte, as cinzas que ficavam como resíduos e, principalmente, o fato de ser altamente poluente porque possui muitas impurezas, entre eles o enxofre. Assim, ao ser queimado, além dos produtos normais oriundos da combustão que falaremos mais adiante e que já geram poluição, o carvão mineral libera também grande quantidade de óxidos de enxofre que reagem com a água da chuva e formam a chuva ácida.
Hoje o carvão corresponde a 6% da oferta de energia primária no Brasil.

O carvão mineral é um combustível fóssil
O petróleo é, na atualidade, o combustível fóssil de maior aplicação comercial, pois, nas refinarias, ele passa por um processo em que são obtidos os seus derivados, tais como a gasolina — que detém entre todos a maior importância econômica —, o óleo diesel, o querosene e o GLP (Gás Liquefeito de Petróleo). Para saber mais sobre eles, leia o texto Refino do petróleo.
Além disso, esses derivados também são usados como matéria-prima na produção de plásticos e borrachas tão usados em nossa sociedade.
O petróleo e seus derivados correspondem a 37% da oferta de energia primária no Brasil.
.jpg)
Extração de petróleo
Um dos derivados do petróleo é o gás natural, outro combustível fóssil que também pode ser encontrado em jazidas, geralmente em associação ao petróleo. Ele é formado basicamente de metano (CH4) e é usado, por exemplo, na geração de calor e de energia em indústrias e em automóveis, sendo menos poluente que o óleo combustível. Seu uso vem crescendo muito e corresponde a cerca de 9% da oferta de energia primária no Brasil.
A sua desvantagem, porém, é seu transporte e estocagem, pois, como ele é um gás, são necessários cilindros e vasos industriais para estocar, além de grandes gasodutos para o transporte que trazem impactos ao meio ambiente.

Os gasodutos podem trazer impactos sobre o meio ambiente
Todos os combustíveis fósseis são formados por compostos orgânicos que, quando queimados, liberam gás carbônico e água, se a combustão é completa. Isso é um grande problema, pois, desde o século XIX, a concentração de gás carbônico na atmosfera vem aumentando cada vez mais, o que tem intensificado o problema do efeito estufa.
Além disso, a combustão incompleta dos combustíveis fósseis libera o monóxido de carbono, um gás extremamente venenoso que não pode ser lançado na atmosfera.
Assim como foi dito no caso do carvão, os derivados do petróleo também possuem impurezas que são liberadas em sua queima e poluem a atmosfera.
Além da poluição ambiental que causam, os combustíveis fósseis não são renováveis, ou seja, um dia vão esgotar-se. Por isso, há a necessidade e a busca urgentes por alternativas que sejam fontes de energia mais limpas e renováveis, como os biocombustíveis.
Ainda assim, o século XXI ainda terá uma grande participação dos combustíveis fósseis no total da energia consumida no mundo.
15ª semana
SITUAÇÃO DE APRENDIZAGEM 3 COMPOSIÇÃO, PROCESSAMENTO E USOS DA BIOMASSA
Conteúdos e temas: processos de transformação, usos sociais da biomassa e questões ambientais.
Competências e habilidades: reconhecer a biomassa (e exemplos de materiais a ela pertencentes) como recurso alternativo ao uso de combustíveis fósseis; valorizar conhecimentos químicos como instrumentos para a busca de alternativas energéticas; avaliar a biomassa como fonte de energia alternativa; aplicar conceitos de nomenclatura orgânica para melhor entender as informações relativas à biomassa; desenvolver atitudes como saber ouvir, dialogar e argumentar.
Sugestão de estratégias de ensino: aulas expositivo-dialogadas; levantamento de ideias que os alunos já possuem sobre biomassa; pesquisa orientada por perguntas; discussão de informações pesquisadas em roda de conversa. Sugestão de recursos: livros, material de outras séries, jornais, revistas e internet.
Sugestão de avaliação: apresentação do material de pesquisa solicitado; apresentação dos resultados das pesquisas; síntese das informações pesquisadas; participação.
Biomassa
A biomassa é um material constituído principalmente de substâncias de origem orgânica, ou seja, de animais e vegetais.

Atualmente, o petróleo é a principal substância empregada na geração de energia, porém, a biomassa é uma fonte utilizada bem antes da descoberta do “ouro negro”. O homem utiliza a lenha como fonte energética desde o início da civilização. Portanto, a biomassa faz parte da história da humanidade como fonte de energia.
A biomassa é um material constituído principalmente de substâncias de origem orgânica, ou seja, de animais e vegetais. A energia é obtida através da combustão da lenha, bagaço de cana-de-açúcar, resíduos florestais, resíduos agrícolas, casca de arroz, excrementos de animais, entre outras matérias orgânicas.
Essa fonte energética é renovável, pois a sua decomposição libera CO2 na atmosfera, que, durante seu ciclo, é transformado em hidratos de carbono, através da fotossíntese realizada pelas plantas. Nesse sentido, a utilização da biomassa, desde que controlada, não agride o meio ambiente, visto que a composição da atmosfera não é alterada de forma significativa.
Entre as principais vantagens da biomassa estão:
– Baixo custo de operação;
– Facilidade de armazenamento e transporte;
– Proporciona o reaproveitamento dos resíduos;
– Alta eficiência energética;
– É uma fonte energética renovável e limpa;
– Emite menos gases poluentes.
Porém, o seu uso sem o devido planejamento pode ocasionar a formação de grandes áreas desmatadas pelo corte incontrolado de árvores, perda dos nutrientes do solo, erosões e emissão excessiva de gases.
A utilização da energia da biomassa é de fundamental importância no desenvolvimento de novas alternativas energéticas. Sua matéria-prima já é empregada na fabricação de vários biocombustíveis, como, por exemplo, o bio-óleo, BTL, biodiesel, biogás, etc.
SITUAÇÃO DE APRENDIZAGEM 4 A BIOSFERA COMO FONTE DE ALIMENTOS PARA O SER HUMANO
Conteúdos e temas: componentes nutricionais dos alimentos; propriedades e funções orgânicas encontradas em carboidratos, lipídios e proteínas; nutrição e saúde.
Competências e habilidades: reconhecer as funções orgânicas presentes nos diferentes grupos de alimentos; reconhecer polímeros, assim como os monômeros que os compõem.
Sugestão de estratégias de ensino: retomada da análise de rótulos de alimentos realizada em Biologia, focalizando os valores energéticos de cada componente e sua relação com as respectivas estruturas; discussões relacionadas às funções de cada grupo de alimentos na manutenção da vida.
Sugestão de recursos: questões; observação de estruturas; livro didático. Sugestão de avaliação: participação em aula; realização das atividades; respostas aos exercícios.
Todos os alimentos que consumimos tem relação com a biosfera: as carnes das mais variadas são provenientes dos diferentes animais inseridos em nossa biosfera, assim como as plantas e vegetais também tem essa mesma origem.
Estudo do Carbono
Química Orgânica
 A Química Orgânica ajuda-nos a entender as estruturas e as propriedades das moléculas formadas por cadeias carbônicas
A Química Orgânica ajuda-nos a entender as estruturas e as propriedades das moléculas formadas por cadeias carbônicasA Química Orgânica recebeu inicialmente esse nome para descrever substâncias extraídas de organismos vivos. Acreditava-se que elas só podiam ser produzidas em organismos vegetais e animais, mas nunca em laboratório.
Entretanto, provou-se que o homem conseguia sim sintetizar compostos orgânicos em laboratório, e então a definição de Química Orgânica mudou para:
“Ramo da Química que estuda a maioria dos compostos formados pelo elemento carbono”.
O carbono é o elemento básico para o estudo da química orgânica, tema que costuma ser muito cobrado no Enem. Localizado no grupo 14 (família IVA), o carbono possui seis elétrons, sendo quatro destes localizados em sua camada de valência. Desta forma, o carbono, tetravalente, realiza quatro ligações covalentes para adquirir sua estabilidade química. Pode-se ligar com outros átomos de carbono, encadeando-se, para formar tipos inúmeros de cadeias. O átomo de carbono se liga a hidrogênio e, a outros elementos comuns em compostos orgânicos como o oxigênio (O), nitrogênio (N), enxofre (S), halogênios (Cl, Br, F, I), etc.
Tais compostos são agrupados em diferentes funções que apresentam propriedades químicas semelhantes, tais como os hidrocarbonetos, os álcoois, as cetonas, os aldeídos, os ácidos carboxílicos, os ésteres, os éteres, as aminas, as amidas, entre outros.
Veja nesta subseção como identificar cada uma dessas funções, onde elas estão presentes em nossa sociedade, a realizar a nomenclatura dos compostos orgânicos segundo as regras estabelecidas pela IUPAC, como ocorre o fenômeno da isomeria em muitas dessas substâncias e o que são os polímeros naturais e artificiais que formam os plásticos tão comuns em nosso cotidiano.
Classificação do Carbono
A classificação do carbono é baseada na quantidade dos demais átomos de carbono ligado a ele e também no tipo de ligação.
O carbono pode ser classificado seguindo vários critérios: um deles se baseia na quantidade dos demais átomos de carbono a ele ligados.
Carbono primário: ligado diretamente, no máximo, a 1 outro carbono;
Carbono secundário: ligado diretamente a 2 outros carbonos
Carbono terciário: ligado diretamente a 3 outros carbonos;
Carbono quaternário: ligado diretamente a 4 outros carbonos.
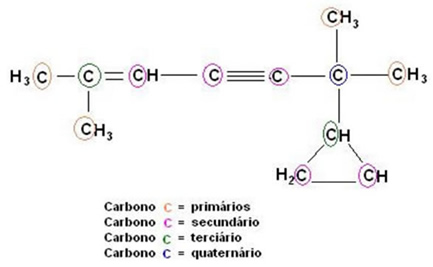
A outra classificação se refere aos tipos de ligação que unem os carbonos.
O carbono pode ser classificado em função das ligações que apresenta:
a) Carbono Saturado: apresenta somente ligações simples, chamadas de sigma (σ).
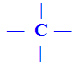
b) Carbono Insaturado: presença de duplas ligações, denominadas de pi (π). Ou ainda, carbono que apresenta ligação tripla.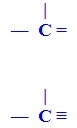
Composição: o C é o principal elemento, incluem também o H, N, O, S, P e ainda os halogênios.
Características: em geral os compostos orgânicos são covalentes apolares. A presença de um elemento diferente do C e H promove certa polaridade na molécula.
H H
Ex.: H – C – H H – C – OH
H H
Apolar Polar
CARACTERÍSTICAS GERAIS
Ponto de fusão e ebulição: inferiores aos compostos inorgânicos, a maioria apresenta instabilidade térmica.
Isomeria: compostos com a mesma fórmula molecular.
Solubilidade: os apolares pouco solúveis em água, os polares solúveis, a exemplo do álcool e açúcar.
Combustibilidade: em geral são combustíveis.
Encadeamento: em função da tetravalência do C tendem a formar estruturas denominadas cadeias carbônicas.
Velocidade de reação: pouco reativos, dependem de ativadores (luz, calor, pressão, catalisadores, etc.).
Postulados de Couper – Kekulé
Tais postulados foram propostos no século XIX e são resultantes do trabalho de diversos cientistas, em especial, do químico Archibald Scott Couper e, claro, do próprio Kekulé. Assim, é comum também denomina-los Postulados de Couper-Kekulé.
Postulados do Carbono
Por que é importante estudar a fundo o Carbono? Este elemento é a unidade fundamental dos compostos orgânicos, tudo se explica por suas propriedades únicas.
O comportamento químico do carbono começou a ser explicado através dos estudos de dois cientistas do século XIX, Archibald Scott Couper (1831-1892) e Friedrich August Kekulé (1829-1896). Estes estudiosos deram nome aos postulados de “Couper-Kekulé”, vamos conhecer agora as propriedades do carbono detalhadas por este conceito:
1° postulado: O átomo de carbono é tetravalente
A tetravalência do carbono é sua propriedade de formar quatro ligações covalentes, ou seja, ele disponibiliza quatro elétrons ligantes. Isso porque em sua camada de valência o átomo de carbono possui 4 elétrons livres.
Metano: molécula formada pela ligação de 4 átomos de Hidrogênio (H) a 1 átomo de carbono (C).
2° postulado: As quatro unidades de valência do carbono são iguais entre si.
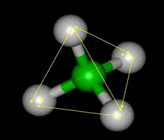
O Fluorometano é um exemplo desta propriedade, só existe um composto com este nome, ele é formado pela substituição de um hidrogênio da molécula de Metano por um átomo de Flúor (F). O Flúor poderá substituir qualquer H da molécula que receberá a mesma nomenclatura, repare na ilustração abaixo:
Qualquer posição ocupada pelo átomo de Flúor dará origem ao Fluorometano.
3° postulado: Propriedade de encadeamento – capacidade que átomos de um mesmo elemento têm de formar cadeias moleculares.
.jpg)
Átomos de carbono ligam-se diretamente entre si, formando estruturas denominadas cadeias carbônicas. A variedade de compostos orgânicos existentes na natureza se deve a esta propriedade do Carbono de formar cadeias. O composto acima (decano) é formado por 10 átomos de C interligados.
O carbono não é o único elemento químico que pode formar encadeamentos: alguns outros elementos como o enxofre e o nitrogênio, por exemplo, também apresentam essa característica. No entanto, somente o carbono pode constituir cadeias tão diversificadas, extensas e quimicamente estáveis.
A tetravalência do carbono, sua capacidade de se ligar com vários tipos de elementos químicos e de formar cadeias carbônicas são as propriedades responsáveis pelo enorme número de compostos orgânicos já conhecidos. Por isso, a Química Orgânica é definida como a área da Química que trata dos compostos de carbono com características específicas.
Classificação das cadeias carbônicas
As cadeias carbônicas podem se classificam através de vários fatores:
1- Cadeia aberta e fechada
Cadeia aberta ou acíclica
Nessa cadeia, os átomos de carbono não formam ciclo.
Cadeia fechada ou cíclica
Nessa cadeia, os átomos de carbono formam ciclo ou anéis.
II) Classificação das cadeias acíclicas ou abertas
A) Quanto à disposição dos átomos
Cadeia acíclica normal ou reta:
A única que apresenta átomos de carbono primário e secundário, com duas extremidades.
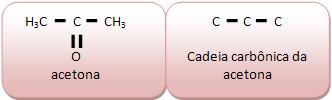
Cadeia acíclica ramificada:
Apresenta pelo menos um átomo de carbono terciário ou quaternário, com mais de duas extremidades.
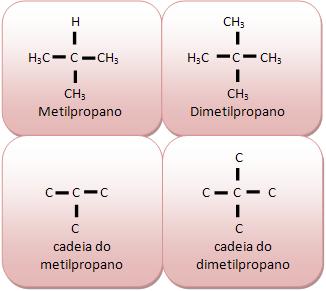
| A cadeia do composto ao lado apresenta átomos de carbono primário e secundário com três extremidades considerada ramificada.
|
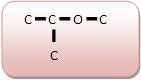
B) Quanto à natureza dos átomos
Cadeia homogênea:
Não apresenta átomos diferentes de caborno intercalados na cadeia, como as cadeias carbônicas de metilpropano e dimetilpropano, acetona e glicerol.
Cadeias heterogênea:
Apresenta átomos diferentes de carbono intercalados na cadeia. Os átomos diferentes recebem o nome de heteroátomos.
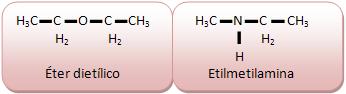
O oxigênio e o nitrogênio são considerados heteroátomos das referidas cadeias carbônicas. Somente os átomos com valência maior que 1 podem ser heteroátomos.
C) Quanto ao tipo de ligação entre os átomos de carbono
Cadeia saturada:
Os átomos de carbono ligam-se entre si, por ligações, como todas as cadeias carbônicas dos compostos mencionados até o momento.
Cadeia insaturada ou não-saturada
Apresenta uma dupla ou tripla ligação entre átomos de carbono.
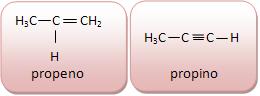
A cadeia carbônica do ácido acético é homogênea, pois entre os átomos de carbono não existe nenhum heteroátomo e na saturada entre os dois átomos de carbono existe apenas uma ligação simples. Vejamos:
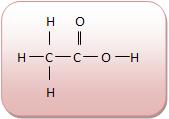
III) Classificação das cadeias cíclicas ou fechadas
A) Quanto à natureza dos átomos
Cadeia homocíclica ou cíclica homogênea: em seu anel existem apenas átomos de carbono.
Cadeia heterocíclica ou heterogênia: em seu anel existem átomos diferentes de carbono. Vejamos:
B) Classificação das cadeias homocíclicas
O benzeno (C6H6) é um líquido incolor, que tem odor agradável, mas com vapores átoxicos, imiscíveis com água. Normalmente é usado como solvente, na fabricação de corantes, plásticos, medicamentos, explosivos. Encontrado no alcatrão de hulha, uma das frações provinientes da destilação seca da hulha, carvão mineral contendo aproximadamente 80% de carbono.
A molécula do benzeno (C6H6) é composta por seis átomos de carbono, que são ligados alternadamente, por simples e duplas ligações.
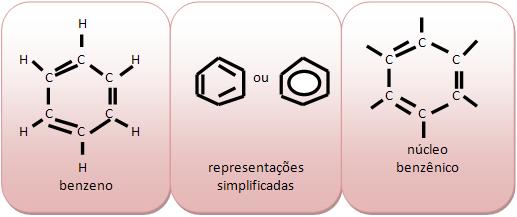
As cadeias homocíclicas são classificadas como cadeias alicíclicas.
As Cadeias alicíclicas não contêm núcleo benzênico. Vejamos:
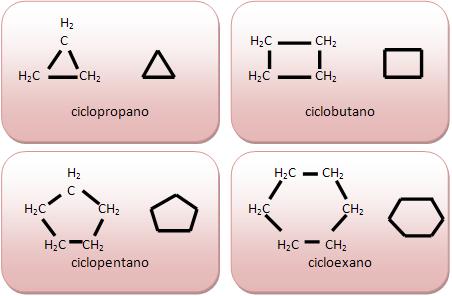
Cadeias aromáticas contêm núcleo benzênico, classificados em cadeia aromática, o fenol comum (C6H5OH) é considerado um sólido, pouco solúvel em água, empregado como desinfetante, na fabricação de corantes, plásticos.
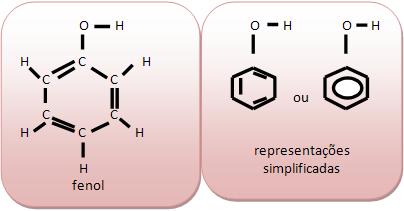
A cadeia aromática pode ser composta por mais de um núcleo benzênico.
Cadeia aromática de núcleos isolados seus anéis não possuem átomos de carbono em comum.
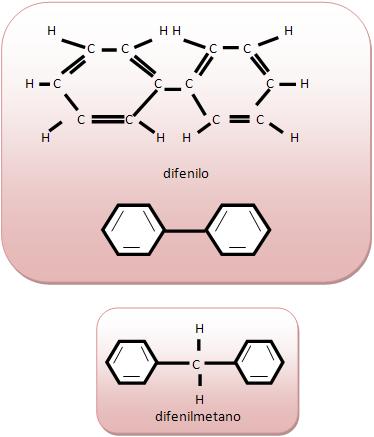
Cadeia aromática de núcleos condensados seus anéis possuem átomos de carbono comum.
Naftalleno ou naftalina (C10H8) é considerada um sólido branco que sofre sublimação para ser usado como inseticida sendo encontrado no alcatrão de hulha.
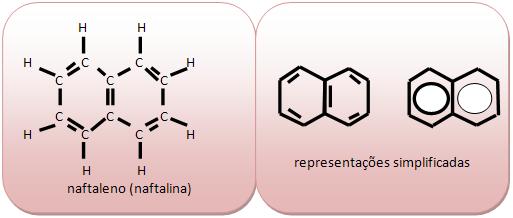
Cadeia alifática
• Existe uma certa divergência entre os autores quanto a classificação das cadeias.
• Alguns autores usam o termo cadeia alifática como sinônimo de cadeia aberta ou acíclica.
• Outros autores classificam como alifáticas as cadeias não-aromáticas.
A afirmação mais correta seria as cadeias e as alicíclicas seriam alifáticas.
Classificação das cadeias carbônicas fechadas
A classificação das cadeias carbônicas fechadas utiliza como referência a presença de núcleo benzênico, ligações pi ou heteroátomos.
O benzeno é um dos principais exemplos de substância com cadeia carbônica fechada
A classificação das cadeias carbônicas fechadas é um importante tópico estudado na química orgânica, pois, a partir desse conhecimento, é possível construir a fórmula estrutural de um composto orgânico, como ciclenos, alcoóis cíclicos, aromáticos, cetonascíclicas, éteres cíclicos, etc.
Para realizar a classificação das cadeias carbônicas fechadas, iniciamos pela divisão em dois grandes grupos:
- Cadeia carbônica fechada aromática;
- Cadeia carbônica fechada não aromática.
Classificação das cadeias carbônicas fechadas aromáticas
As cadeias fechadas aromáticas apresentam como principal característica a presença de um ciclo, que contém:
- Seis átomos de carbono;
- Seis átomos de hidrogênio;
- Um átomo de hidrogênio em cada carbono;
- 3 ligações duplas;
- 3 ligações simples;
- Ligações simples e duplas alternadas entre si.
Esse ciclo, com essas características, tem o nome oficial de benzeno. Um ponto fundamental é que ocorre no benzeno um fenômeno denominado de ressonância, no qual as ligações duplas trocam de posição de forma ininterrupta, alterando constantemente sua posição. Por essa razão, é comum simbolizar as três duplas apenas por um círculo, que representa a ressonância.
Fórmula estrutural do benzênico com o anel
a) Aromáticas mononucleares
São as cadeias aromáticas que apresentam apenas um benzeno, que está ligado a outro elemento (por exemplo, o cloro), grupo substituinte (como o radical metil, CH3) ou um grupo funcional (como a carboxila).
Exemplos de aromáticos mononucleares
b) Aromáticas polinucleares
- Com núcleos isolados
Nesse tipo de cadeia carbônica aromática, há a presença de dois ou mais núcleos benzênicos, porém separados por um átomo de um elemento (por exemplo, um oxigênio) ou grupo funcional (por exemplo, a carbonila de uma cetona).
Fórmula estrutural de um aromático isolado por um elemento químico
Fórmula estrutural de um aromático isolado por um grupo funcional de cetona
- Com núcleos condensados
Nesse tipo de cadeia carbônica fechada aromática, temos a presença de dois ou mais núcleos benzênicos, unidos entre si, ou seja, existem carbonos e ligações em comum nas estruturas.
As cadeias aromáticas podem ser classificadas de acordo com o número de anéis aromáticos:
– mononuclear: quando possui apenas um núcleo (anel aromático)
– polinuclear: quando possui vários anéis aromáticos.
Os aromáticos polinucleares podem ser classificados em:
– polinucleares isolados: quando os anéis não possuem átomo de carbono em comum.
– polinuclear condensado: quando os anéis possuem átomos de carbono em comum.
– saturada: cadeia que possui apenas ligações simples entre os átomos.
– insaturada: cadeia que possui uma dupla ligação entre carbonos.
Podem ser classificadas de acordo com a presença ou não de um heteroátomo:
– homogênea ou homocíclicas: possuem somente átomos de carbonos ligados entre si.
– heterogênea ou heterocíclica: possuem um heteroátomo entre átomos de carbono.
Cadeias mistas
As cadeias carbônicas mistas são abertas e também fechadas.
Até agora as cadeias carbônicas foram representadas através de formas chamadas de fórmulas estruturais planas. Esse tipo de fórmula mostra todas as ligações, simbolizadas pelos traços, envolvidas nas cadeias carbônicas. Porém, visto que muitas dessas cadeias podem ser longas e complexas, é comum simplificar a fórmula estrutural, condensando algumas ligações. É possível fazer isso através de dois modos. Veja cada um deles:
- Fórmula estrutural condensada: a primeira forma de simplificar uma cadeia carbônica é utilizar índices, isto é, números que indicam a quantidade de átomos de hidrogênio que se ligam ao carbono. Exemplo:
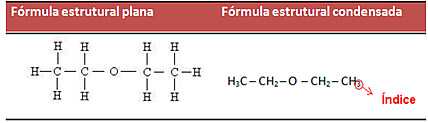
Isso também pode ser feito de forma ainda mais simplificada, utilizando índices para mostrar a quantidade de carbonos na cadeia. Veja como a fórmula mostrada anteriormente fica:
H2C5 ̶ O ̶ C5H2
- Fórmula de traços: essa fórmula representa as ligações entre carbonos, usando traços. As pontas, bem como as pontas das inflexões, correspondem a átomos de carbono.
Exemplos:
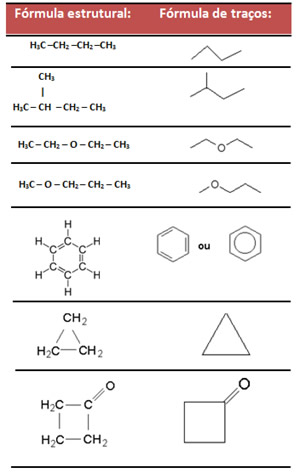
vídeo aulas relacionadas ao assunto:
Atividade Avaliativa 1 – cadeias carbônicas
1 – (Padre Anchieta SP) A substância de fórmula CH3–O–CH2–CH3 tem cadeia carbônica:
a) ( ) acíclica, homogênea e normal.
b) ( ) cíclica, heterogênea e ramificada.
c) ( ) cíclica, homogênea e saturada.
d) ( ) acíclica, insaturada e heterogênea.
e) ( ) acíclica, saturada e heterogênea.
2 – (Unifor CE) A acrilonitrila, H2C=CH–CN, matéria-prima usada na obtenção de fibras têxteis, tem cadeia carbônica:
a) ( ) acíclica e ramificada.
b) ( ) cíclica e insaturada.
c) ( ) cíclica e ramificada.
d) ( ) aberta e homogênea.
e) ( ) aberta e saturada.
CH3
|
CH3 — C — CH — CH2 — CH3
| |
CH3 CH3
a) ( ) 5 carbonos primários, 3 secundários, 1 terciário e 2 quaternários
b) ( ) 3 carbonos primários, 3 secundários, 1 terciário e 1 quaternário.
c) ( ) 5 carbonos primários, 1 secundário, 1 terciário e 1 quaternário.
d)( ) 4 carbonos primários, 1 secundário, 2 terciários e 1 quaternário.
4- No composto:
H3C
|
CH — CH — CH2 — CH — CH3
| | |
H3C CH3 CH3
as quantidades totais de átomos de carbono primário, secundário e terciário são, respectivamente, iguais a:
a)( ) 5, 2 e 2.
b) ( ) 5, 1 e 3.
c) ( ) 4, 3 e 2.
d) ( ) 3, 3 e 3.
e)( ) 2, 1 e 4.
5- A prednisona é um glicocorticoide sintético de potente ação antirreumática, anti-inflamatória e antialérgica, cujo uso, como de qualquer outro derivado da cortisona, requer uma série de precauções em função dos efeitos colaterais que pode causar. Os pacientes submetidos a esse tratamento devem ser periodicamente monitorados, e a relação entre o benefício e reações adversas deve ser um fator preponderante na sua indicação.
Fórmula estrutural da prednisona
Com base na fórmula estrutural apresentada anteriormente, qual o número de átomos de carbono terciários que ocorrem em cada molécula da prednisona?
a) ( ) 3
b)( ) 4
c) ( ) 5
d) ( ) 6
e) ( ) 7
6- Classifique em V ou F as sentenças relacionadas aos carbonos numerados da seguinte cadeia:
.jpg)
( ) os carbonos I, II e IV são primários
( ) o carbono III se classifica como secundário
( ) na cadeia há somente um carbono quaternário
( ) o carbono IV recebe a classificação de terciário
( ) existem 5 carbonos primários na cadeia
7- Observe o composto a seguir e assinale a alternativa correspondente ao número de carbonos primários presente nesta cadeia:
2,3- dimetilbutano
a) ( )1
b) ( ) 2
c) ( ) 3
d) ( )4
e) ( ) 5
8- (MACK SP) O hidrocarboneto, que apresenta a menor cadeia carbônica aberta, saturada e ramificada, tem fórmula molecular:
a) ( ) CH4
b) ( ) C4H8
c) ( ) C5H8
d) ( ) C4H10
e) ( ) C2H4
9- (ITE SP) O composto orgânico, de fórmula plana, possui:
A zidovudina ou AZT (azidotimidina) é um fármaco utilizado para inibir a infecção e os efeitos citopáticos do vírus da imunodeficiência humana do tipo HIV-I, o agente causador da AIDS. Abaixo é mostrada a fórmula estrutural do AZT:
Fórmula estrutural do AZT
Quantos carbonos saturados e insaturados, respectivamente, apresenta uma molécula do AZT?
a) ( ) 2 saturados e 8 insaturados.
b) ( ) 6 saturados e 4 insaturados.
c) ( ) 5 saturados e 5 insaturados.
d) ( ) 4 saturados e 6 insaturados.
e) ( ) 8 saturados e 2 insaturados.
10 – (MACK SP) O composto apresenta:
Ch³
Ι
Ch³ -C – Ch³
Ι
Nh³
a) ( ) cadeia carbônica insaturada.
b) ( ) somente carbonos primários.
c) ( ) um carbono quaternário.
d)( ) três carbonos primários e um terciário.
e) ( ) cadeia carbônica heterogênea.
11 – (UFJF MG) Classificar a cadeia da molécula 3-metil 1-penteno.
a) ( ) cíclica, ramificada, saturada, homogênea;
b) ( ) acíclica, normal, insaturada, heterogênea;
c) ( ) acíclica, ramificada, insaturada, homogênea;
d) ( ) cíclica, ramificada, saturada, homogênea;
e) ( ) acíclica, ramificada, saturada, homogênea;
12- (UEL PR) Dentre os componentes do cigarro, encontram-se a nicotina que interfere no fluxo de informações entre as células, a amônia que provoca irritação nos olhos e o alcatrão, formado pela mistura de compostos como o benzopireno, o crizeno e o antraceno, todos com potencial cancerígeno. Sobre o benzopireno, cuja estrutura química é apresentada a seguir, é correto afirmar que a molécula é formada por:

a) ( ) Cadeias aromáticas com núcleo benzênico.
b) ( ) Arranjo de cadeias carbônicas acíclicas.
c) ( ) Cadeias alicíclicas de ligações saturadas.
d) ( ) Cadeias carbônicas heterocíclicas.
e) ( ) Arranjo de anéis de ciclo hexano.
13- O náilon é um polímero de condensação, mais especificamente da classe das poliamidas, que são polímeros formados pela condensação de um diácido carboxílico com uma diamida. Uma das variedades desse polímero pode ser obtida por meio de uma matéria-prima denominada de caprolactana, cuja fórmula estrutural é:
Fórmula da caprolactana
Analisando essa cadeia, podemos classificá-la em:
a) ( ) Fechada, insaturada, heterogênea, mononuclear.
b) ( ) Alicíclica, insaturada, heterogênea, mononuclear.
c) ( ) Fechada alicíclica, saturada, heterogênea, mononuclear.
d) ( ) Fechada alicíclica, insaturada, homogênea, mononuclear.
e) ( ) Fechada, insaturada, homogênea, mononuclear.
14 (PUC-RS)O ácido etilenodiaminotetracético, conhecido como EDTA, utilizado como antioxidante em margarinas, de fórmula
Fórmula do EDTA (ácido etilenodiaminotetracético)
Apresenta cadeia carbônica
a) ( ) acíclica, insaturada, homogênea.
b) ( ) acíclica, saturada, heterogênea.
c) ( ) acíclica, saturada, homogênea.
d) ( ) cíclica, saturada, heterogênea.
e) ( ) cíclica, insaturada, homogênea.
Aula 15
Semana 03/09 a 17/09
A Nomenclatura IUPAC refere-se ao estabelecimento de regras para a escrita dos nomes dos compostos que são oficialmente aceitos em todo o mundo. Essas regras são estabelecidas pela IUPAC (União internacional da Química Pura e Aplicada, sigla que vem do inglês International Union of Pure na Applied Chemistry). Desde 1892 esse órgão tem realizado reuniões internacionais envolvendo químicos bem conceituados para aperfeiçoar essa nomenclatura.
A nomenclatura dos compostos orgânicos é muito importante, pois, atualmente, existem mais de 19 milhões dessas substâncias presentes em inúmeros produtos usados em indústrias, laboratórios e no nosso cotidiano. Assim, esses compostos precisam ser identificados internacionalmente, pois, por exemplo, ao se publicar alguma pesquisa científica com a utilização ou obtenção de determinado composto químico, outros cientistas poderão repetir os experimentos e avaliá-los, sabendo quais são os compostos corretos.
Visto que muitos desses compostos têm estruturas e propriedades parecidas, a nomenclatura IUPAC segue regras que permitem que todas as substâncias orgânicas possuam nomes diferentes, não repetindo em nenhum caso. Além disso, outro aspecto importante é que é possível determinar a nomenclatura do composto por meio da sua fórmula estrutural e vice-versa.
HIDROCARBONETOS
O petróleo é uma mistura de hidrocarbonetos e constitui a principal fonte desses compostos
Os hidrocarbonetos são compostos formados somente por átomos de carbono e hidrogênio. Essa é a função orgânica mais simples, porém a mais importante e utilizada. Além disso, as cadeias carbônicas dos hidrocarbonetos servem de base para a formação de todas as demais funções orgânicas.
Esse grupo funcional divide-se em alifáticos e aromáticos. Os aromáticos são os que possuem pelo menos um anel benzênico em sua cadeia, já os alifáticos (todos os demais) são subdivididos em:
* Alcanos: hidrocarbonetos de cadeia aberta que possuem somente ligações simples entre carbonos;
* Alcenos: hidrocarbonetos de cadeia aberta que possuem uma ligação dupla entre carbonos;
* Alcinos: hidrocarbonetos de cadeia aberta que possuem uma ligação tripla entre carbonos;
* Ciclanos ou cicloalcanos: hidrocarbonetos de cadeia fechada que possuem somente ligação simples entre carbonos;
* Ciclenos ou cicloalcenos: hidrocarbonetos de cadeia fechada que possuem uma ligação dupla entre carbonos.
Desse modo, você pode observar que os hidrocarbonetos constituem um grupo funcional bastante diversificado e amplo. Além disso, são muito importantes, pois constituem o petróleo, que é, atualmente, a principal fonte de combustíveis e de energia; estão presentes na parafina usada em velas e objetos decorativos; compõem o gás natural e o gás que causa o amadurecimento das frutas; são encontrados em óleos essenciais; são utilizados como solventes e removedores de tintas e vernizes, bem como na produção de polímeros (plásticos e borrachas); fazem parte do carvão, entre outras aplicações.
Em razão desses inúmeros fatores é que decidimos separar esta subseção. Ela apresenta artigos que retratam essa função da Química Orgânica de uma forma bem detalhada, abordando cada tipo de hidrocarboneto, suas fontes, aplicações e a sua nomenclatura.
Atualmente, as regras básicas que cumprem esse objetivo para grande parte dos compostos orgânicos são as seguintes:
Regras principais que constituem a nomenclatura IUPAC
Observe que o primeiro aspecto que observamos na fórmula é a quantidade de carbonos que existem na cadeia. Por exemplo, observe o composto abaixo:
Nessa fórmula, há cinco átomos de carbono na cadeia, portanto, o seu prefixo é PENT.
Agora, analisamos os tipos de ligações existentes entre os carbonos, que, nesse caso, são somente ligações simples (saturadas), assim, o infixo é AN.
Por último, vemos à qual função orgânica o composto pertence. No exemplo considerado, temos somente átomos de carbono e hidrogênio, o que significa que esse composto pertence ao grupo dos hidrocarbonetos e, portanto, a sua terminação é O.
Juntando essas três partes, temos: PENTANO. Esse é o nome do composto apresentado.
Há dois casos excepcionais que possuem uma palavra antes do prefixo: os compostos de cadeia fechada, em que precisamos escrever primeiro a palavra “ciclo”, e os compostos do grupo dos ácidos carboxílicos, que escrevemos primeiro a palavra ácido. Veja:
Se houver alguma ligação dupla ou tripla (insaturações) ou alguma ramificação (quando há na estrutura mais de duas extremidades) na cadeia carbônica, torna-se necessário numerar os carbonos da cadeia para poder indicar no seu nome onde a insaturação ou a ramificação está ocorrendo. A numeração deve começar do carbono da extremidade que estiver mais próximo do grupo funcional. Em todos os casos, inicia-se a nomenclatura considerando-se a seguinte ordem de importância:
grupo funcional > insaturação > ramificação
Veja alguns exemplos e observe que as ramificações são escritas primeiro e que, se houver mais de uma ramificação, elas devem ser escritas em ordem alfabética, desconsiderando prefixos como di, tri etc. Além disso, os números dos carbonos nas insaturações devem considerar os menores números possíveis:
Veja, nesse caso, que não começamos a numeração do carbono mais próximo à ramificação, mas sim do carbono mais próximo à insaturação.
Nesse composto, é possível perceber que as ramificações foram colocadas em ordem alfabética e foram considerados os menores números possíveis (3, 4 e 6), porque se começássemos da outra extremidade, teríamos os seguintes números dos carbonos de onde saem as ramificações (5, 7 e 8).
Além dos grupos funcionais mostrados na tabela mais acima, existem muitos outros. Veja quais são na seção: Grupos Funcionais.
Existem, porém, cadeias carbônicas tão complexas e grandes que, infelizmente, essas regras aplicadas aqui não são suficientes. Mas elas são úteis para os compostos estudados no Ensino Médio.
Por Jennifer Fogaça
Graduada em Química
Radicais
Radicais são todos os agrupamentos atômicos que contêm uma ou mais valências livres e que não podem ocorrer em liberdade. A nomenclatura leva a regra de apenas adicionar a palavra il ou ila nas terminações do nome.
O radical é uma partícula eletricamente neutra, ao inverso do íon que possui carga elétrica.
- Radicais alquilas ou alcoílas
São considerados radicais monovalentes que são derivados dos alcanos.
Existem quatros radicais butil (C4H9 –):
- Radicais alquenilas
Os radicais alquenilas são radicais monovalentes decorrentes dos alcenos (alquenos).
- Radicais alquinilas
Os radicais alquinilas são radicais monovalentes decorrentes dos alcinos (alquinos).
- Radicais arilas
Os radicais arilas são radicais monovalentes, mas sua valência livre está presente em um carbono pertencente em um número de benzênico.
- Observações:
O radical benzil é um radical aromático monovalente, que possui um núcleo benzênico, mas a sua valência livre não está nos carbonos do núcleo. Esta definição está de acordo com a I.U.P.A.C.
As definições de outros autores diferentes:
- Radical alquila apresenta uma valência livre em carbono saturado.
• Radical alquenila possui uma valência livre em carbono de dupla-ligação.
• Radical alquinila apresenta uma valência livre em carbono de tripla-ligação.
Videoaula relacionada:
QUESTÃO 1
Escreva as fórmulas estruturais dos seguintes hidrocarbonetos:
- Propano
- Heptano
- 1-penteno
- 3-hexino
- Ciclopentano
- Ciclopenteno
- Hexa-1,3-dieno
- 2-metil-octano
- 6-metil-oct-1-eno
- 3-metilpent-1-ino
- Metilciclopentano
- 2,5-dimetil-hexa-1,3-dieno
- 1-butino
QUESTÃO 2
A seguir, temos as representações de alguns hidrocarbonetos aromáticos e ramificados.
Das opções abaixo, quais os nomes corretos segundo as regras estabelecidas pela IUPAC para cada um desses compostos?
- Metilbenzeno
- 2,6-dimetil-5-propil-octano
- Pent-1-ino
- 4,5-dimetil-hex-1-eno
- 1,4-dimetilbenzeno
- 3-etil-2-metil-hexano
- Metilbut-1,3-dieno
Funções orgânicas Assim como em química inorgânica, em química orgânica também agrupamos as substâncias com propriedades químicas semelhantes, que são consequência de características estruturais comuns, em funções.
Cada função orgânica é caracterizada por um grupo funcional, que lhe confere características e nomenclaturas específicas.
| Sufixo | Infixo | ||
| N° de Carbonos | Saturação da Cadeia | ||
| 1C | MET | Saturadas | AN |
| 2C | ET | ||
| 3C | PROP | Insaturadas | |
| 4C | BUT | ||
| 5C | PENT | 1 dupla | EN |
| 6C | HEX | 2 duplas | DIEN |
| 7C | HEPT | 3 duplas | TRIEN |
| 8C | OCT | ||
| 9C | NON | 1 tripla | IN |
| 10C | DEC | 2 triplas | DIIN |
| 11C | UNDEC | 3 triplas | TRIIN |
Quando a cadeia possuir ramificações, deve-se utilizar a nomenclatura referente ao número de carbonos da ramificação seguida do sufixo IL para indicar um radical.
Com base nessa regra geral, podemos nomear qualquer função orgânica apenas sabendo o sufixo relacionado ao seu grupo funcional. Podemos dividir as funções orgânicas em hidrocarbonetos, funções oxigenadas, funções nitrogenadas, funções halogenadas e outras funções menores.
Hidrocarbonetos
São um conjunto de funções que só contém carbono e hidrogênio em sua estrutura.
Grupo Funcional: C, H.
Nomenclatura: terminação -O
Os hidrocarbonetos podem ser divididos em:
Alcanos ou parafinas: hidrocarbonetos que possuem cadeia aberta e ligações simples. O termo parafina significa pouco reativo, do latim parum = pequena + affinis = afinidade.
Fórmula Geral: CnH2n+2
Exemplos:
| Pentano |
 |
| Nonano |
| |
Quando houverem ramificações na cadeia, essas devem ser escritas a frente da cadeia principal, utilizando a terminação –IL. A cadeia principal é contada a partir da extremidade mais próxima da ramificação. Exemplo:
| 3-metil-nonano |
 |
Se houverem duas ramificações, nomeá-las sempre em ordem alfabética. Exemplo:
| 4-etil-3-metil-heptano |
 |
Quando houver dúvida, utilizar a contagem mais próxima da ramificação que virá primeiro em ordem alfabética. Exemplo:
| 3-etil-4-metil-hexano |
 |
Alcenos, alquenos ou olefinas: são hidrocarbonetos que possuem cadeia aberta e ligações duplas (insaturação). O termo olefina significa oleoso, do latim oleum = óleo + affinis = afinidade.
Fórmula Geral: CnH2n
Na nomenclatura dos alcenos, é importante que a contagem da cadeia principal comece na extremidade mais próxima da dupla ligação. A posição da dupla deve vir antes do infixo que indica o tipo de ligação.
Exemplos:
| pent-2-eno |
 |
| 5-metil-hex-2-eno |
 |
Alcinos ou alquinos: são hidrocarbonetos que possuem cadeia aberta e ligações triplas. Utiliza-se para os alcinos as mesmas regras de nomenclatura dos alcenos, mas com sufixo in (+0, sufixo geral dos hidrocarbonetos).
Fórmula Geral: CnH2n-2
Exemplos:
| hept-2-ino |
 |
| 4-metil-hept-1,5-diino |
 |
Alcadienos ou dienos: são alcenos que possuem duas duplas ligações.
Fórmula Geral: CnH2n-2
Exemplo:
| hex-2,4-dieno |
 |
Hidrocarbonetos cíclicos: apresentam cadeia fechada e podem ou não possuir insaturações. Sua nomenclatura segue a regra dos hidrocarbonetos de cadeia aberta, apenas adicionando a palavra ciclo na frente.
Exemplos:
| Ciclopropano |
 |
| Ciclobuteno |
 |
| Metil-ciclohexano |
 |
Aromáticos: são hidrocarbonetos cíclicos que possuem três ligações duplas alternadas que permanecem em ressonância, formando um anel aromático, mais conhecido como benzeno. O benzeno pode se ligar a outros anéis e formar outros compostos aromáticos.
Exemplo:
| Naftaleno |
 |
| Antraceno |
 |
| Fenantraceno |
 |
Nos anéis aromáticos ramificados, é comum utilizar a seguinte designação para as posições das ramificações:
| 1,2-dimetil-benzeno ou orto-dimetil-benzeno |
 |
| 1,3-dimetil-benzeno ou meta-dimetil-benzeno |
 |
| 1,4-dimetil-benzeno ou para-dimetil-benzeno |
 |
Funções oxigenadas
São funções que apresentam o oxigênio na sua estrutura.
Álcoois: são compostos que apresentam o grupo hidroxila (‒OH) em sua estrutura. Podem possuir insaturações, cadeias cíclicas e ramificações. São solúveis em água e até onze carbonos são líquidos.
Na nomenclatura, a contagem da cadeia principal deve iniciar na extremidade mais próxima do grupo funcional.
Grupo Funcional: ‒OH
Nomenclatura: terminação –OL
Exemplos:
| etanol |
 |
| 4-metil-hexan-2-ol |
 |
| 2-metil-pent-3-enol |
 |
Fenóis: são álcoois onde a hidroxila está ligada diretamente ao anel aromático. São antibacterianos e fungicidas, mas podem ser tóxicos aos seres vivos.
Grupo Funcional: Caromático‒OH
Nomenclatura: Fenol ou hidroxi-benzeno
Nota: na nomenclatura de fenóis ramificados, deve-se iniciar a contagem no grupo funcional e girar no sentido horário ou anti-horário, de acordo com a menor numeração para a ramificação, a partir da hidroxila.
| Fenol ou hidroxi-benzeno |
 |
| 3-metil-fenol ou 1-hidroxi-3-metil-benzeno ou meta-metil-fenol |
 |
Éteres: são compostos que possuem um átomo de oxigênio ligado a dois átomos de carbono. Podem ser formados pela desidratação intermolecular de álcoois.
Grupo Funcional: ‒O‒
Nomenclatura: prefixo que indica o número de carbonos do menor radical + OXI + nome do hidrocarboneto correspondente ao maior radical.
Exemplos:
| Metoxi-propano |
 |
| Propoxi-propano |
 |
Aldeídos: são compostos que apresentam o grupamento carbonila (C=O) na extremidade da cadeia. O odor dos aldeídos que têm baixo peso molecular é irritante, porém, à medida que o número de carbonos aumenta, torna-se mais agradável.
Grupo funcional: 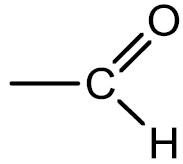
Nomenclatura: terminação -AL
Exemplos:
| Butanal |
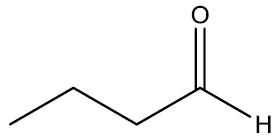 |
| 4-etil-hexanal |
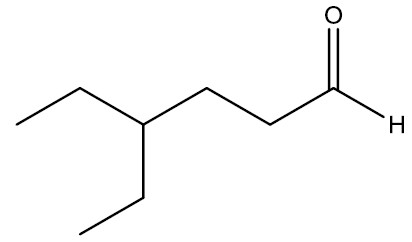 |
Cetonas: são compostos que apresentam o grupamento carbonila (C=O) no meio da cadeia. São formadas pela oxidação de álcoois secundários, onde um átomo de hidrogênio (ligado ao oxigênio) é retirado e o átomo de oxigênio passa a fazer uma ligação dupla com o carbono da cadeia.
Grupo funcional: 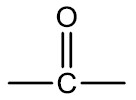
Nomenclatura: terminação -ONA
Exemplos:
| Propanona ou acetona |
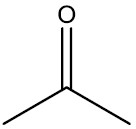 |
| 3-metil-pentan-2-ona |
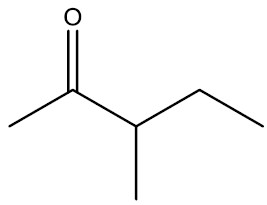 |
Ácidos Carboxílicos: são compostos que possuem o grupamento carboxila (carbonila + hidroxila) na extremidade da cadeia. Em geral são mais fracos que os ácidos inorgânicos e dão origem aos ácidos graxos e lipídeos.
Grupo funcional: 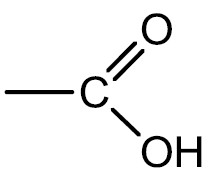
Nomenclatura: Ácido + terminação -ÓICO
Exemplos:
| Ácido propanóico |
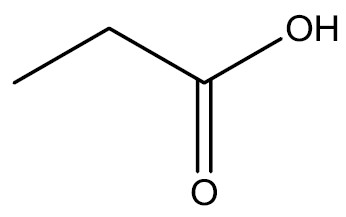 |
| Ácido 2-metil-butanóico |
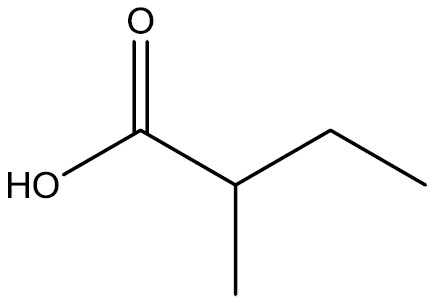 |
Sais de ácidos carboxílicos: são compostos derivados de uma neutralização do ácido carboxílico com uma base. Sendo o metal (Me) incorporado na cadeia carbônica enquanto há liberação de água.
Grupo funcional: 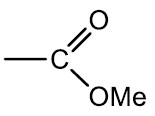
Nomenclatura: terminação –ATO de nome do metal
Exemplo:
| Butanoato de sódio |
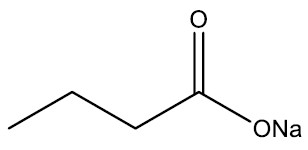 |
Ésteres: originam-se a partir da substituição do hidrogênio da hidroxila de um ácido por um radical orgânico. Podem ser produzidos pela esterificação de um ácido carboxílico com um álcool.
Grupo funcional: 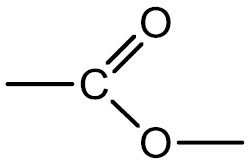
Nomenclatura: terminação –ATO de nome do radical carbônico
Exemplos:
| Propanoato de metila |
 |
| Propanoato de propila |
 |
 Funções nitrogenadas
Funções nitrogenadas
São funções que possuem o nitrogênio em sua estrutura.
Aminas: são bases orgânicas, obtidas a partir da substituição de um ou mais hidrogênios da amônia (NH3) por radicais orgânicos. Os aminoácidos são compostos que possuem o grupamento amina e ácido carboxílico na mesma molécula.
Grupo Funcional: ‒NH2 ou ‒NH‒ ou ‒N<
Nomenclatura: terminação -AMINA
Exemplos:
| Etilamina |
 |
| Etil-metilamina |
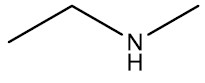 |
| Dietil-metilamina |
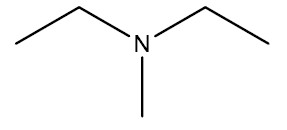 |
Amidas: São compostos orgânicos derivados de ácidos carboxílicos pela substituição da hidroxila (‒OH) pelo grupamento amino (‒NH2). A ureia, de fórmula CO(NH2)2, é uma diamida que é eliminada pela urina por ser produto final do metabolismo dos animais superiores.
Nomenclatura: terminação -AMIDA
Exemplos:
| Propanoamida |
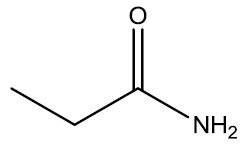 |
| 2-metil-propanoamida |
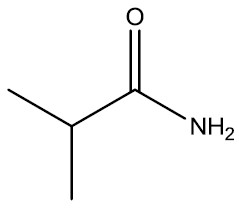 |
Nitrocompostos: São compostos que apresentam o radical nitro (‒NO2). Tem larga aplicação em explosivos e agrotóxicos.
Grupo Funcional: ‒‒NO2
Nomenclatura: NITRO + nome do hidrocarboneto
Exemplos:
| Nitrobutano |
 |
| 2,4-dimetil-nitropentano |
 |
Nitrilas ou cianetos: são compostos que apresentam o radical nitrila (‒CN). São o resultado da substituição do átomo de hidrogênio do cianeto de hidrogênio ou ácido cianídrico (HCN) por um radical orgânico.
Grupo funcional: ‒CN
Nomenclatura: terminação -NITRILA
Exemplos:
| Butanonitrila |
 |
| 3-metil-pentanonitrila |
 |
 Funções halogenadas
Funções halogenadas
São funções que possuem em sua estrutura um halogênio (F, Cl, Br ou I).
Haletos Orgânicos ou derivados halogenados: são compostos formados a partir da substituição de um átomo de hidrogênio de um hidrocarboneto por um halogênio. São insolúveis em água e em geral tóxicos e danosos aos organismos vivos.
Grupo Funcional: ‒X (F, Cl, Br ou I)
Nomenclatura: nome do halogênio + nome do hidrocarboneto
Exemplos:
| Bromo-propano |
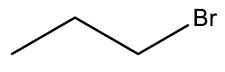 |
| Cloro-benzeno |
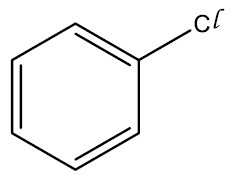 |
Haletos de Ácidos ou haletos de acila: são compostos derivados de ácidos carboxílicos onde a hidroxila foi substituída por um halogênio. Os cloretos de ácidos mais simples são líquidos de cheiro forte e irritante, tóxicos, insolúveis e mais densos que a água.
Nomenclatura: nome do halogênio + -ETO de nome do hidrocarboneto + ILA
Exemplos:
| Iodeto de hexanoíla |
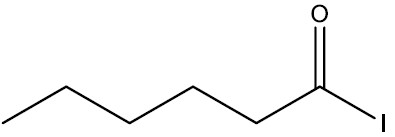 |
| Fluoreto de butanoíla |
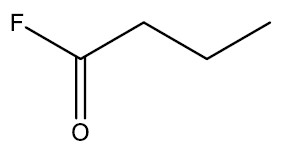 |
Ácidos sulfônicos
São compostos orgânicos derivados do ácido sulfúrico (H2SO4) pela substituição de uma hidroxila por um radical orgânico. São largamente aplicados na obtenção de surfactantes (espumantes), que estão presentes em xampus, detergentes e cremes dentais.
Grupo Funcional: ‒SO3H
Nomenclatura: ÁCIDO + nome do hidrocarboneto + SULFÔNICO
Exemplos:
| Ácido propanosulfônico |
 |
| Ácido 5-metil-3-hexasulfônico |
 |
Compostos de Grignard
São compostos organometálicos que apresentam pelo menos um átomo de um metal ligado diretamente ao átomo de carbono.
Grupo Funcional: ‒MgX (F, Cl, Br, I)
Nomenclatura: halogênio + ETO de radical + MAGNÉSIO
Exemplos:
| Brometo de etil-magnésio |
 |
| Fluoreto de ciclohexil-magnésio |
 |
Funções mistas
São compostos que apresentam diversas funções na estrutura. Em geral, possuem nomenclatura IUPAC mais complexa, por esta razão são mais conhecidos por seus nomes usuais.
Exemplos:
| Colesterol |
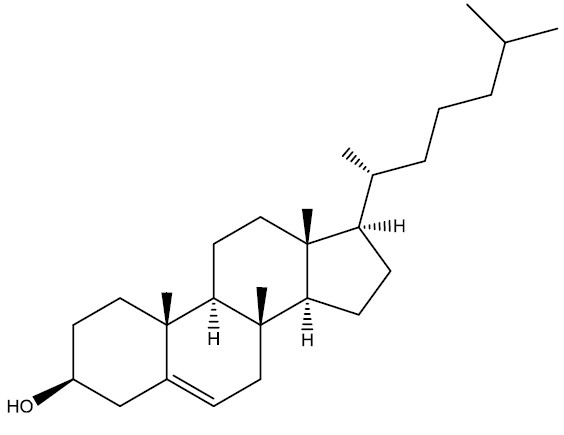 |
| Aspartame |
 |
Bibliografia
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.
http://www.joinville.udesc.br/portal/professores/franciscogm/materiais/Fun__es_org_nicas.pdf
http://web.ccead.puc-rio.br/condigital/mvsl/Sala%20de%20Leitura/conteudos/SL_funcoes_organicas.pdf



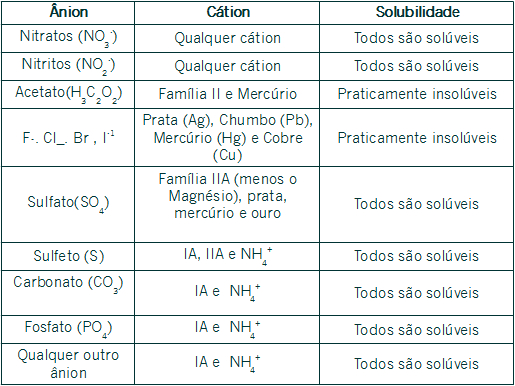
ISOMERIA
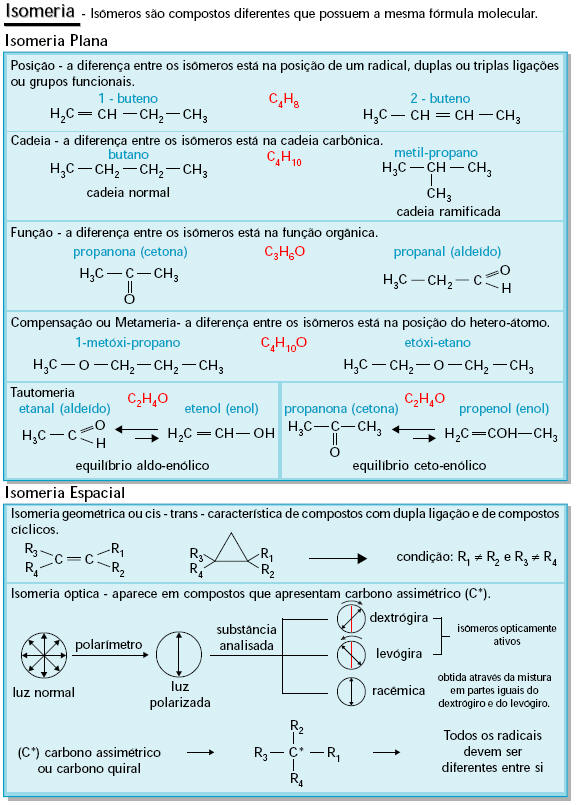
Exercícios Sobre Funções Orgânicas Com Oxigênio
Estes exercícios testarão seus conhecimentos sobre as funções orgânicas com oxigênio, como álcool, fenol, éter, éster, cetona, aldeído e fenol.
-
-

e as seguintes funções químicas:
a. ácido carboxílico; d. cetona;
b. álcool; e. éster;
c. aldeído; f. éter.
A opção que associa CORRETAMENTE as substâncias com as funções químicas é:
a) Id; IIc; IIIe; IVf.
b) Ic; IId; IIIe; IVa.
c) Ic; IId; IIIf; IVe.
d) Id; IIc; IIIf; IVe.
e) Ia; IIc; IIIe; IVd.
-
-
- Questão 2
(EFOA-MG) As estruturas abaixo representam algumas substâncias usadas em protetores solares.



A função que NÃO está presente em nenhuma dessas estruturas é:
a) cetona.
b) éter.
c) éster.
d) amina.
e) álcool.
- Questão 2
-
- Questão 3
A fórmula estrutural abaixo pertence ao barbatusol, que é a principal substância presente em uma planta conhecida como boldo. Essa planta é muito utilizada porque a substância em questão é eficiente para tratar males do fígado e também problemas relacionados com a digestão.
Analisando a fórmula estrutural do barbatusol, qual é o nome da função oxigenada presente em sua estrutura?
a) álcool
b) éster
c) fenol
d) éter
e) aldeído
- Questão 3
-
- Questão 4
A fórmula estrutural abaixo pertence à substância vanilina, que é responsável pelo aroma e sabor característicos da baunilha:

Analisando a estrutura da vanilina, quais são as substâncias oxigenadas presentes em sua estrutura?
a) álcool, éter e éster
b) álcool, ácido e fenol
c) aldeído, álcool e éter
d) aldeído, éster e álcool
e) aldeído, éter e fenol
- Questão 4
Respostas
-
- Resposta Questão 1
Letra c). A resposta é a letra c) porque:
I- é um aldeído por apresentar uma carbonila na extremidade da cadeia;
II- é uma cetona por apresentar uma carbonila entre dois carbonos da cadeia;
III- é um éter por apresentar um átomo de oxigênio ligado simultaneamente a dois átomos de carbono;
IV- é um éster porque um átomo de carbono está ligado a dois oxigênios – um por uma ligação dupla e outro por uma ligação simples.
- Resposta Questão 1
-
- Resposta Questão 2
Letra e). Nenhuma das estruturas fornecidas apresenta um álcool, que é composto por um grupo hidroxila (OH) ligado diretamente a um carbono saturado (apresenta somente ligações simples).

Resposta Questão 3
Letra c). Temos um fenol porque o grupo hidroxila (OH) está ligado diretamente ao benzeno.
.jpg)
- Resposta Questão 2
- Resposta Questão 4
Letra e). A resposta é a letra e) porque temos:
- Aldeído: uma carbonila na extremidade da cadeia;
- Éter: um átomo de oxigênio ligado simultaneamente a dois átomos de carbono;
- Fenol: grupo hidroxila (OH) ligado diretamente ao benzeno.

EXERCÍCIOS SOBRE FUNÇÕES ORGÂNICAS
QUESTÃO 1
(UFPR) A fenilefrina, cuja estrutura está representada abaixo, é usada como descongestionante nasal por inalação.
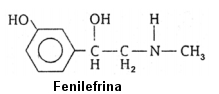
Estrutura da fenilefrina
Sobre a fenilefrina, é correto afirmar que:
01. na sua estrutura existem duas hidroxilas.
02. as funções existentes nesse composto são fenol, álcool e amina.
04. a função amina presente caracteriza uma amina primária, porque só tem um nitrogênio.
08. a função amina presente é classificada como secundária.
16. os substituintes do anel aromático estão localizados em posição meta.
QUESTÃO 2
(UESPI) Os representantes dos compostos dessa função orgânica são oxigenados. Têm caráter relativamente ácido, porém, menos ácido que os ácidos carboxílicos. Em geral, eles são pouco solúveis ou insolúveis em água, mas os seus sais são bem mais solúveis. Alguns são utilizados como desinfetantes e na produção de resinas. As características apontadas anteriormente estão associadas à função:
a)álcool.
b)aldeído.
c)cetona.
d)éter.
e)fenol.
QUESTÃO 3
(USJT-SP) Alguns compostos são muito utilizados para intensificar o sabor de carnes enlatadas, frangos, carnes congeladas e alimentos ricos em proteínas. Por exemplo:
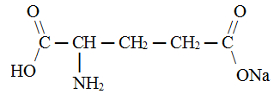
Composto orgânico em exercício sobre funções
Esse composto não contribui, por si só, com o sabor. Sua função é explicada por duas teorias:
• estimula a atividade das papilas do gosto;
• aumenta a secreção celular.
Quais as funções orgânicas existentes no composto acima?
a) Amida, amina e ácido.
b) Anidrido de ácido e sal orgânico.
c) Amina, ácido carboxílico e sal orgânico.
d) Amida, ácido carboxílico e sal orgânico.
e) Amido, ácido orgânico e éster de ácido.
Associe corretamente a que grupo funcional pertence cada uma das substâncias a seguir:
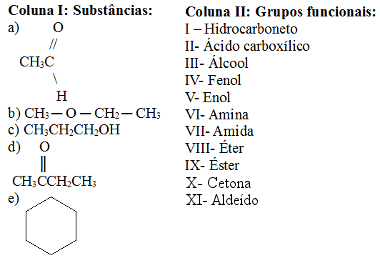
Compostos orgânicos e determinação dos grupos funcionais
A seguir são apresentadas as fórmulas estruturais de algumas substâncias que, de alguma forma, fazem parte do nosso cotidiano.
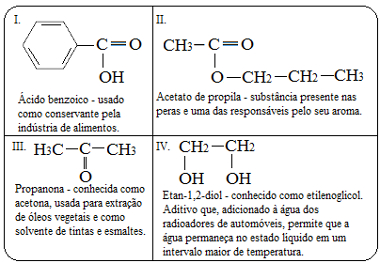
Compostos orgânicos presentes no cotidiano
Identifique as funções a que cada uma das substâncias citadas pertence:
a) Éster, éter, cetona, álcool.
b) Ácido carboxílico, éter, cetona, álcool.
c) Ácido carboxílico, éster, aldeído, álcool.
d) Ácido carboxílico, éster, cetona, álcool.
e) Ácido carboxílico, éter, aldeído, álcool.
QUESTÃO 6
Qual das afirmativas a seguir sobre funções orgânicas está incorreta?
a) Todo hidrocarboneto possui apenas carbono e hidrogênio.
b) Os haletos orgânicos são derivados da substituição de um ou mais hidrogênios por átomos de halogênios.
c) Os aldeídos possuem o grupo carbonila entre dois átomos de carbono.
d) Tanto as cetonas quanto os aldeídos possuem o grupo carbonila.
e) As aminas são derivadas da amônia pela substituição de um, dois ou três hidrogênios por cadeias carbônicas.
RESPOSTAS
Questão 1
Resposta: 27. Estão corretos os itens: 01, 02, 08 e 16.
04. Errado, porque se trata de uma amina secundária (há dois substituintes ou duas cadeias carbônicas ligadas diretamente ao nitrogênio).
Questão 2
Alternativa “e”.
O fenol apresenta um leve caráter ácido.
Questão 3
Alternativa “c”.
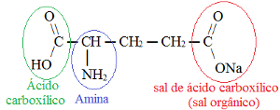
Funções orgânicas presentes em composto
Questão 4
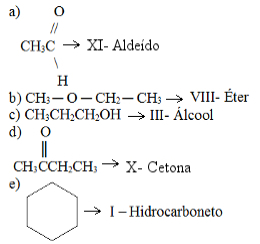
Resposta de exercícios sobre determinação de funções orgânicas
Questão 5
Alternativa “d”.
Questão 6
Alternativa “c”.
Os aldeídos possuem o grupo carbonila ligado a um hidrogênio. Na verdade, as cetonas correspondem à função orgânica que é caracterizada pelo grupo carbonila entre dois átomos de carbono.



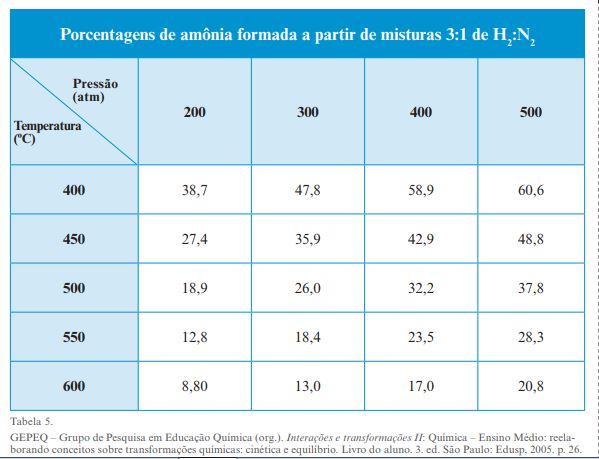

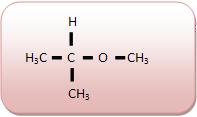
.jpg)