2° SÉRIE 2° BIMESTRE
11ª semana 16/04 a 20/04/2018
Orientação e revisão do 1 bimestre, a respeito do conteúdo. Auto avaliação do professor e aluno.
12ª semana 23/04 a 27/04/2018
Situação de Aprendizagem 6 – Tratamento da
Água – Uma questão de sobrevivência
CONTÉUDOS E TEMAS: Etapas de Tratamento da água.COMPETÊNCIA E HABILIDADES.Compreender a necessidade de tornar a água potável; conhecer procedimentos para seu tratamento, aplicando conceitos e processos como separação de sistema heterogêneos, solubilidade e transformação química; organizar e interpretar informações sobre o tratamento e consumo de água para refletir sobre o uso consciente da água e tomar suas decisões dentro dos limites, a esse respeito.
13ª semana 30/04 a 04/05/2018
Situação de Aprendizagem 7 – As quantidades em transformações que ocorrem em solução – Um cálculo importante no tratamento da água
CONTÉUDOS E TEMAS:Relações quantitativas de massa e de quantidade de matéria (mol) nas transformações químicas que ocorrem em soluções.COMPETÊNCIA E HABILIDADES.Construir e aplicar conceitos relativos ás proporções de reagentes e produtos numa reação em solução, compreendendo a importância desses cálculos na sociedade; interpretar a equações químicas em termos quantitativos.
14ª semana 07/05 a 11/05/2018
Situação de Aprendizagem 8 – Como o ser humano utiliza a água? Podemos interferir nos modos como a sociedade vem utilizando a água?CONTÉUDOS E TEMAS:Poluição ambiental; responsabilidades legais e pessoais; uso da água e sua preservação.
COMPETÊNCIA E HABILIDADES.Buscar dados e informações sobre poluição das águas; conhecer aspectos da legislação sobre a água e sobre seus usos, para compreender o problema e refletir sobre formas de atuação que auxiliam no enfretamento das situações cotidianas e na elaboração de propostas de intervenção em sua realidade.
15ª semana 14/05 a 18/05/2018
Situação de Aprendizagem 9 – Explicando o comportamento de materiais; modelos sobre a estrutura da matéria.CONTÉUDOS E TEMAS:
Natureza elétrica da matéria – condutividade elétrica dos materiais, isolantes e condutores.
COMPETÊNCIA E HABILIDADES.Classificação e estabelecimento de critérios; controle de variáveis; elaboração de modelo explicativos; ideias de Thomson, Rutheford e Bohr; Tabela periódica – estrutura e propriedades dos elementos.
16ª semana 21/05 a 25/05/2018
Situação de Aprendizagem 10 – Explicando o comportamento de materiais; as ligações entre átomos, íons e moléculas.CONTÉUDOS E TEMAS:Forças de atração e de repulsão elétrica; ligações químicas; localização dos metais e não metais na tabela periódica.
COMPETÊNCIA E HABILIDADES.Interpretar a ligação química em termos das atrações e repulsões entre elétrons e núcleos, relacionando as propriedades das substâncias de maneira a ampliar o entendimento do mundo físico; reconhecer a ideia de ligação química como modelo explicativo.
17ª semana 28/05 a 01/06/2018
Situação de Aprendizagem 11Transformações químicas; uma questão de quebra e formação de ligações.CONTÉUDOS E TEMAS:
Ligações químicas; modelo explicativo para transformação química; energia de ligação; modelo explicativo para transformações químicas exotérmicas e endotérmicas.
COMPETÊNCIA E HABILIDADES.
Empregar a linguagem química; interpretar a transformação química como a quebra e formação de ligações; compreender e identificar a energia envolvida na quebra e formação de ligações químicas, fazer previsões a respeito da energia envolvida numa transformação química.
18ª semana 04/06 a 08/06/2018
Situação de Aprendizagem 12 – Representando a energia envolvida nas transformações; o uso de diagramas de energia.CONTÉUDOS E TEMAS:Diagramas de energia; calor de reação; reação exotérmicas e endotérmicas.
COMPETÊNCIA E HABILIDADES.
Fazer uso da linguagem química; compreender, utilizar e saber construir gráficos de energia.
DISCIPLINA: QUÍMICA – 2° SÉRIE – 3° BIMESTRE.
19ª Aula
03 de agosto
Replanejamento do 3° Bimetre, revisão do conteúdo ministrado, retirado duvidas sobre as notas, orientação e auto avaliação do professor.
20ª Aula
10 de agosto
Falta Coletiva
21ª Aula
17 de agosto
Atividade 1 – O modelo de Rutherford-Bohr para explicar o comportamento da matéria Natureza elétrica da matéria – Condutibilidade elétrica: um critério para classificar os materiais
Atividade 2 – Do átomo de Dalton ao átomo de Rutherford-Bohr
Ideias de Thomson sobre o átomo
Ideias de Rutherford: modelo do átomo nuclear
Ampliando os conhecimentos sobre o átomo: novas ideias sobre o núcleo e a eletrosfera
O átomo de Bohr
21ª Aula
24 de agosto
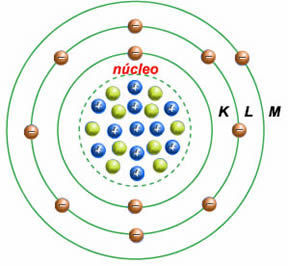
Camada de valência
A camada de valência é a camada mais externa que um átomo pode apresentar, ou seja, é a camada mais distante do núcleo de um átomo,é a ultima camada a receber o elétron em um átomo. Uma das formas de determiná-la é por meio de distribuição eletrônica ou pela tabela periódica.
Camada de valência é a última camada a receber elétron em um átomo a partir de sua distribuição eletrônica. Através do Principio de Linus Pauling, os átomos podem possuir até sete camadas de distribuição eletrônica, denominadas de K, L, M, N, O, P e Q. Os elétrons que pertencem à camada de valência são os que participam de uma ligação química por estarem mais externos em relação aos outros, sendo possível, deste modo, interações do tipo covalente e iônica (ou eletrostática)
Camada de valência e a tabela periódica
Podemos ainda determinar a camada de valência por meio do período e da família do elemento na Tabela Periódica.
a) Período O período (coluna horizontal, numerada de 1 a 7) em que o elemento está é a sua camada de valência.
Exemplo 1: Átomo de estanho (Sn) O estanho está localizado no quinto período da tabela periódica, logo, sua camada de valência é a quinta.
Exemplo 2: Átomo de bário (Ba) O bário está localizado no sexto período da tabela periódica, logo, sua camada de valência é a sexta.
Exemplo 3: Átomo de meitnério(Mt) O meitnério está localizado no sétimo período da tabela periódica, logo, sua camada de valência é a sétima.
b) Família A Quando o elemento pertence à família A, o número da família sempre será o número de elétrons na camada de valência, distribuídos nos subníveis s (limite de 2 elétrons) e p (limite de 6 elétrons).
Exemplo 1: Átomo de estanho (Sn)O estanho está localizado na família IVA da tabela periódica, logo, sua camada de valência apresenta quatro elétrons (dois estão presentes no subnível s e dois estão no subnível p).
Exemplo 2: Átomo de bário (Ba)O bário está localizado na família IIA da tabela periódica, logo, sua camada de valência apresenta dois elétrons (no subnível s).
c) Família B Independentemente da família B a que o elemento pertença, sua camada de valência sempre apresentará 2 elétrons (no subnível s).
Exemplo 1: Átomo de meitnério (Mt) O meitnério está localizado na família VIIB da tabela periódica, logo, sua camada de valência apresenta dois elétrons (no subnível s).
Exemplo 2: Átomo de cobre (Cu)O cobre está localizado na família IB da tabela periódica, logo, sua camada de valência apresenta dois elétrons.
Íons
Os íons são átomos que ganham ou perdem elétrons durante uma reação, podendo ser classificado em: ânions ou cátions.
Na+ e Cl–
Você sabe o que significa os sinais positivo e negativo destes elementos? Eles aparecem para indicar a presença de íons, neste caso se trata dos íons participantes da reação de formação do Cloreto de Sódio:
Na+ + Cl– ↔ NaCl
A seta indica que a reação é reversível.
Os íons explicam porque o composto é formado: o átomo de sódio (Na) não é estável, pois apresenta 1 elétron livre na camada de valência, a estabilidade só será atingida se ele perder um elétron, o que dará origem ao cátion Na+.
O átomo de cloro (Cl-) por sua vez também não é estável, pelos mesmos motivos que o Na, e atingirá a estabilidade somente se ganhar um elétron, esse átomo dá origem ao íon Cl-.
Sendo assim, a ligação iônica surge através da interação eletrostática e obedece a regra: cargas com sinais opostos se atraem.
Os compostos iônicos adquirem estrutura eletronicamente neutra por possuírem a mesma quantidade de prótons e elétrons, mas os íons formadores, pelo contrário: são reativos e instáveis.
Resumindo: Íons são átomos que perdem ou ganham elétrons durante reações, eles se classificam em ânions e cátions:
Ânion (íon negativo): átomo que recebe elétrons e fica carregado negativamente.
Exemplos: F-1, O-2.
Cátion (íon positivo): átomo que perde elétrons e adquire carga positiva. Exemplos:
Mg+2, Pb+4.
Exemplos de ionização de elementos químicos:9F → 9F-
Átomo neutro recebe 1 elétronO átomo de Flúor (F) se encontrava eletricamente neutro, mas como ganhou 1 elétron passou a se apresentar como um Ânion.
Átomo neutro perde 2 elétronsO átomo de Cálcio (Ca) perdeu 2 elétrons e passou a ser um cátion.
40Ca → 40Ca2+
22ª Aula
07 setembro feriado nacional
14 de setembro
Atividade Avaliativa
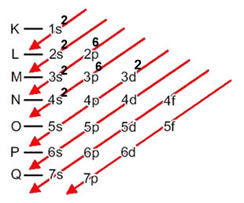
Diagrama de Linus Pauling
O diagrama de Linus Pauling serve para auxiliar no preenchimento de elétrons pelos subníveis de energia em determinado átomo. Nesse diagrama, os subníveis energéticos são denominados pelas letras s, p, d e f, cada qual com sua energia específica. Para entender o diagrama, usa-se o modelo atômico de Rutherford-Bohr, onde se admite que os elétrons girem ao redor do núcleo atômico em diferentes camadas energéticas:
Camadas eletrônicas, níveis e subníveis de energia com seus preenchimentos eletrônicos.
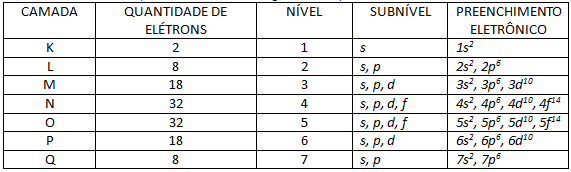
Observando a Tabela acima, vemos que o número de elétrons é a soma dos números sobrescritos na coluna de preenchimento eletrônico, o que quer dizer que a cada camada, há um número de elétrons que se distribuem pelos subníveis de energia denominados pelas letras s, p, d e f. O número máximo de elétrons por subnível está representado pelo número sobrescrito. Deste modo, a última coluna é chamada de Diagrama de Linus Pauling, que é preenchido e seguido de acordo com a figura abaixo:
Diagrama de Linus Pauling.

Notamos pelo diagrama acima que há uma seta contínua e pontos tracejados. Tais figuras servem para indicar o preenchimento de elétrons em um átomo e sua continuação após o fim da seta. Por exemplo: O cloro contém 17 elétrons, como se dá seu preenchimento pelo Diagrama de Linus Pauling? Qual será sua camada de valência? Bem, como o elemento nos dá 17 elétrons, é só seguir o diagrama somando o número máximo de elétrons que cada subnível pode comportar. Assim, o preenchimento será da forma:
1s2 2s2 2p63s23p5
Com o resultado acima, faremos algumas observações:
I) Observe o preenchimento do exemplo e siga a seta do diagrama, note que seguimos a cada linha contínua e tracejada;
II) Começamos preenchendo por 1s2, depois de preencher este subnível, faltam ainda 15 elétrons para serem alocados. Como o subnível s comporta apenas 2 elétrons, passamos para o próximo, e assim sucessivamente, cada qual com seu subnível de número máximo de elétrons que pode comportar;
III) Note que em 3p5 há apenas 5 elétrons no subnível p, tendo em vista que neste subnível cabe 6 elétrons. Um subnível pode estar completo com seu número máximo de elétrons ou pode faltar, mas nunca exceder. Exemplo, o subnível p não pode ter 7 elétrons, mas pode ter 6 ou menos elétrons.
IV) Observe que deixamos em negrito os níveis e subníveis 3s2 3p5. Esta é a camada de valência, a última camada do átomo de Cloro. De acordo com a Tabela acima, o número 3 representa o nível M, e a soma dos números sobrescritos é 5+2 = 7, logo há 7 elétrons na camada de valência do átomo de Cloro.
23ª Aula
21 setembro
Recuperação da aprendizagem
Camada de Valência e Tabela Periódica dos Elementos
A representação dos elementos por meio do preenchimento eletrônico nos permite deduzir a localização deste na Tabela Periódica em termos de seus respectivos Grupos (ou Famílias). Se um elemento possui 7 elétrons em sua camada de valência, este deve estar localizado no Grupo 7 (ou Família 7A), da mesma forma se um elemento possuir apenas 1 elétron em sua camada de valência, este deve estar localizado no Grupo 1 (ou Família 1A).
Camada de Valência e Ligação Química
A maioria dos elementos químicos que estão listados na Tabela Periódica dos Elementos não possuem sua camada de valência completa, apenas os Gases Nobres do Grupo 8 (ou Família 8A), que possuem 8 elétrons em sua camada mais externa. Sendo assim, a maioria dos elementos químicos seguem a regra do octeto, que preconiza a estabilidade química com a quantidade de 8 elétrons em sua camada de valência. Logo, os elementos podem fazer ligações do tipo iônicas ou covalentes para preencherem sua camada mais externa e assim ficarem com estabilidade semelhante a de um gás nobre, com oito elétrons.
Distribuição eletrônica de elementos neutros, cátions e ânions e suas camadas de valência
Na natureza, os elementos químicos podem ser encontrados em um estado neutro, em forma de cátions (ou seja, carregados positivamente) ou em forma de ânions (carregados negativamente). Para entender uma ligação química, é necessário saber como é a camada de valência do elemento em análise. A distribuição eletrônica é a mesma que fizemos no exemplo com o átomo de cloro, mas com algumas particularidades.
Átomos neutros
Em átomos neutros não há presença de carga, logo a sua distribuição eletrônica por meio do Diagrama de Linus Pauling segue-o na íntegra, como foi feito com o exemplo anterior usando o átomo de cloro.
Átomos carregados negativamente (ânions)
Em ânions há a presença de carga negativa, se um átomo for da forma X–, significa que há uma carga negativa; X-2, há duas cargas negativas; X-3, três cargas negativas; e assim por diante. O elétron possui carga negativa, logo, um ânion há excesso de elétrons em relação a seu átomo neutro. Desse modo, um átomo X-2 possui 2 elétrons a mais em relação a seu átomo na forma X, neutra. Assim, o preenchimento eletrônico de átomos carregados negativamente deve ser feito adicionando elétrons junto ao subnível que está incompleto.
Exemplo: o átomo de Cloro pode apresentar-se na forma Cl-1, deste modo, o preenchimento pelo Diagrama de Pauling para o íon cloreto será 1s2 2s2 2p63s23p6.
Átomos carregados positivamente (cátions)
Em cátions, há a presença de carga positiva, ou seja, há deficiência de elétrons nesse tipo de átomo. Logo, um átomo que apresente a forma X+2 possui deficiência de dois elétrons em relação a seu átomo neutro. O mesmo raciocínio se aplica ao item anterior que usamos para ânions, sendo dessa vez realçado o déficit de elétrons para formar a carga positiva. Assim, o preenchimento eletrônico seguindo o Diagrama de Linus Pauling deve ser feito subtraindo elétrons de seu átomo neutro. Essa subtração é feita no(s) último(s) níveis e subnível(eis).
Exemplo: o átomo de Ferro em seu estado neutro possui 26 elétrons e a seguinte distribuição eletrônica 1s2 2s2 2p6 3s2 3p64s2 3d6. Notamos que sua camada de valência possui 2 elétrons, representada por 4s2.
O Ferro pode ser encontrado na natureza na forma Fe+2, mais conhecido como Ferro(II). Sendo assim, sua distribuição eletrônica fica da forma 1s2 2s2 2p6 3s2 3p6 3d6, com a ausência de dois elétrons que estavam na camada N = 4s2.
Referências
BROWN, T., LEMAY, E., Quimica – Ciência central. 9ed. Prentice-Hall, 2005.
TESTE SEU CONHECIMENTO
- Faça a distribuição eletrônica para o átomo de Sr+2 e indique o nível e subnível da camada de valência.
- [UDESC/2009]Os elementos X e Y possuem as seguintes configurações eletrônicas 1s22s2 2p6 3s23p6 4s2 3d10 4p3 e 1s2 2s2 2p6 3s2 3p6 4s1 respectivamente. O período e a família em que se encontram estes elementos são: a) Os elementos X e Y pertencem ao quarto período, sendo que o elemento X pertence á família 5A e o elemento Y pertence à família 1A.
b) Os elementos X e Y pertencem ao quarto período, sendo que o elemento X pertence á família 3A e o elemento Y pertence à família 1A.
c) Os elementos X e Y pertencem a mesma família e ao mesmo período.
d) Os elementos X e Y pertencem ao terceiro e primeiro período respectivamente. Quanto à família os dois elementos pertencem à família 4A.
e) O elemento X é um alcalino e o elemento Y é um halogênio.
Distribuição Eletrônica no Diagrama de Pauling
Publicado por: Jennifer Rocha Vargas Fogaça

Segundo o cientista Schrödinger, cada elétron da eletrosfera de um átomo possui uma determinada quantidade de energia. Assim, cada elétron só permanece no nível e subnível de energia correspondente.A distribuição desses elétrons em seus níveis e subníveis de energia é feita de forma crescente de energia. E sua representação gráfica é dada pelo Diagrama de Pauling, criado pelo químico Linus Pauling (1901-1994), que recebeu dois prêmios Nobel, um de Química (1954) e o outro da Paz (1962).O diagrama de Pauling representa os níveis, que são as camadas eletrônicas do átomo. São sete níveis, enumerados de forma crescente do mais próximo ao núcleo para fora (1, 2, 3… 7) e, denominados, respectivamente, pelas letras K, L, M, N, O, P e Q.Existem no máximo quatro subníveis, que são: s, p, d, f.A quantidade de subníveis existentes em cada nível está esboçada abaixo:

A quantidade máxima de elétrons que pode ser distribuída em cada nível e subnível está evidenciada a seguir:

Visto que, para um mesmo nível, os subníveis têm energias diferentes, nem sempre o subnível energético é o mais afastado do núcleo. Por isso, é importante seguir a ordem crescente de energia dos subníveis no momento de fazer a distribuição dos elétrons. Essa ordem é dada pelas setas indicadoras no Diagrama de Pauling:

Portanto, veja exemplos de distribuição dos elétrons de dois elementos químicos:Exemplo 1: Magnésio (12Mg)Ordem energética da distribuição eletrônica do 12Mg: 1s2, 2s2, 2p6 e 3s2.

Exemplo 2: Vanádio (23V):
Ordem energética da distribuição eletrônica do 23V: 1s2, 2s2, 2p6,3s2, 3p6, 4s2 e 3d3.
 Observe que, nesse exemplo, no último subnível preenchido (3d) cabiam 10 elétrons; porém, apenas 3 foram necessários para completar o número atômico.
Observe que, nesse exemplo, no último subnível preenchido (3d) cabiam 10 elétrons; porém, apenas 3 foram necessários para completar o número atômico.
 Como podemos observar no diagrama de Linus Pauling acima, um átomo apresenta sete níveis de energia (1 a 7). Quando realizamos a distribuição eletrônica, a camada de valência será sempre a última. Veja os exemplos a seguir:
Como podemos observar no diagrama de Linus Pauling acima, um átomo apresenta sete níveis de energia (1 a 7). Quando realizamos a distribuição eletrônica, a camada de valência será sempre a última. Veja os exemplos a seguir:
Exemplo 1: Átomo de sódio (11Na)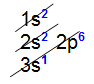 Analisando a distribuição eletrônica acima, é possível constatar que a camada de valência (o nível mais afastado do núcleo) é o terceiro nível e apresenta um elétron (no subnível s).Exemplo 2: Átomo de germânio (32Ge)
Analisando a distribuição eletrônica acima, é possível constatar que a camada de valência (o nível mais afastado do núcleo) é o terceiro nível e apresenta um elétron (no subnível s).Exemplo 2: Átomo de germânio (32Ge)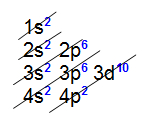 Analisando a distribuição acima, é possível constatar que a camada de valência (nível mais afastado do núcleo) é o quarto nível e possui quatro elétrons (nos subníveis s e p).Exemplo 3: Átomo de urânio (92U)
Analisando a distribuição acima, é possível constatar que a camada de valência (nível mais afastado do núcleo) é o quarto nível e possui quatro elétrons (nos subníveis s e p).Exemplo 3: Átomo de urânio (92U).jpg) Analisando a distribuição eletrônica do urânio, é possível constatar que a camada de valência é o sétimo nível e apresenta dois elétrons (no subnível s).
Analisando a distribuição eletrônica do urânio, é possível constatar que a camada de valência é o sétimo nível e apresenta dois elétrons (no subnível s).
24ª Aula
28 setembro
Recuperação de Aprendizagem
Números Quânticos

Os elétrons são representados pelo seu conteúdo de energia, indicado pelos números quânticos
O Princípio da Incerteza de Werner Heisenberg (1901-1976), criado em 1926, estabeleceu que não é possível calcular a posição e a velocidade de um elétron em um mesmo instante, ou seja, quanto maior for a precisão da determinação da medida da posição do elétron, menor será a precisão da medida de sua velocidade e vice-versa.Por isso, os cientistas passaram a adotar o conceito de “orbital”, que se refere à região no espaço ao redor do núcleo do átomo onde é maior a probabilidade de se encontrar determinado elétron. No modelo de orbitais, o elétron tem característica dual, isto é, como onda-partícula que se desloca no espaço, mas que está dentro de uma região (orbital) ao redor do núcleo, como uma nuvem eletrônica.Esse movimento do elétron passou a ser descrito por Erwin Schrödinger por meio de uma equação matemática que associava a natureza corpuscular do elétron, ou seja, sua natureza como partícula, sua energia, carga e massa.
Durante o processo algébrico da solução da equação de Schrödinger, surgiram naturalmente códigos matemáticos relacionados com a energia do elétron, que são denominados de números quânticos.Existem quatro números quânticos: número quântico principal (n), número quântico secundário ou azimutal (l), número quântico magnético (m ou ml) e número quântico spin (s ou ms).O conjunto de números quânticos nunca se repete para dois elétrons em um átomo. Portanto, esse conjunto de números quânticos serve para identificar cada elétron na eletrosfera de um átomo. Então, vejamos como determinar cada um:1. Número quântico principal (n): Refere-se ao nível de energia do elétron.Segundo o modelo atômico de Rutherford-Bohr, os elétrons movimentam-se ao redor do núcleo em órbitas circulares com quantidades de energia bem definidas e características, sendo, portanto, chamadas de níveis de energia ou camadas eletrônicas. Para os elementos conhecidos até o momento, a quantidade máxima de níveis de energia são sete, sendo representados pelas letras K, L, M, N, O, P e Q, indo da camada mais próxima ao núcleo para a mais distante. Essas camadas correspondem respectivamente aos números 1, 2, 3, 4, 5, 6 e 7.Assim, os valores de n variam de 1 a 7, de acordo com o nível de energia do elétron. Quanto maior o número quântico principal, maior é a energia do elétron.
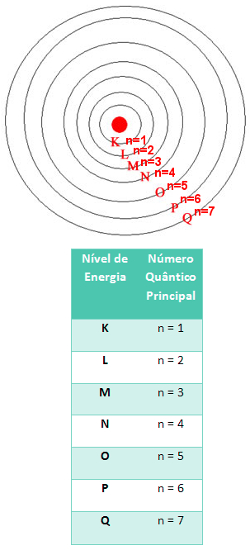
Relação entre o nível de energia e o número quântico principal2. Número quântico secundário ou azimutal (l): Refere-se ao subnível de energia do elétron.Conforme explicado no texto Distribuição eletrônica, os elétrons distribuem-se nas camadas eletrônicas de acordo com subníveis de energia, que são identificados pelas letras s, p, d, f, que aumentam de energia nessa ordem. Cada nível comporta uma quantidade máxima de elétrons distribuídos nos subníveis de energia.Para os elementos até então conhecidos, temos apenas quatro tipos de subníveis:
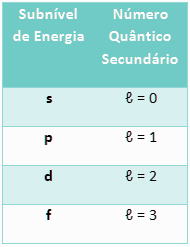
Tabela da relação entre o subnível de energia e o número quântico secundário Isso significa que, para um número quântico principal n, o número quântico secundário será l = n – 1.
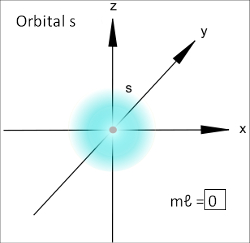
3. Número quântico magnético (m ou ml): Refere-se à orientação dos orbitais no espaço.
O orbital do tipo s possui forma esférica e, portanto, só há uma orientação possível para ele. Desse modo, só haverá um valor possível para o número quântico magnético, que será igual a 0:
Representação do orbital s
Veja que o orbital é representado por um quadrado.
Em relação ao subnível do tipo p, conforme a figura abaixo indica, existem três orientações espaciais possíveis, porque ele apresenta-se na forma de um duplo ovoide. Então, para o subnível p, há três números magnéticos possíveis, -1, 0, +1, que são representados
por três quadradinhos: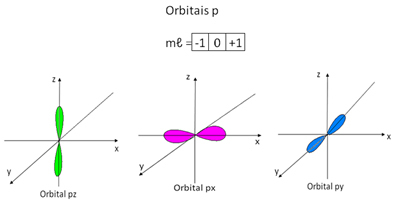
Representação dos orbitais p
Já o subnível d possui cinco orientações espaciais possíveis, sendo que o número magnético pode apresentar os seguintes valores: -2, -1, 0, +1, +2:
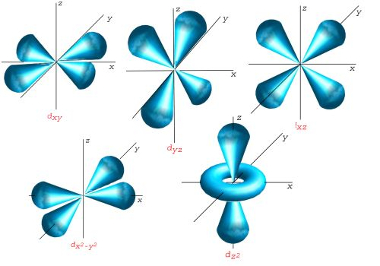
Representação dos orbitais d
Por fim, o subnível f possui sete orientações espaciais possíveis, sendo que o número magnético pode apresentar os seguintes valores: -3, -2, -1, 0, +1, +2, +3: Representação dos orbitais f*Desse modo, temos as seguintes possibilidades:

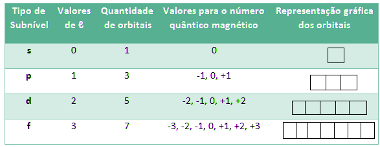
Tabela da relação entre orbitais e o número quântico magnéticoEsses orbitais costumam ser representados de acordo com um diagrama energético, como o mostrado a seguir, em que cada “escada” corresponde ao nível e cada “degral” corresponde ao subnível.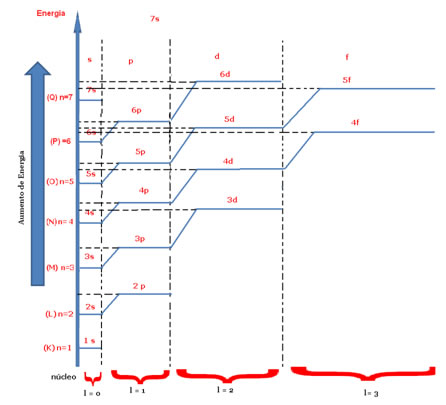
Diagrama energético indicando o número quântico magnético
4. Número quântico spin (s ou ms): Refere-se ao sentido da rotação (no inglês, spin significa rotação) do elétron.Dois elétrons conseguem ficar em um mesmo orbital e não se repelirem porque eles giram em sentidos opostos, o que causa uma força magnética de atração. Assim, o magnetismo em razão do spin de um elétron é anulado pelo magnetismo do spin oposto, ficando um sistema estável.É por isso que cada orbital possui no máximo dois elétrons com spins opostos, que são simbolizados por setas.
Isso é dito pelo Princípio da Exclusão de Pauli.Por convenção, adotamos o seguinte: a seta para cima corresponde a ms= -1/2, e a seta para baixo corresponde a ms= +1/2.ms = -1/2 ou +1/2
ms = ↑ ou ↓Segundo a Regra de Hund ou Regra de máxima multiplicidade, o preenchimento dos orbitais de um subnível deve ser feito de uma forma que contenha o maior número possível de elétrons desemparelhados (isolados). Por isso, temos que preencher primeiro os orbitais (quadradinhos), colocando somente as setas para cima, e depois voltamos preenchendo as setas para baixo.
Vejamos um exemplo:Indique os quatro números quânticos para o elétron mais energético do Cobre (Z = 29):Resolução:Primeiro realizamos a distribuição eletrônica no Diagrama de Pauling dos 29 elétrons do cobre:
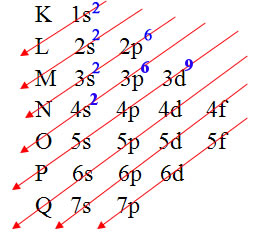 Distribuição eletrônica do cobre no diagrama de Pauling
Distribuição eletrônica do cobre no diagrama de Pauling
Veja que o subnível mais energético é o último a ser preenchido, ou seja, o 3d9.
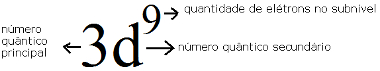
Subnível mais energético do cobre e sua relação com os números quânticos*O nível é o M, ou seja, o número principal é: n =3.
*O subnível é o d, então, o número quântico secundário é: l = 2.
* Visto que são nove (9) elétrons e queremos saber o do nono elétron, que foi o último a ser preenchido e que é o mais energético, vamos realizar a distribuição deles nos orbitais para descobrir o número quântico magnético e o spin.
Lembrando que primeiro vamos preencher com todas as setas para cima e depois preencher com as setas para baixo:
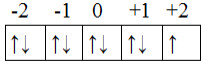
Distribuição eletrônica nos orbitais do subnível mais energético do cobreA última seta a ser preenchida, que é o elétron mais energético, ficou no +1, então, o valor do número quântico magnético é: ml = +1.*Visto que a seta está para baixo, por convenção, adotamos que o número quântico spin é: ms = +1/2.
* Crédito da imagem: Autor: CK-12 Foundation/ Extraído de: Wikimedia Commons
No ano de 1913, o dinamarquês especialista em física atômica Niels Bohr (1885-1962) estabeleceu o modelo atômico sistema planetário que é usado atualmente.Bohr chegou a esse modelo baseando-se no dilema do átomo estável. Ele acreditava na existência de princípios físicos que descrevessem os elétrons existentes nos átomos. Esses princípios ainda eram desconhecidos e graças a esse físico passaram a ser usados.
Bohr iniciou seus experimentos admitindo que um gás emitia luz quando uma corrente elétrica passava nele. Isso se explica pelo fato de que os elétrons, em seus átomos, absorvem energia elétrica e depois a liberam na forma de luz. Sendo assim, ele deduziu que um átomo tem um conjunto de energia disponível para seus elétrons, isto é, a energia de um elétron em um átomo é quantizada.
Esse conjunto de energias quantizadas mais tarde foi chamado de níveis de energia.Com essas conclusões Bohr aperfeiçoou o modelo atômico de Rutherford e chegou ao modelo do átomo como sistema planetário, onde os elétrons se organizam na eletrosfera na forma de camadas.
Conceito de Bohr: Os elétrons estão distribuídos em camadas ao redor do núcleo. Existem 7 camadas eletrônicas, representadas pelas letras maiúsculas: K, L, M, N, O, P e Q. À medida que as camadas se afastam do núcleo, aumenta a energia dos elétrons nelas localizados.As camadas da eletrosfera representam os níveis de energia da eletrosfera.
Assim, as camadas K, L, M, N, O, P e Q constituem os 1º, 2º, 3º, 4º, 5º, 6º e 7º níveis de energia, respectivamente.A partir dessa descrição, é fácil deixar-se induzir por uma concepção de um modelo que lembra a órbita de um planeta, com elétrons orbitando ao redor do “núcleo-sol”.As hipóteses postuladas por Niels Bohr foram as seguintes:
1 Os elétrons não podem assumir qualquer valor de energia, mas apenas alguns valores bem determinados. Logo, os elétrons não podem orbitar a qualquer distância do núcleo, mas apenas em algumas distâncias permitidas, nas quais não perdem energia.
2- Um elétron pode saltar para uma órbita menos energética liberando um photon, cuja energia corresponde à diferença entre a energia das órbitas final e inicial. Analogamente, um elétron pode saltar para uma órbita mais energética absolvendo um photon se a energia deste for igual à diferença energética entre uma das órbitas permitidas e a órbita inicial do elétron.
O fenômeno da incandescência, estudado por Kirchhoff entre outros, consiste na emissão de luz pelos corpos ao serem aquecidos. Através de várias experiências, ficou claro que a freqüência da luz emitida pelo corpo aquecido era independente da substância desse corpo, ela dependia apenas da temperatura.Aumentando-se então gradativamente a temperatura do corpo, a cor da luz emitida, sendo esta característica relacionada com a freqüência da luz, também se modificava gradativamente. Se fotografássemos todo o processo, obteríamos um espectro contínuo, com todas as freqüências existentes.Mas algo de estranho ocorria quando o corpo aquecido consistia numa substância pura, como um gás de Hidrogênio por exemplo.Neste caso, as leis da incandescência não eram aplicáveis: se a determinada temperatura o gás de Hidrogênio emitia uma luz de determinada cor, aumentando um pouco essa temperatura, a cor da luz emitida não se modificava, a freqüência da luz emitida permanecia a mesma; até que, aquecendo mais o corpo até certo grau, a cor da luz emitida era bruscamente alterada. A luz emitida não se modificava de forma contínua, mas de forma discreta e o gás emitia apenas luz de algumas freqüências bem determinadas, formando com isso um espectro descontinuo, com apenas algumas riscas coloridas correspondente a apenas algumas freqüências de luz. Esse fato era até então inexplicável, não se sabia porque os gases puros se comportavam de forma tão diferente das substancias compostas.
A teoria de Bohr permitiu elucidar o mistério…A sua teoria explicou totalmente o fato: as freqüências dos photons emitidos pelos elétrons do gás de Hidrogênio, quando eles saltam para uma órbita de menor corresponde exatamente com a freqüência da luz que aparece no espectro desse gás! Por isso que o gás não emite todas as cores, pois que somente alguns saltos eletrônicos são possíveis. Obviamente, numa substancia quimicamente complexas, o número de frequências permitidas é tão grande que o tratamos como continuo… Este foi um dos grandes triunfos do modelo de Niels Bohr. E fez com que sua teoria ganhasse bastante credibilidade na época de sua publicação, apesar de Bohr não justificar a origem das suas hipóteses…Pela teoria de Bohr, as órbitas possíveis (ou os níveis energéticos), foram representadas pelas letras:K, L, M, N, O, P, Q…Porém, mais tarde verificou-se que para os outros elementos, o espectro obtido experimentalmente não era o previsto: ao invés de aparecer uma única raia no espectro para cada nível energético, aparecia duas ou mais linhas muito próximas, o que não era esperado pela teoria. Logo, a teoria de Niels Bohr necessitava também de ser reparada… Foi o que fez

Exercícios Sobre Distribuição Eletrônica
A distribuição eletrônica é como os elétrons estão distribuídos nas camadas de energia ao redor do núcleo do átomo, e um modo de descobrir é usar o diagrama de Pauling.
Questão 1
A distribuição eletrônica do bário (Z=56) na ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12
d) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f10
Questão 2
Ao se realizar a distribuição eletrônica do titânio, que possui número atômico igual a 22, descobre-se que o seu subnível mais energético e os elétrons distribuídos nele são dados por:
a) 3p3
b) 3p5
c) 4s2
d) 3d2
e) 4p6
- Questão 3 Qual a distribuição eletrônica em camadas do átomo 2656Fe?
a) 2 – 8 – 10 – 2.
b) 2 – 8 – 12.
c) 2 – 8 – 8 – 4.
d) 2 – 8 – 18 – 18 – 8 – 2.
e) 2 – 8 – 14 – 2.
- Questão 4
(Unifor-CE) O átomo de um elemento químico tem 14 elétrons no 3º nível energético (n = 3). O número atômico desse elemento é:
a) 14
b) 16
c) 24
d) 26
e) 36
- Questão 5 (FEI-SP) A configuração eletrônica de um átomo neutro no estado fundamental é 1s2 2s2 2p6 3s2 3p5. O número de orbitais vazios remanescentes no nível principal M é:
a) 0
b) 1
c) 5
d) 6
e) 10
- Questão 6
(Unaerp) O fenômeno da supercondução de eletricidade, descoberto em 1911, voltou a ser objeto da atenção do mundo científico com a constatação de Bednorz e Müller de que materiais cerâmicos podem exibir esse tipo de comportamento, valendo um prêmio Nobel a esses dois físicos em 1987. Um dos elementos químicos mais importantes na formulação da cerâmica supercondutora é o ítrio:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d1. O número de camadas e o número de elétrons mais energéticos para o ítrio, serão, respectivamente:
a) 4 e 1.
b) 5 e 1.
c) 4 e 2.
d) 5 e 3.
e) 4 e 3.
Respostas
-
- Resposta Questão 1
Alternativa “b”.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2
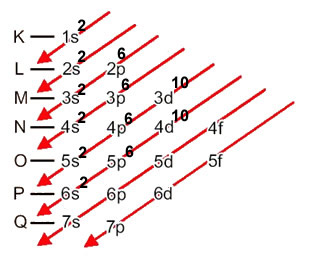
Distribuição eletrônica do bário no diagrama de Pauling
- Resposta Questão 1
-
- Resposta Questão 2
Alternativa “d”.
A distribuição eletrônica do titânio em ordem energética crescente é: 1s2 2s22p6 3s2 3p6 4s2 3d2. Portanto, o seu subnível mais energético é o último a ser preenchido: 3d2:
Distribuição eletrônica do titânio no diagrama de PaulingApenas para tirar quaisquer dúvidas, o subnível 4s2 é o mais externo e não o mais energético.
- Resposta Questão 2
-
- Resposta Questão 3
Alternativa “e”.
Pelo diagrama mostrado logo mais abaixo, você poderá ver que em cada camada a quantidade de elétrons é:
1ª camada: K = 2;
2ª camada: L = 8;
3ª camada: M = 14;
4ª camada: N = 2;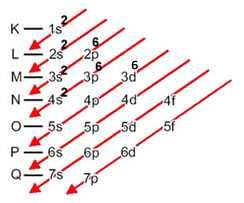
Distribuição eletrônica do ferro
- Resposta Questão 3
-
- Resposta Questão 4
Alternativa “d”.
O 3º nível energético é M, então, basta realizar a distribuição eletrônica, seguindo a ordem dada pelas setas, até que haja 14 elétrons nesse nível (2 + 6 + 6):

Distribuição eletrônica de 14 elétrons no terceiro nível do diagrama de PaulingSomando todos os elétrons distribuídos, temos que o total é igual a 26.
- Resposta Questão 4
-
- Resposta Questão 5
Alternativa “c”.
O nível M é o terceiro, então, se olharmos esse nível, temos que os orbitais 3s e 3p estão preenchidos com elétrons, restando os 5 vazios do subnível 3d:
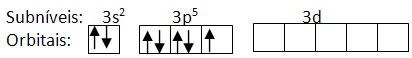
Subníveis e orbitais do nível MResposta Questão 6
Alternativa “b”.
Pela distribuição eletrônica mostrada no enunciado (1s2 2s2 2p6 3s2 3p6 4s23d10 4p6 5s2 4d1), vemos que os elétrons foram distribuídos até a camada 5 (5s2). Visto que essa distribuição já está na ordem energética crescente, o subnível mais energético é o 4d que possui 1 elétron.
- Resposta Questão 5
Forças intermoleculares
Forças intermoleculares são as forças exercidas para manter unidas duas ou mais moléculas.
Elas correspondem a ligações químicas que têm a função de unir ou repelir as moléculas de um composto.
As forças intermoleculares provocam estados físicos diferentes nos compostos químicos. Essa interação pode ser mais ou menos forte, conforme a polaridade das moléculas.
Classificação
As forças intermoleculares são classificadas em três tipos que variam conforme a intensidade:
- Ligação de Hidrogênio: Ligação de forte intensidade.
- Dipolo Permanente ou dipolo-dipolo: Ligação de média intensidade.
- Dipolo Induzido ou Forças de London: Ligação de fraca intensidade.
O conjunto das forças intermoleculares também pode ser chamado de Forças de Van der Waals.
Ligação de Hidrogênio
A ligação ou ponte de hidrogênio ocorre em moléculas polares que têm o hidrogênio unido a elementos com volume atômico baixo e eletronegativos, como o oxigênio (O), Flúor (F) e Nitrogênio (N).
É a força intermolecular mais forte, pois existe uma grande diferença de eletronegatividade entre os elementos.
Um exemplo de ligação de hidrogênio ocorre na molécula de água (H2O).
Dipolo-dipolo
O dipolo-dipolo ocorre entre as moléculas dos compostos polares e é considerada uma interação de força intermediária. Nesse caso, o hidrogênio não interage diretamente com F, N e O.
Os elétrons estão distribuídos de forma assimétrica e assim o elemento mais eletronegativo atrai os elétrons para si.
Nas ligações dipolo-dipolo as moléculas polares interagem de maneira que os polos opostos sejam preservados.
Dipolo induzido
O dipolo induzido é constituído pela atração não gravitacional que ocorre entre todas as moléculas apolares e polares.
Os elétrons estão distribuídos de forma uniforme e não há formação de dipolo elétrico. Porém, quando as moléculas se aproximam induzem a formação de dipolos temporários.
Forças intermoleculares x Forças intramoleculares
É importante saber que as forças intermoleculares são um tipo de ligação química. As demais são as “forças intramoleculares”.
Assim, as forças intermoleculares são exercidas entre as moléculas e as intramoleculares no interior das moléculas.
As forças intramoleculares são:
Iônica
A ligação iônica é considerada uma ligação química forte. Ela é produzida pela atração eletrostática entre íons de cargas diferentes (+ e -). Consiste na relação estabelecida entre metal e não-metal por meio da transferência de elétrons.
As forças que produzem a ligação covalente resultam na partilha de pares de elétrons entre dois átomos de não-metais.
A maior parte dos compostos covalentes tem pontos de ebulição e fusão baixos, são pouco solúveis em água e dissolvem-se com facilidade em solventes apolares.
Metálica
A ligação metálica resulta das forças exercidas no interior das moléculas de substâncias metálicas.
Os metais têm poucos elétrons de valência, sendo bons condutores de eletricidade, calor e refletem a radiação.
Exercícios
1. Enem (2011/ Questão 58/ prova branca) A pele humana, quando está bem hidratada, adquire boa elasticidade e aspecto macio e suave. Em contrapartida, quando está ressecada, perde sua elasticidade e se apresenta opaca e áspera.
Para evitar o ressecamento da pele é necessário, sempre que possível, utilizar hidratantes umectantes, feitos geralmente à base de glicerina e polietilenoglicol:
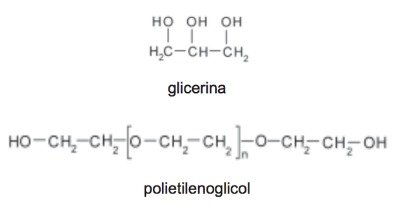
A retenção de água na superfície da pele promovida pelos hidratantes é consequência da interação dos grupos hidroxila dos agentes umectantes com a umidade contida no ambiente por meio de:
a) ligações iônicas
b) forças de London
c) ligações covalentes
d) forças dipolo-dipolo
e) ligações de hidrogênio
Alternativa e) ligações de hidrogênio.
2. (UERJ-1997) Água e etanol são dois líquidos miscíveis em quaisquer proporções devido a ligações intermoleculares, denominadas:
a) iônicas.
b) pontes de hidrogênio.
c) covalentes coordenadas.
d) dipolo induzido – dipolo induzido.
e) dipolo permanente
Alternativa b) pontes de hidrogênio.
3. (Vunesp-2003) Pode-se verificar que uma massa de água ocupa maior volume no estado sólido (gelo) do que no estado líquido. Isto pode ser explicado pela natureza dipolar das ligações entre os átomos de hidrogênio e oxigênio, pela geometria da molécula de água e pela rigidez dos cristais. As interações entre as moléculas de água são denominadas
a forças de Van der Waals.
b) forças de dipolo induzido.
c) forças de dipolo permanente.
d) pontes de hidrogênio.
e) ligações covalentes.
25ª Aula
05 de outubro
A Teoria dos Octetos
A teoria de Bohr-Sommerfeld permitiu a Kossel e Lewis estabelecerem uma teoria para explicar a estabilidade dos átomos e também a maneira pela qual eles se ligam para formarem moléculas, esta teoria foi denominada teoria dos octetos.Ela se baseia em três princípios fundamentais:
Um átomo apenas se torna estável quando o seu último nível energético possuir 8 elétrons
Os elétrons preenchem primeiramente os níveis de menor energia
Um átomo não pode possuir mais do que 8 elétrons no seu último nível energético.
Estas três leis, explicam porque os átomos se ligam para formarem substâncias, pois somente possuindo 8 elétrons na sua ultima camada, o átomo adquire estabilidade, por exemplo: o Hidrogênio possui 1 elétron, e o Oxigênio possui 6 elétrons, então, dois átomos de Hidrogênio devem se unir a um átomo de Oxigênio para formar assim uma molécula de água (H2O). Veja que desta forma a molécula possuirá 8 elétrons no seu último nível energético, e estará estável… A partir destas teorias, Mendelev conseguiu elaborar a tabela periódica dos elementos, e relacionar as características das substâncias com as suas semelhanças atômicas.
Ligações Químicas
Basicamente, duas forças de naturezas distintas atuam no interior da matéria: são as forças intermoleculares, isto é, entre moléculas, e as forças intramoleculares, que agem no interior dessas moléculas, entre dois ou mais átomos.
As forças intermoleculares podem ser descritas, sucintamente, como Pontes de Hidrogênio ou Forças de Van der Waals.
As forças intramoleculares são as famosas ligações químicas, que podem ser do tipo iônico, covalente ou metálico. O propósito deste texto é abordar aspectos referentes às forças intramoleculares, isto é, referentes às ligações químicas.Sem nenhuma dúvida, ainda hoje as forças que atuam entre átomos representam um dos aspectos mais intrigantes de todo o estudo da química.
Destas forças, as mais fortes são as ligações químicas, responsáveis pela união estável de átomos, resultando na formação de moléculas, sendo estas as bases constituintes de toda matéria que conhecemos.As ligações químicas representam interações entre dois ou mais átomos, interações essas que podem ocorrer por doação de elétrons, compartilhamento de elétrons ou ainda deslocalização de elétrons.
Cada um desses processos é caracterizado por uma denominação de ligação química. É importante, entretanto, salientar que a grande maioria das ligações não ocorre de modo a pertencer 100% a um determinado grupo.
O que ocorre é determinada ligação apresentar propriedades intermediárias a um e a outro grupo. Mas esse aspecto intermediário raramente é abordado na literatura química, sendo utilizada a classificação predominante para a ligação química em questão.
De modo geral, como fora mencionado, pode ocorrer a doação e o recebimento de elétrons entre dois átomos, caracterizando uma ligação denominada de Ligação Iônica.
Nessa ligação, predominam as forças eletrostáticas que atraem os íons de cargas opostas.
A ligação iônica é a responsável pela formação de compostos iônicos, e ocorre entre um átomo metálico e um átomo não metálico, com doação de elétrons por parte do primeiro e recebimento de elétrons por parte do segundo.
Quando se combinam dois átomos que possuem um mesma tendência de ganhar e perder elétrons, ocorre então a formação de uma Ligação Covalente.
Sob essas condições, não ocorre uma transferência total de elétrons. Nesse processo, ocorre um compartilhamento de elétrons, aos pares. A ligação covalente, sempre entre dois átomos não metálicos, forma os compostos de natureza molecular, de modo a constituir uma molécula de natureza polar (ligação entre dois átomos diferentes) ou apolar (entre dois átomos iguais).
Já a Ligação Metálica traz um processo distinto. Os elétrons distribuem-se sobre núcleos positivos de átomos metálicos, formando uma nuvem eletrônica sobre toda estrutura da matéria formada, sendo esta a responsável pelas propriedades metálicas da matéria constituída.
Referências:
PERUZZO, Francisco Miragaia (Tito); CANTO, Eduardo Leite; Química na Abordagem do Cotidiano, Ed. Moderna, vol.1, São Paulo/SP- 1998.
SARDELLA, Antônio; MATEUS, Edegar; Curso de Química: química geral, Ed. Ática, São Paulo/SP – 1995.SITUAÇÃO DE APRENDIZAGEM 1
FORÇAS DE INTERAÇÃO ENTRE PARTÍCULAS QUE COMPÕEM OS ESTADOS SÓLIDO, LÍQUIDO E GASOSO
Conteúdos e temas: interações entre íons, átomos e moléculas: volatilidade, temperaturas de fusão e de ebulição e forças de interação.
Competências e habilidades: construir e interpretar o conceito de forças interpartículas, relacionando-as às propriedades das substâncias iônicas, moleculares e metálicas; aplicar os conhecimentos adquiridos em situações do cotidiano que envolvem diferentes tipos de interação.
Sugestão de avaliação: questões propostas; elaboração de texto; busca em fontes de informação;
apresentação de seminários; atividade-síntese.Será que as moléculas, quando próximas exercem algum tipo de força?A resposta é sim, átomos e moléculas por possuírem um campo magnético, exercem uma força sobre as outras.Então agora vamos entender exatamente que tipo de força é essa.Bons estudos!!!!!!!E nosso planeta, a água encontra-se nos estados sólido, líquido e gasoso. A água doce disponível (no máximo 0,3% de toda a água do planeta) já teria sido totalmente consumida se não fosse o ciclo hidrológico, que envolve, sob a ação da energia solar, o movimento contínuo das águas, distribuindo-as em diferentes regiões do planeta: estado sólido nas geleiras e calotas polares; no estado líquido nos oceanos, mares, rios, lençóis freáticos etc.; estado gasoso (vapor-d´ água) na atmosfera. Esse movimento se dá por meio de transformações, algumas envolvendo mudanças de fase- como evaporação, a transpiração e a condensação- que culminam com a precipitação da água, na forma de chuva, e sua infiltração nas camadas subterrâneas do solo. Esses processos estão representados a seguir:Força intermolecular quando duas moléculas se aproximam há uma interação de seus campos magnéticos o que faz surgir uma força entre elas. É o que chamamos de força intermolecular.Essas forças variam de intensidade, dependendo do tipo da molécula (polar ou apolar).Polaridade, essa propriedade depende da eletronegatividade dos átomos envolvidos na ligação, ou seja, da capacidade que o átomo tem de atrair para si o par de elétrons que ele compartilha com outro átomo em uma ligação covalente.
Tabela de eletronegatividade Lembrando que o menor valor é o mais eletropositivo
| Elementos | Eletronegatividade |
| F | 3,98 |
| O | 3,44 |
| Cl | 3,16 |
| N | 3,04 |
| Br | 2,96 |
| I | 2,66 |
| S | 2,58 |
| C | 2,55 |
| Metais Nobres | 2,54 a 2,28 |
| H | 2,20 |
| P | 2,19 |
| Semi-metais | 2,04 a 1,18 |
| Metais Comuns | 2,20 a 0,79 |
| Fr | 0,70 |
Eletronegatividade: É a tendência que um átomo tem de atrair elétrons. É muito característico dos não-metais. Linus Pauling, através de experimentos, tentou quantificar esta tendência e criou uma escala de eletronegatividade. Na tabela periódica, os gases nobres não são considerados, já que não tem tendência a ganhar ou perder elétrons. Já estão estabilizados.
Eletropositividade: É a tendência que um átomo tem de perder elétrons. É muito característico dos metais. Pode ser também chamado de caráter metálico. É o inverso da eletronegatividade.
Os gases nobres também não são considerados, por conta da sua estabilidade.No caso das moléculas orgânicas, todas as ligações entre seus átomos são covalentes, por isso, precisamos analisar a diferença de eletronegatividade entre os átomos das ligações para determinar se as moléculas são polares ou apolares.
Quando a molécula for diatômicas, formadas por átomos iguais, elas exerceram a mesma força não havendo formação de polos, anulando seus vetores, neste caso será uma molécula apolar.Em uma situção que os átomo são diferentes, o átomo mais eletronegativa exercerá uma força, onde o outro átomo será eletropositivo, ou seja cargas parciais diferentes. Então teremos uma molécula polar.Exemplo:A imagem descreve que o átomo de Cloro é mais eletronegativo que o Hidrogênio.Exemplo de apolar.A molécula do BF3 apresenta 3 ligações polares, com os vetores direcionados para o flúor, que é o elemento mais eletronegativo. A geometria trigonal plana da molécula confere uma distribuição eletrônica simétrica ao redor do boro caracterizando a molécula como apolar, já que os três vetores se anulam.A molécula do dióxido de carbono CO2 é linear, e as ligações entre os átomos de carbono e oxigênio são polares, porém os vetores que definem o momento dipolar se anulam e a molécula é apolar.
O← C → CExistem três tipos de interações intermoleculares. Elas servem somente para as substâncias que possuem ligações covalentes. São elas:
– Pontes de Hidrogênio ou Ligações de Hidrogênio;
– Forças dipolo-dipolo, dipolo-permanente ou dipolar;
– Forças de London, Forças de Van der Waals ou dipolo-induzido.Pontes de HidrogênioUma conseqüência das pontes de hidrogênio que existem na água é a sua elevada tensão superficial. As moléculas que estão no interior do líquido atraem e são atraídas por todas as moléculas vizinhas, de tal modo que as essas forças se equilibram. Já as moléculas da superfície só são atraídas pelas moléculas de baixo e dos lados.Exemplo: A tensão superficial explica alguns fenômenos, como por exemplo, o fato de alguns insetos caminharem sobre a água e a forma esférica das gotas de água.Esta interação intermolecular pode ser chamada também de Ligações de Hidrogênio. É realizada sempre entre o hidrogênio e um átomo mais eletronegativo, como flúor, oxigênio e nitrogênio.
Dipolo-Dipolo
Esta interação intermolecular pode ser chamada também de dipolo-permanente ou dipolar.
Ocorre em polares. É menos intensa que as pontes de hidrogênio.Quando a molécula é polar, há de um lado um átomo mais eletropositivo e do outro, um átomo mais eletronegativo.Estabelece-se de modo que a extremidade negativa do dipolo de uma molécula se oriente na direção da extremidade positiva do dipolo de outra molécula.Assim:
Exemplos:
HCl, HBr, HI
Forças de LondonEsta interação intermolecular pode ser chamada também de dipolo-induzido ou Forças de Van der Waals.
É a interação mais fraca de todas e ocorre em moléculas apolares. Neste caso, não há atração elétrica entre estas moléculas. Deveriam permanecer sempre isolados e é o que realmente acontece porque, em temperatura ambiente, estão no estado gasoso.São cerca de dez vezes mais fracas que as ligações dipolo-dipolo.A molécula mesmo sendo apolar, possui muitos elétrons, que se movimentam rapidamente. Pode acontecer, em um dado momento, de uma molécula estar com mais elétrons de um lado do que do outro. Esta molécula estará, portanto, momentaneamente polarizada e por indução elétrica, ira provocar a polarização de uma molécula vizinha (dipolo induzido), resultando uma fraca atração entre ambas. Esta atração é a Força de London.Exemplos: Cl2, CO2, H2
Aproveite para conferir nossas videoaulas sobre o assunto:


